副干酪乳杆菌产γ-氨基丁酸的发酵培养基优化
2019-11-07王欣悦赵保堂杨富民
张 俊,王 勇,张 锋,王欣悦,王 娇,赵保堂,杨富民*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.庆阳质量检验检测研究院,甘肃 庆阳 745000;3.甘肃省分析测试中心,甘肃 兰州 730000)
副干酪乳杆菌(Lactobacillusparacasei)属于乳杆菌属,是一种革兰氏阳性异型发酵乳酸菌[1]。副干酪乳杆菌具有平衡肠道菌群、抑菌、降血压、抗肿瘤、抗氧化、降胆固醇等多种益生特性,其产γ-氨基丁酸性能更吸引人们的关注[2]。γ-氨基丁酸(γ-aminobutyric acid ,GABA)是一种由4个碳原子构成的非蛋白氨基酸[3-4]。其作为一种抑制性神经递质,具有调节血压、抗惊厥、促进精神安定等作用[5-6],在预防和治疗癫痫、活化肾肝、抗炎等方面具有良好的效果[7-10]。因GABA在天然食物中含量较低,目前主要通过化学合成法、植物富集法、微生物发酵法生产GABA[11-12]。微生物发酵法生产GABA具有产率高、操作简便、食用安全、污染小等优势,使其近年来成为关注与研究热点[13-15]。研究人员将GABA作为一种新型添加剂应用于食品中[16]。目前,提升乳酸菌产GABA含量备受人们的关注[17]。Li等[18]对乳酸芽孢杆菌NCL912产GABA的培养基进行了优化,最终使得GABA的产量达到了345.83 mmol/L。本研究以从传统牦牛酸奶中筛选出的具有抗氧化性的副干酪乳杆菌为研究对象,研究其产γ-氨基丁酸的生长条件,旨在为副干酪乳杆菌高产GABA提供依据,并拓宽该菌株的应用范围。
1 材料与方法
1.1 材料与试剂
副干酪乳杆菌;L-谷氨酸钠,上海中秦化学试剂有限公司;GABA标准品,上海源叶生物科技有限公司;三氯乙酸、柠檬酸混合液、MRS培养基成分;以上试剂均为分析纯。
1.2 仪器与设备
紫外可见分光光度计UV759(PC),上海悦丰仪器仪表有限公司;pH计、精密天平,上海精密科学仪器有限公司;高速台式离心机,北京时代北利离心机有限公司;氨基酸自动分析仪,日本日立LA8080。
1.3 方法
1.3.1 培养基配制
1.3.1.1 MRS培养基
蛋白胨10 g/L,牛肉膏10 g/L,葡萄糖20 g/L,酵母膏8 g/L,硫酸镁2 g/L,硫酸锰0.05 g/L,磷酸氢二钾2 g/L,柠檬酸三铵2 g/L,无水乙酸钠5 g/L,1 mL吐温-80。
1.3.1.2 初始培养基
酵母浸粉10 g/L,无水乙酸钠2 g/L,蛋白胨5 g/L,葡萄糖10 g/L,L-谷氨酸钠5 g/L,维生素B6 2 mmol/L。
1.3.2 样品前处理
参考窦海艳[19]的方法,菌液静培72 h。培液经5 000 r/min离心20 min,取上清液后添加10%的三氯乙酸,并以10 000 r/min离心5 min,液体经0.22 μm(水相)过滤备用。
1.3.3 培养基单因素试验
以初始培养基为标准,采用比色法测定GABA。碳源选择葡萄糖、麦芽糖、蔗糖、乳糖、麦芽糊精、果糖;氮源选择蛋白胨、酪蛋白胨、胰蛋白胨、酸水解蛋白、大豆蛋白;无机盐选择氯化钙、硫酸镁、硫酸锰、磷酸氢二钾、氯化钠;前体物质(L-谷氨酸钠)质量浓度为1、2、3、4、5 g/L;接种量设置为1%、2%、3%、4%、5%、6%、7%、8%;pH值设置为4.0、4.5、5.0、5.5、6.0、6.5;温度设置为33、35、37、39、41 ℃。
1.3.4 Plackett-Burman与响应面法试验
根据单因素试验,选择碳源、氮源、无机盐、pH值、接种量、温度、底物浓度,进行PB试验,进一步筛选后采用Box-Behnken软件设置中心组合实验,确定培养基的最佳组合。
1.3.5 GABA含量测定
1.3.5.1 比色法测定GABA
参考窦海艳等的研究[19-21]方法并改进,取0.4 mL处理液,依次加入0.5 mL硼酸缓冲液(pH=9.0)、1 mL 10%苯酚、0.1 mL碳酸钠、0.3 mL次氯酸钠。沸水浴10 min、冰浴20 min后,加2 mL 60%的无水乙醇,混匀后静置30 min。于640 nm处测定吸光度值。
1.3.5.1.1 苯酚浓度与次氯酸钠溶液对GABA测定的影响
取5 mmol/L的GABA标准混合液0.4 mL。分别添加2%、4%、6%、8%、10%、12%、14%、16%与18%的苯酚,其余测定条件保持不变;添加次氯酸钠溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1与1.2 mL,其他条件保持不变进行测定。
1.3.5.1.2 比色法标准曲线建立
分别取0、1、2、3、4、5、6、7、8、9 mmol/L的GABA标准混合溶液,其余保持不变,测定640 nm处的吸光值。
1.3.5.1.3 精密度试验
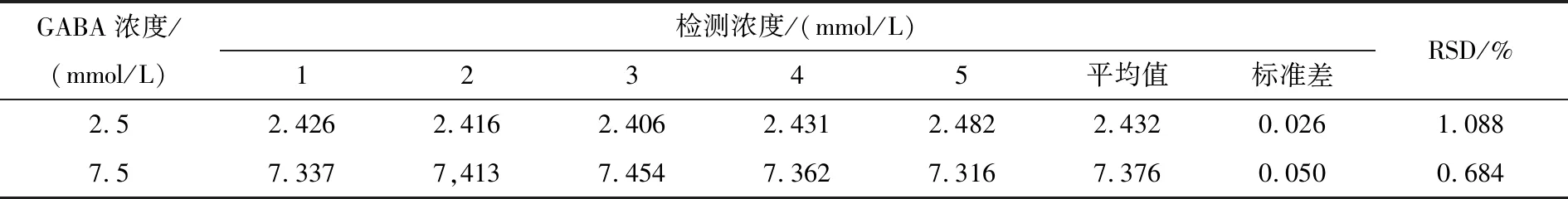
运用比色法测定2.5 mmol/L GABA和7.5 mmol/L GABA的吸光度。
1.3.5.2 氨基酸自动分析仪法测GABA
采用GB 5009.124-2016中氨基酸的测定原理,并参考日立LA8080的说明书,取2 mL处理好的发酵液,经10 000 r/min,10 min离心后取上清液。设置色谱分析条件[22-24],用氨基酸自动分析仪进行检测。
1.3.5.2.1 GABA标准溶液
称取标准品0.1 g GABA超纯水溶解为0.001、0.005、0.01、0.015、0.02 mg/mL。
1.3.5.2.2 色谱条件
GABA与茚三酮缓冲液反应产生蓝紫色化合物,波长测定为570 nm,进样量为20 μL。
分离柱:4.6 mm ID×60 mm,型号:#26622PH,柱温50 ℃,柠檬酸缓冲溶液流速为0.40 mL/min。
除氨柱:4.6 mm ID×40 mm,型号:#2650 L,柱温135 ℃,茚三酮缓冲溶液流速为0.35 mL/min。程序设定为反应时间(30 min)与再生时间(23 min)。具体运行参数见表1。

表1 氨基酸分析仪洗脱程序
1.4 统计分析
试验数据用Excel进行统计和分析,采用Design-Expert 8.0.6处理PB试验和响应面试验数据。
2 结果与分析
2.1 比色法测定GABA
2.1.1 苯酚、次氯酸钠对比色法的影响以及标准曲线的建立
由图1(a)可知,随苯酚浓度上升,吸光值整体也随之增加。苯酚质量分数为10%时吸光度良好,并与16%差异不大,考虑到成本因素,确定10%的苯酚;由图1(b)可得,次氯酸钠量增加,吸光值呈现先上升后下降的趋势。次氯酸钠的添加量为0.3 mL时,吸光值最大;由图1(c)可见,GABA标准品含量与其吸光值具有良好的线性方程:Y=0.1963X+0.0518,R2=0.995。
2.1.2 精密度试验
结果表明,该方法具有较好的检测范围(2.5~7.5 mmol/L),在试验范围内有很好的检测精确度,且具有较好的重现性,相对标准偏差小于1.5%。因此,可用于发酵样品的前期测定工作,并进行大批量测定工作。
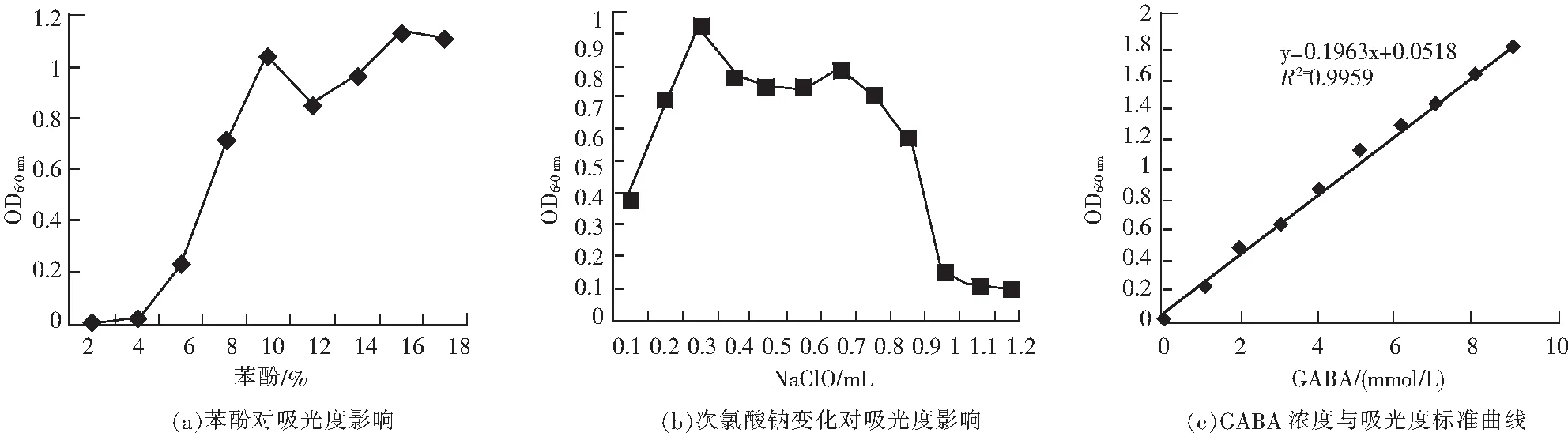
图1 比色法中苯酚、次氯酸钠以及标准曲线
GABA浓度/(mmol/L)检测浓度/(mmol/L)12345平均值标准差RSD/%2.52.4262.4162.4062.4312.4822.4320.0261.0887.57.3377,4137.4547.3627.3167.3760.0500.684
2.2 培养基单因素试验结果

图2 单因素试验结果
由图2(a)可知,在6种碳源中,葡萄糖对GABA产量的影响最大。葡萄糖作为一种单糖,直接参与细胞内糖代谢,被微生物吸收利用[27]。因此,宜选择葡萄糖作为该培养基的碳源。
由图2(b)可知,在5种有机氮源中,蛋白胨对GABA产量的影响最大,酸水解蛋白胨和大豆蛋白胨影响较小。蛋白胨富含有机氮化合物,也含有一些维生素,其价格相对较低。
由图2(c)可知,5种无机盐中,硫酸锰和氯化钙对GABA产量的影响最大,硫酸镁、磷酸二氢钾、氯化钠对GABA产量的影响较小。硫酸锰和氯化钙是微生物生长重要的微量元素,影响微生物的生长发育。
由图2(d)可知,随着底物质量浓度的增加γ-氨基丁酸的产量也随之升高,当底物质量浓度达到3 g/L时GABA的产量最大。随着质量浓度升高,GABA产量下降,可能是由于菌体内外渗透压差变高,干扰了乳酸菌的新陈代谢,从而导致GABA产量下降,这与Villegas等[16]的研究一致。
由图2(e)可知,随着接种量的升高,GABA的产量也逐渐提高,当接种量达到6%时,GABA的产量达到最大值。随接种量增加,GABA的产量下降,其原因可能是菌体含量增加,前期营养物质消耗增加,后期菌株的生长以及代谢将受到影响。
由图2(f)可知,随着pH值的升高,GABA的产量呈现先增长后减少的趋势。pH值为6.0时γ-氨基丁酸的产量最大,宜选择pH为6作为该培养基的pH值。
由图2(g)可知,随着温度的升高GABA的产量也随之增加,在37 ℃时,达到副干酪乳杆菌产GABA的最适温度,γ-氨基丁酸的产量最大。之后,随着温度的升高GABA的产量下降,这是由于过高的温度不适合菌株生长的缘故。
2.3 PB试验设计及结果分析
根据单因素试验确定的碳源、氮源、无机盐、底物浓度、温度、pH值和接种量8个因素,采用Plackett-Burman进行八因素二水平的实验设计,高水平为低水平的1.5倍左右,PB试验设计和结果见表3,PB试验设计结果与方差分析见表4。
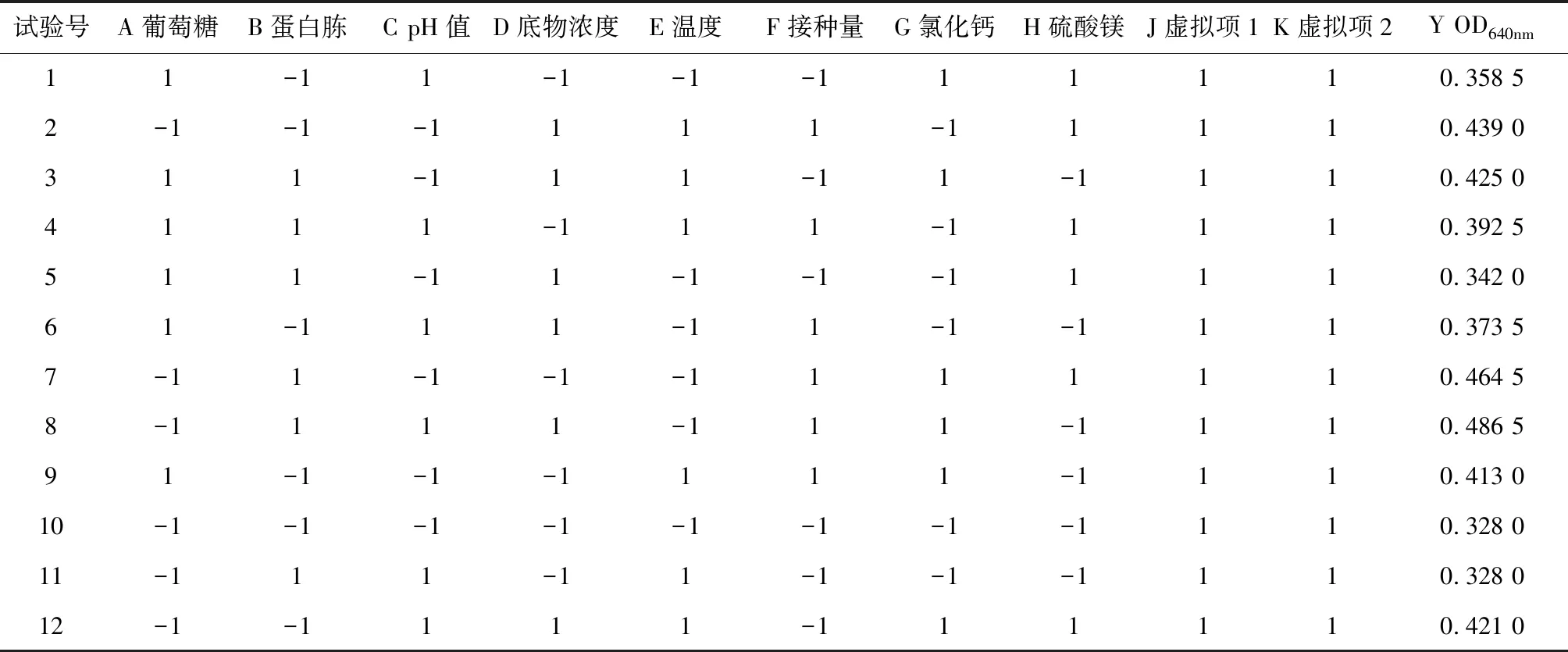
表3 Plackett-Burman试验设计和结果
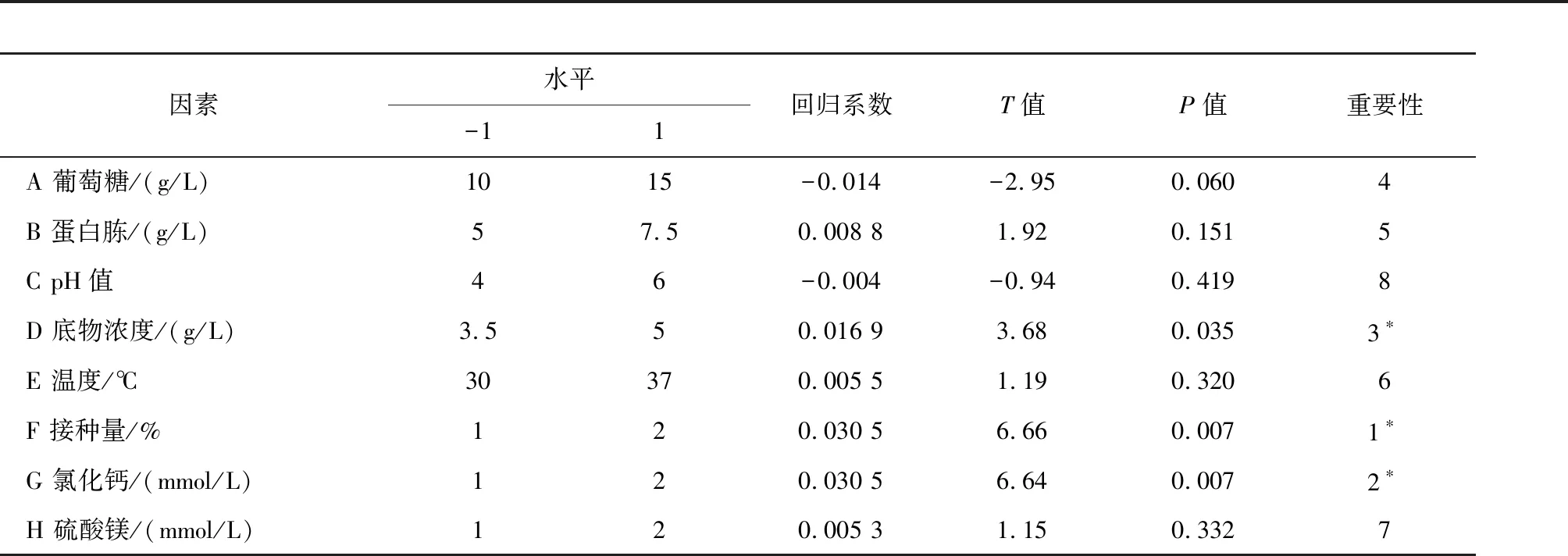
表4 Plackett-Burman试验设计与方差分析
注:*表示差异显著(P<0.05)
由表4可知,在副干酪乳杆菌产γ-氨基丁酸的过程中,α=0.05的显著水平,接种量、氯化钙、底物浓度对发酵液的OD640 nm值影响显著,其中葡萄糖、pH值对GABA产量的影响为负效应,而蛋白胨、底物质量浓度、温度、接种量、氯化钙、硫酸镁对GABA产量的影响为正效应,因此接种量、氯化钙、底物质量浓度可作为主要影响因素,进行培养基响应面的优化。参数方程如下:
Y=0.0293-0.00542A+0.00703B-0.00429C+0.0225D+0.00156E+0.06108 F+4.35 1G+0.341H
2.4 响应面试验设计及结果分析
2.4.1 GABA氨基酸标准测定
将1.0 mg/mL的GABA标品溶液稀释成0.005、0.01、0.015 mg/mL的标准溶液,将系列标准溶液上机测定,以峰面积A对质量浓度C(mg/mL)绘制标准曲线,其回归方程为:Y=97703X+15.787,R2=0.999 7,线性范围度为 0.005~0.001 mg/mL范围内线性关系良好;检测标品与样品图如图3所示。
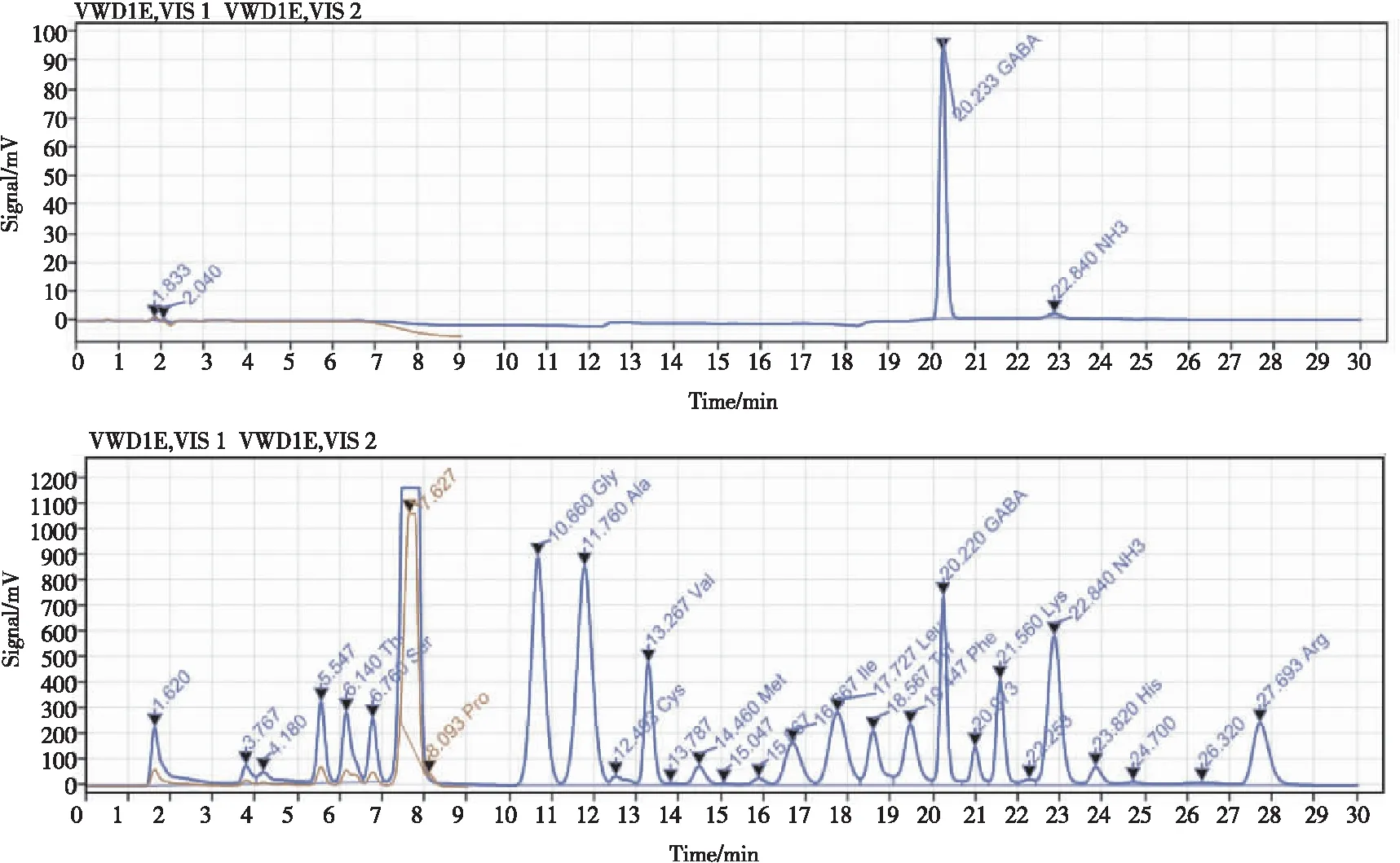
图3 GABA标品与样品出峰图
2.4.2 响应面试验设计与结果
使用Box-Behnken的中心组合试验设计,进行三因素三水平的试验,优化副干酪乳杆菌合成GABA的培养基试验。各因素水平见表5,实验设计与结果见表6。

表5 响应面试验水平和因素
根据表6的结果,使用Design-Expert 8.0.6对数据进行拟合和方差分析,得到接种量、氯化钙、底物浓度3个因素对GABA产量影响的回归方程:Y=2.86+0.022A+0.043B+0.011C-0.002AB-0.021AC+0.035BC-0.13A2-0.086B2-0.079C2。对回归模型进行方差分析检验其显著性,由表7的结果可知,模型的P=0.001 4<0.05,失拟项不显著(P>0.05),决定系数R2=0.9426,CV=1.43%,说明该模型显著、具有良好的拟合性,且该模型对86.89%的响应值可以进行解释,实验结果的准确性和精确度较高。根据P值大小,可以判断出A2对GABA的产量有极显著影响,B、B2和C2对GABA的产量有显著影响,根据F值,将3个因素对GABA产量的影响进行排序,其结果为:B>A>C。

表6 响应面试验设计及结果
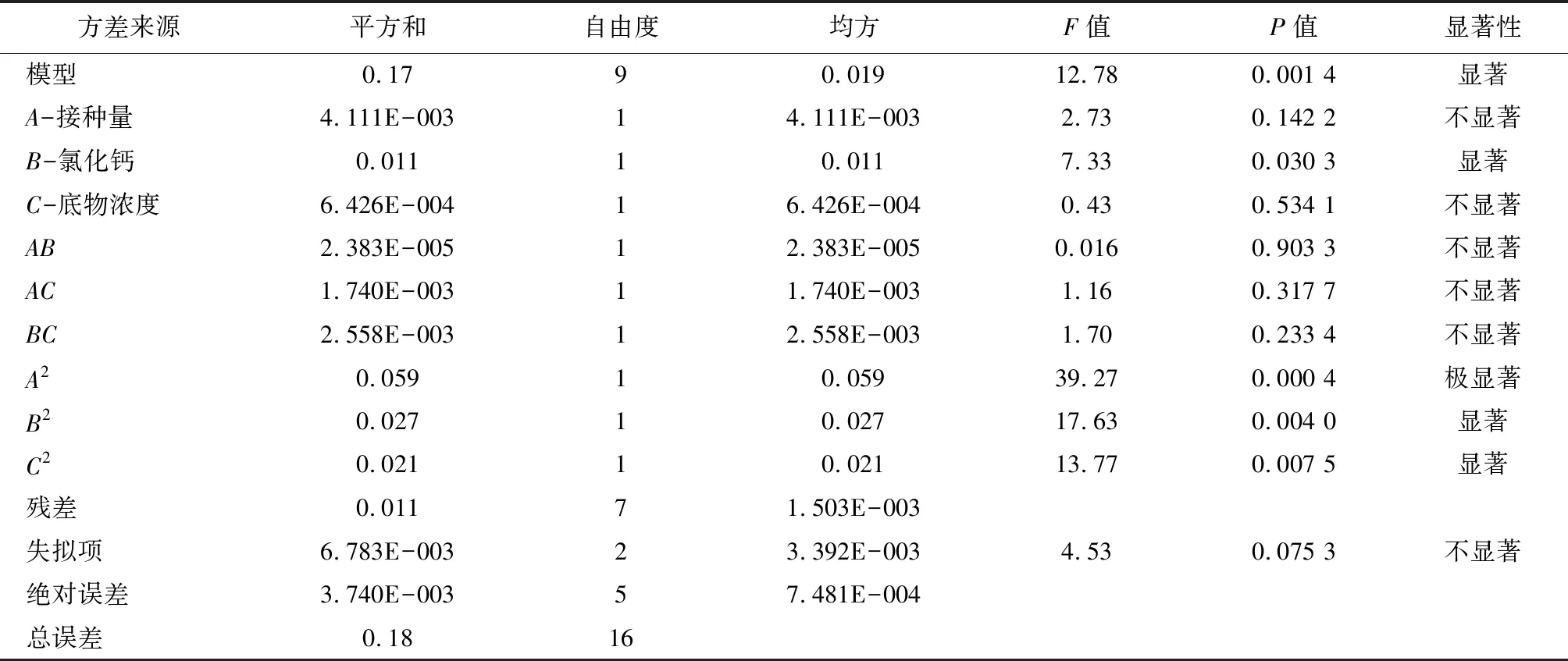
表7 回归模型的方差分析
注:P<0.001,差异极显著;P<0.05,差异显著
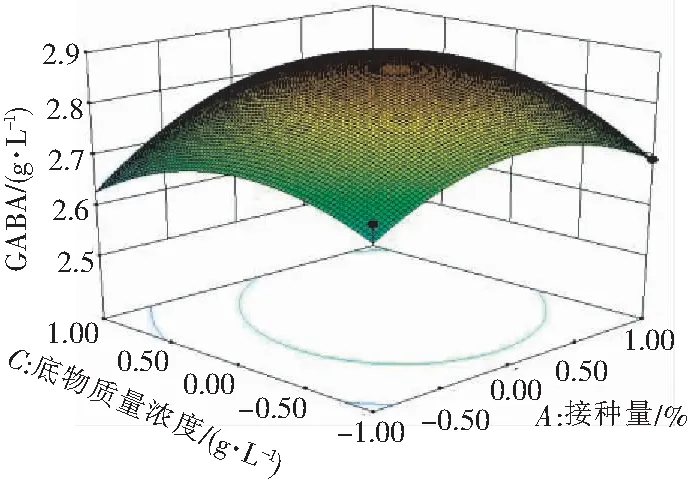
接种量、氯化钙与底物浓度的交互效应分析见图4—6。等差线越密集,则响应面图形坡面越陡峭,说明在一个因素固定不变时,另外2个因素的交互作用对GABA产量的影响越大,反之则影响越小。等高线的中心越近似于椭圆,则交互作用越强;等高线的中心越近似于圆,则交互作用越弱。由图4—6可知,氯化钙(B)和底物质量浓度(C)和的交互效应对GABA产量的影响是比较大的。所以在具体试验操作中,适当调整接种量和底物浓度有利于GABA含量上升。由图4—6可得,响应面坡面陡峭程度为:AB 图4 接种量氯化钙交互作用对GABA产量的影响 图5 接种量底物质量浓度交互作用对GABA产量的影响 图6 氯化钙底物质量浓度交互作用对GABA产量的影响 2.4.3 响应面验证试验 通过响应面试验得出最佳接种量为4、氯化钙1.5、谷氨酸钠1.5、GABA的含量为2.865 14 g/L。做3次实验取平均值,最后 GABA产量为(2.86±0.02) g/L。 谷氨酸通过谷氨酸脱羧酶(GAD)转化为GABA。GAD是1种依赖于5′-磷酸吡哆醛(PLP)的细胞内酶,它催化L-谷氨酸及其衍生物进行脱羧。而L-谷氨酸被位于细胞膜上面的Glu/GABA反转运蛋白导入细胞,同时将产生的GABA交换到细胞外[18]。 研究发现谷氨酸脱羧酶是生物合成GABA的关键酶及限速酶[25]。Smith等[26]研究发现,GAD其在pH值为4~6下酶活性较高,乳酸菌在发酵代谢中,能降低环境的pH值,在这种条件下能够激发GAD的活性,催发脱羧反应;但是Li等[27]发现代谢后期菌株分解糖产生大量的低重量分子的有机酸,导致酸性环境过低从而不适合细胞生长。Su等[28]发现盐酸吡哆醇作为廉价、稳定的PLP前体物质,在前期加入2 mmol的盐酸吡哆醇能够显著提高GAD的活性。一方面Cacl2等化学物质可以影响酶的活性,而另一方面碳氮源、温度与接种量会影响菌体的生长活力,从而影响GABA的产量。 此外,GABA含量的降低可能是由于GABA转化为琥珀酸、半醛和琥珀酸[29]的原因。Streeter等[30]研究发现植物体内的GABA在GABA转氨酶的作用下,形成琥珀酸半醛(SSA)和谷氨酸,随后在琥珀酸半醛脱氢酶的作用下形成琥珀酸(SA)进入三羧酸循环,从而发挥作用。Kumar[31]等运用C标记法,进一步研究表明黑曲霉中的GABA由L-谷氨酸脱羧而来。利用黑曲霉不接受外部供应的GABA特性,放射性标记谷氨酸盐的吸收率、某些代谢产物的积累率和GABA代谢反应,进而估算TCA循环相关的流量变化;但是关于副干酪乳酸菌产GABA的具体生产代谢途径以及影响因素还有待于更深入探究。 影响副干酪乳杆菌产GABA的关键因素是底物质量浓度、氯化钙、接种量;响应面优化试验发现接种量和谷氨酸钠的交互作用对GABA产量的影响最大。优化培养基配方为:酵母浸粉10 g/L,无水乙酸钠2 g/L,蛋白胨5 g/L,葡萄糖10 g/L,L-谷氨酸钠1.4 g/L,维生素B6 2 mmol/L,氯化钙1.5 mmol/L,接种量4.1%。优化后的培养基产物比初始培养基的GABA的产量提高了9%。

3 讨论
4 结论
