对2019年高考全国卷两道化学试题的再分析
2019-11-07河北省秦皇岛市第一中学066001李俊生
河北省秦皇岛市第一中学(066001) 李俊生
1 对2019 年高考全国卷Ⅱ12 题的分析
2019年高考全国卷Ⅱ12题是一道考察难溶电解质的溶解平衡试题,具体考察学生接受、吸收、整合化学信息的能力。
试题为:绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图1所示。下列说法错误的是( )。
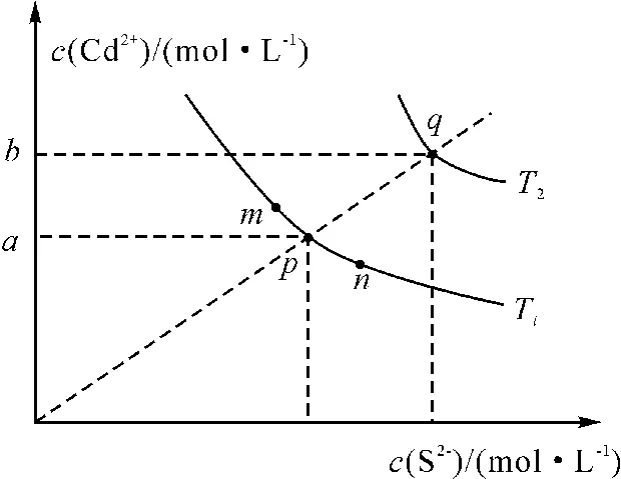
图1 硫化镉沉淀溶解平衡曲线
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
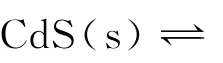
1.1 中学教学中确认CdS(s)溶度积和溶解度关系的一般做法
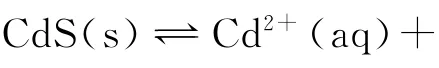

进而结合图像得出a和b分别表示T1和T2温度下CdS的溶解度,这就是认为A 项对的原因。
1.2 通过镉羟合配离子分布率an-pH 图确认选项A的正误
事实上Cd2+在溶液中是水解的,水解生成的含有镉的配离子的分率和溶液的pH 具有如图2所示的关系,情况如下。
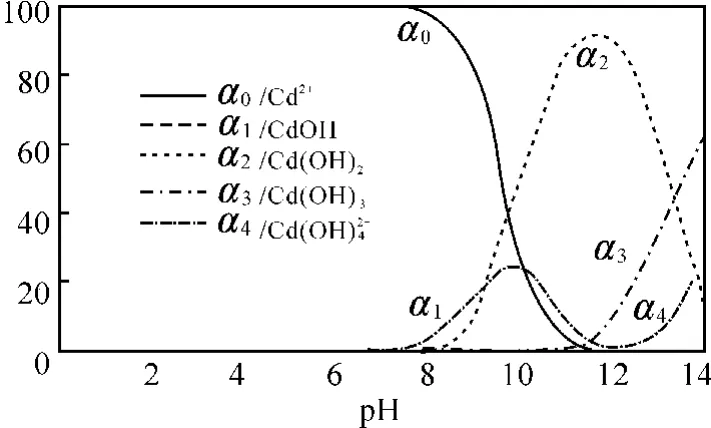
图2 镉羟合配离子分率an-pH 图
图2显示,在不同pH 值时,金属镉离子以不同羟合配离子存在,当pH 值小于9.8时,主要以游离Cd2+离子以及少量CdOH+离子和Cd(OH)2分子存 在;当pH 值 为9.8~13.31 时,主 要 以Cd(OH)2分子形态存在,以及少量的Cd(OH)3-、CdOH+等离子;当pH 值为11.5时,Cd(OH)2分子形态含量超过90%;当pH 值为11.5~13.31时,Cd(OH)2逐渐减少,Cd(OH)3-含量显著增加;当pH 大 于13.31 时,主 要 以Cd(OH)3-以 及 少 量Cd(OH)42-和Cd(OH)2形态存在;同样因为水解原因,含硫微粒也有S2-、HS-、H2S,所以此时CdS的溶解度为:
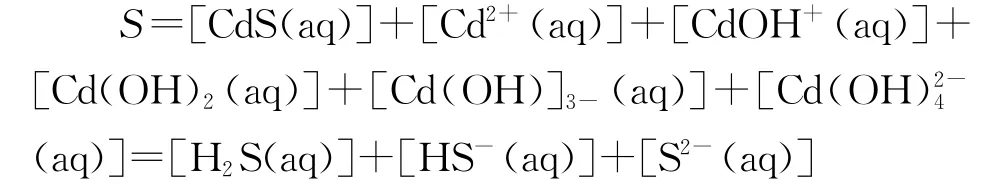
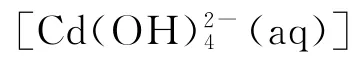
通过对这个试题的分析可以发现,中学教学中确认难溶物质溶度积和溶解度关系的一般做法应该是有前提条件的,由于一般的难溶物质溶度积和溶解度关系的理论推导非常复杂,为了说明问题,我们可以看一些典型物质的溶度积和溶解度的实测值以及溶解度的理论计算值之间的关系,进而确定这个前提条件,具体见表1。
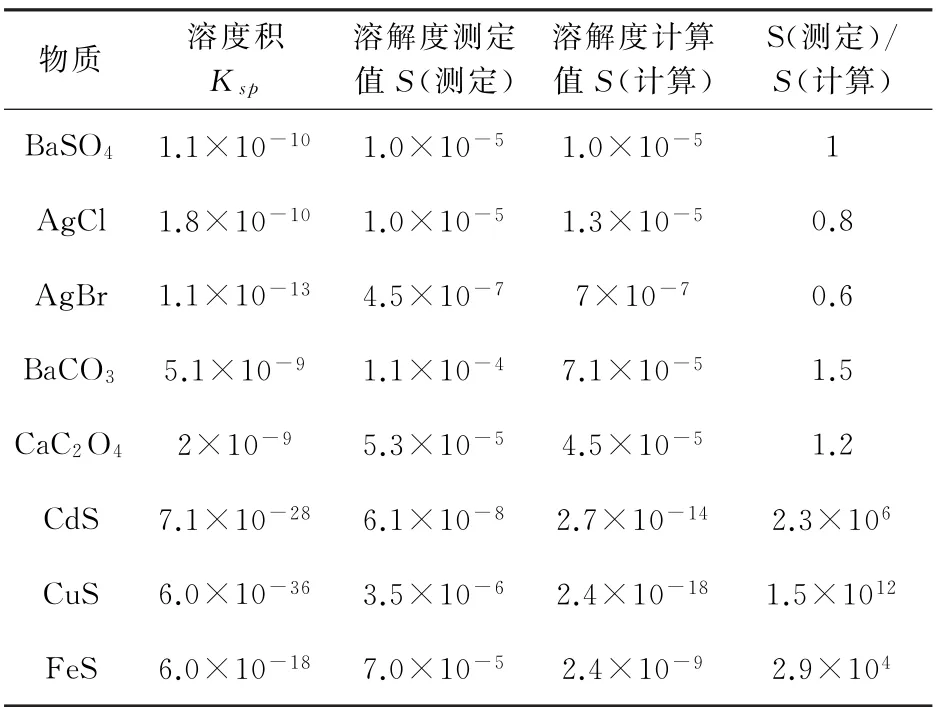
表1 常见难溶物质溶度积和溶解度
通过观察表1,可发现如下结论,对于
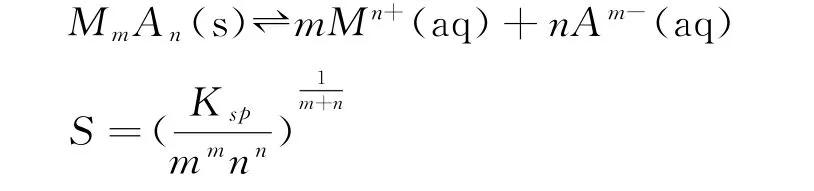
计算得到的难溶物溶解度和难溶物溶度积之间关系成立的前提条件为:
(1)强酸强碱难溶盐用该关系计算溶解度,理论值与实测值相等;
(2)强酸弱碱盐或弱酸强碱盐用该关系计算溶解度,理论值与实测值误差比较小;
(3)弱酸弱碱盐用该关系计算溶解度,理论值与实测值误差最大。
所以,在分析类似于2019年高考全国卷Ⅱ第12题中所出现的难溶物溶度积和溶解度关系时,一定要注意CdS弱酸弱碱盐的属性,不然会得出错误结论。
2 对2019 年高考全国卷Ⅲ35 题第(4)问的分析
2019年高考全国卷Ⅲ35题是一道以磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料为背景,考察一系列物质结构的主干知识,包括元素周期率、电子运动状态、配位键、晶体类型,电负性、杂化方式、考察学生的记忆能力,分析推理以及计算能力。
试题为:磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是Mg,该元素基态原子核外M 层电子的自旋状态相反(填“相同”或“相反”)。
(4)NH4H2PO4中,电负性最高的元素是O;P的杂化轨道与O 的2p轨道形成键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图3所示。这类磷酸根离子的化学式可用通式表示为(PnO3n+1)(n+2)(用n代表P原子数)。
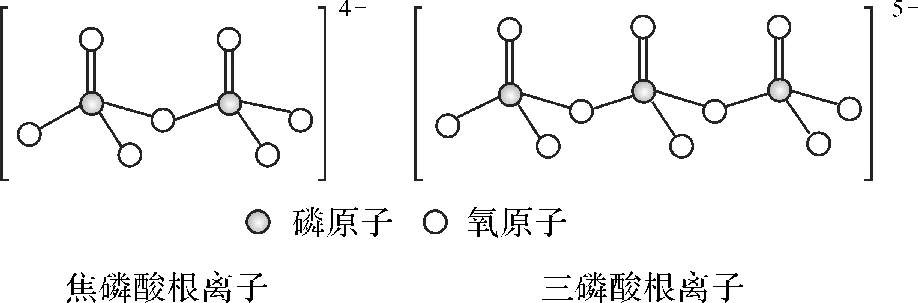
图3 焦磷酸根离子、三磷酸根离子图示
事实上,对“(4)NH4H2PO4中,电负性最高的元素是O;P的sp3杂化轨道与O 的2p轨道形成σ键”中的最后一个空的理解,对学生而言是有一定难度的,在这里“P的sp3杂化轨道与O 的2p轨道形成σ键”中的“…O…”指的是非羟基氧还是羟基氧,非羟基氧或羟基氧杂不杂化,如杂化采取什么样的杂化等问题都需要认真分析进而确认,对于NH4H2PO4中P的杂化方式研究认为:H2PO4-中的P的杂化方式可能有两种方式:sp3(s与px、py、pz)或sd3(s与dxy、dxz、dyz),但是P的价电子排布式为3s23p3,其中ΔE3s-3p<ΔE3s-3d,所以中心P原子按照轨道能量相近原则,以其3s与3p形成稳定的sp3杂化轨道与O 形成σ键,形成离子的初步框架如下:
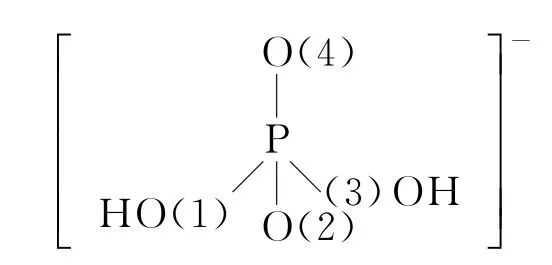
在这个框架中O(1)、O(3)按价层电子对互斥原理分析,应该是sp3杂化,sp3杂化轨道里面的一个轨道(里面一个电子)和P的1个sp3轨道(里面各一个电子)形成P(sp3)-O(sp3)σ键,对于O(2)或O(4)提供什么样的轨道和中心P原子的sp3杂化轨道形成σ键则有两种认识。
观点1:O(2)或O(4)经过图4所示过程,最后形成sp杂化。
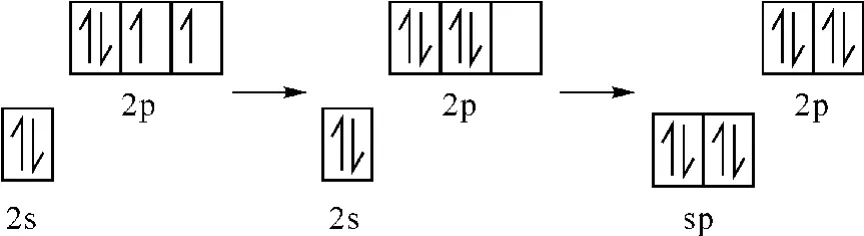
图4 杂化过程图示
形成的两个sp杂化轨道中的一个占有一对孤电子对,另一个是空轨道,这个空轨道接受来自P的sp3轨道的孤电子对,形成一个配位键,O(2)或O(4)中没有参与杂化的2pz、2py上的两对孤电子对又和P原子的两个空轨道dz2、dx2-y2形成2个d-pΠ反馈键,P和O(O(2)或O(4))形成化学键PO。
观点2:O(2)或O(4)经过如图5所示程,并且不杂化。
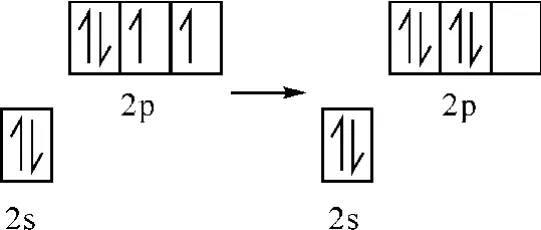
图5 观点2图示
经过如上过程后形成2px空轨道,这个空轨道接受来自P的sp3轨道的孤电子对,形成一个配位键,O(2)或O(4)中2pz、2py上的两对孤电子对又和P原子的两个空轨道dz2、dx2-y2形成2个d-pΠ 反馈键,P 和O(O(2)或O(4))形成化学键PO。
尽管形成的最后形式一样,事实上两种观点的区别是很大的,内涵是有本质区别的,这种区别就是按照观点1计算出的P-O 键长为0.157nm;按着观点2计算出的P-O 键长为0.176nm,而PO 键长的实验值为0.154nm,显而易见观点1更符合实际情况,结合上面分析,H2PO4-离子的结构式为如下形式:
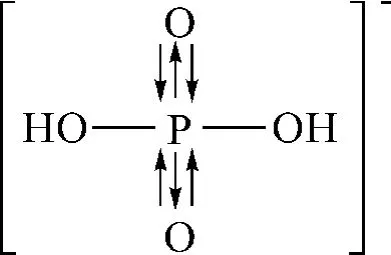
这个结构式具有如下特点:
(1)H2PO4-离子中P原子为sp3杂化;
(2)H2PO4-离子中两个非羟基O 为sp杂化,两个羟基O 为sp3杂化;
(3)H2PO4-离子中P 原子sp3杂化轨道上的孤电子对和非羟基氧O 的sp杂化空轨道形成P(sp3)→O(sp)配位键;
(4)H2PO4-离子中P 原子sp3杂化轨道上成单电子和羟基氧O 的sp3杂化轨道上成单电子形成P(sp3)-O(sp3)共价键;
(5)H2PO4-离子中非羟基O 氧上的两对孤电子对分别和P原子d(dz2、dx2-y2)空轨道形成dpΠ 反馈键。
结合前面分析,显而易见2019年高考全国卷Ⅲ第35题第(4)问中的最后一个空是有一定难度的,表述的科学性和准确性应该进一步完善,结合中学教学,我们认为按照如下方式理解或教学比较好,呈现为“(4)NH4H2PO4中,电负性最高的元素是O;P的sp3杂化轨道与非羟基O 的sp杂化空轨道形成σ键”。
