miR-150调控TGF-β1信号通路与慢性非细菌性前列腺炎的相关性研究
2019-11-06
(右江民族医学院附属医院泌尿外科,广西 百色 533000)
慢性非细菌性前列腺炎(chronic non-bacterial prostatitis,CNP)是前列腺炎的主要类型,占90%以上[1]。流行病学资料显示,约50%的男性在一生中的某个时期会受到CNP的影响[2]。目前对CNP的发病机制、病理生理学改变的作用机制尚未十分清楚,许多医师在临床诊治CNP过程中感到很棘手。近年来,CNP患者前列腺按摩液(expressed prostatic secretion,EPS)中转化生长因子-β1(transforming growth factor-β1,TGF-β1)及相关细胞因子已成为该领域研究的热点。且最新研究显示,大量miRNA在男性生殖腺器官组织中有较高表达,并可定位表达于相关炎症细胞,同时miR-150还可介导炎症反应的整个过程,一定程度上可以作为判断疾病的严重程度及预后的依据[3]。此外,研究中还发现,miR-150含量在全身性感染患者外周血白细胞中表达降低,而靶基因炎症细胞因子:白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)等含量是上升的,且miR-150含量越低,炎症反应越严重,预后越差[4-5]。因此对前列腺液进行相关性研究有望对CNP的发生、发展等一系列生理及病理机制的探索以及对炎症的临床诊断、预后判断开辟一条新途径。本研究采集了CNP患者前列腺液样本,同时采集健康志愿者的前列腺液样本,拟采用ELISA法及qRT-PCR等方法检测上述样本相关细胞因子、TGF-β1及miR-150的水平及表达情况,分析其之间的相关性,旨在为临床治疗和预防CNP提供依据。
1 资料与方法
1.1对象 选取2017年10月—2018年10月在右江民族医学院附属医院泌尿外科门诊治疗的CNP患者(研究组)共42例,年龄19~52岁,平均(32.63±8.20)岁;病程6~60个月。选择同期39例男性健康体检者作为对照(对照组),年龄20~53岁,平均(33.83±7.99)岁。两组研究对象年龄比较,差异无统计学意义(t=0.304,P>0.05),具有可比性。
1.2纳入与排除标准 研究组纳入标准:所有病例均符合美国国立卫生研究院(National Institutes of Health,NIH)制定的前列腺炎诊断标准,根据症状及EPS、细菌培养检查确诊为CNP。对照组纳入标准:门诊正常体检患者。排除标准:所有纳入对象近3个月内无泌尿生殖系统感染史;排除泌尿系统相关其它梗阻性疾病病史、泌尿生殖/直肠肿瘤病史以及尿道手术病史等。
1.3标本采集及实验方法
1.3.1前列腺液采集 禁欲7 d以上,排空膀胱后使用新洁尔灭常规消毒尿道口,经直肠按摩前列腺,收集EPS 置于洁净干燥的试管中,-70℃保存。
1.3.2酶联免疫吸附试验(ELISA)检测 TGF-β1、细胞因子(IL-6、IL-10、TNF-α)水平 采用双抗体夹心酶联免疫吸附试验检测TGF-β1、IL-6、IL-10和TNF-α,试剂盒购自南京森贝伽生物科技有限公司,检测的灵敏度分别为7 ng/L、15 ng/L,检测仪器为Cobas6000全自动生化酶标分析仪,所有操作均严格按照试剂盒说明书进行,测定450 nm处吸光度A值,设立空白对照,通过绘制标准曲线,根据各EPS标本A值在标准曲线上读取相应的TGF-β1、IL-6、IL-10及TNF-α的浓度。为确保实验的一致性,以上操作均由同一人完成,操作人员熟练掌握全自动生化酶标分析仪的操作规程。
1.3.3qRT-PCR检测前列腺液中miR-150和TGF-β1表达 ①总RNA的提取:采用美国Invitrogen公司Trizol RNA提取液,按照说明书分批对总RNA进行提取后置于-80℃下保存备用。紫外吸收法测定读取其在分光光度计260 nm和280 nm处的吸收值,测定RNA溶液浓度和纯度,所有标本总RNA吸光度的比值(A260/A280)均在1.8~2.0之间,表明RNA纯度好。②逆转录总RNA:利用Promega逆转录试剂盒操作将RNA逆转录为cDNA,根据试剂盒说明书对总RNA进行反转录,配成10 μl反应液:Total RNA 1ng,根据Total RNA浓度计算出所需体积、2.5 U/μl Poly A Polymerase 1 μl、RTaseMix 1 μl、5×PAP/RT Buffer 5 μl、dd H2O(RNase/Dnasefree) 补齐至总反应液为10 μl。miR-150基因扩增条件:37℃ 60 min,85℃ 5 min,按TaKaRa公司SYBR RT-PCR Kit进行PCR扩增(扩增反应体系依据各检测基因),引物由Invitrogen公司设计与合成,预变性 95℃ 3 min;95℃ 10 s;55℃ 10 s;72℃ 30 s共33个循环;TGF-β1基因扩增条件:94℃ 3 min,55℃ 10 s,72℃ 10 s,共计40个循环72℃延伸5 min,引物序列见表1。每个样本每种目的基因设置3个复孔,反应结束后获得熔解曲线和扩增曲线,选择SYBR Green I/HRM Dye通道,读取Ct值。目的基因mRNA水平以看家基因(GAPDH)标化,反应结束后以2-△△Ct方法进行定量分析,计算每个基因的Ct值,并与标化的GAPDH比较,以GAPDH的循环阈值(Ct)进行校正,确定目的基因相对表达水平。

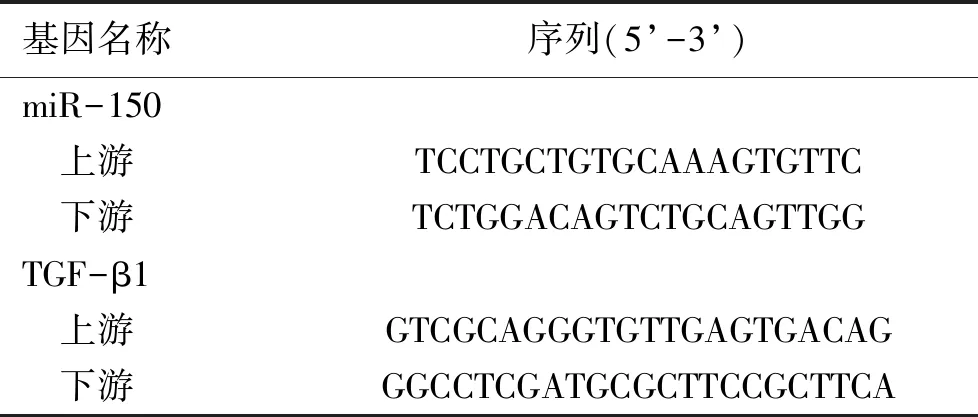
表1 PCR引物序列
2 结果
2.1ELISA检测各因子水平及其相关性分析结果 两组TGF-β1、IL-6、IL-10及TNF-α水平比较结果显示:研究组前列腺液中TGF-β1、IL-6、IL-10及TNF-α含量显著高于对照组(t=27.380、24.319、42.857、32.294,P均<0.001),差异有统计学意义,见表2。Pearson相关分析结果显示:研究组前列腺液中TGF-β1水平与IL-6、IL-10及TNF-α含量均呈正相关(r=0.973、0.931、0.846,P均<0.01),差异有统计学意义,见图1、图2和图3。
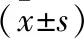
表2 两组前列腺液中TGF-β1、IL-6、IL-10及TNF-α水平比较
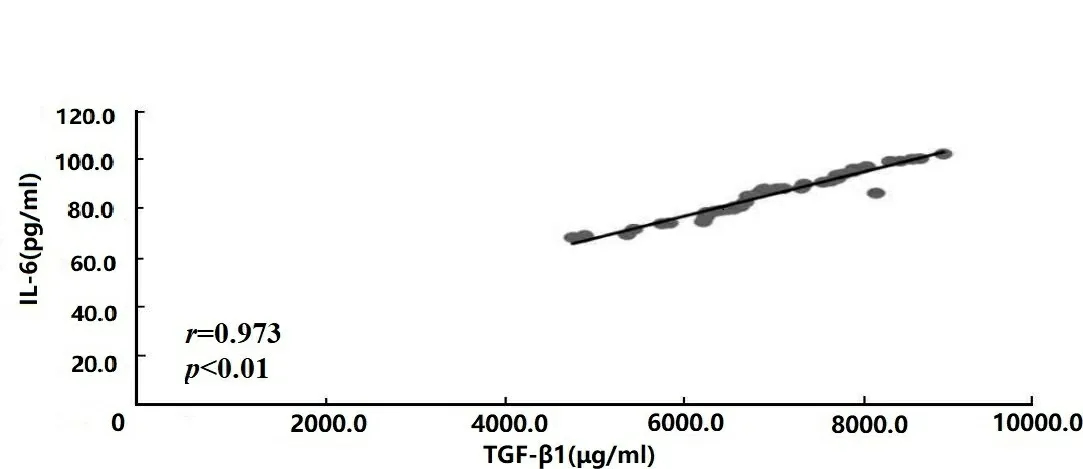
图1 TGF-β1与IL-6水平相关性分析
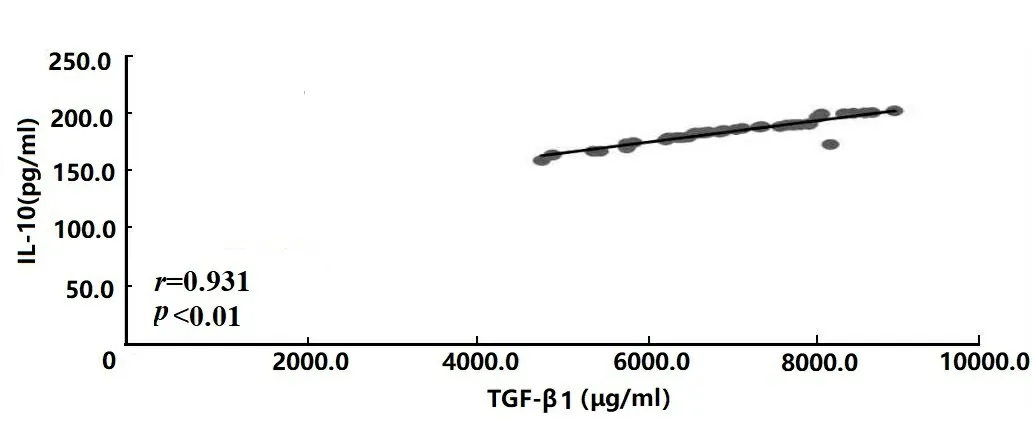
图2 TGF-β1与IL-10水平相关性分析
2.2qRT-PCR检测TGF-β1与miR-150表达量分析结果 研究组TGF-β1的表达量明显高于对照组,而miR-150表达量低于对照组(t=31.228、5.833,P均<0.001),差异有统计学意义。见表3。
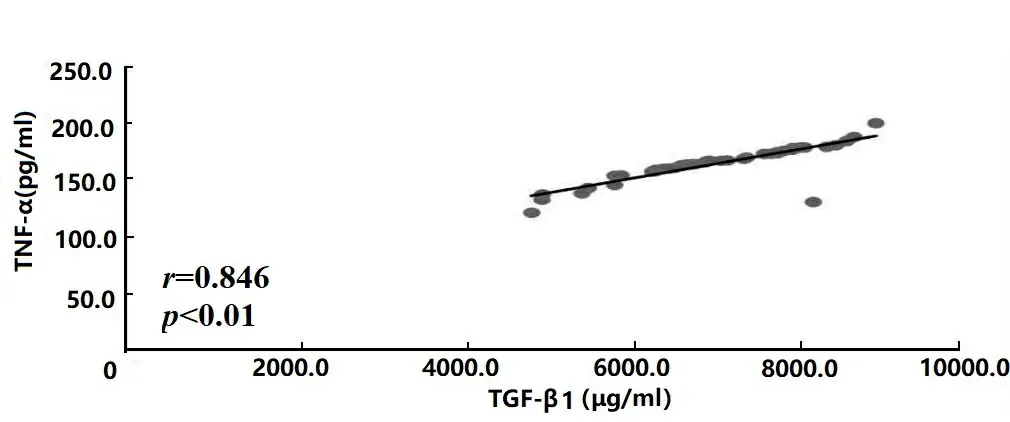
图3 TGF-β1与TNF-α水平相关性分析
表3 两组前列腺液中miR-150和TGF-β1表达量比较
3 讨论
前列腺是男性泌尿生殖系统中最大的腺体,在介导免疫及生殖过程中扮演重要角色。慢性前列腺炎(chronic prostatitis,CP)是成年男性的多发病,也是泌尿外科的常见疾病之一,约占门诊就诊患者的1/4[6]。美国国立卫生院将CP分为四个类型:Ⅰ型:急性细菌性前列腺炎(acute bacterial prostatitis,ABP),Ⅱ型:慢性细菌性前列腺炎(chronic bacterial prostatitis,CBP),Ⅲ型:CNP,Ⅳ型:无症状性前列腺炎(asymptomatic prostatitis,AP)。其中,CNP可占90%以上,是主要的前列腺炎类型[7]。CNP不是一种直接威胁人类生命的疾病,常因伴有下尿路刺激症状和盆腔疼痛综合征而严重影响患者的生活质量[8]。CNP给患者带来前列腺区域不适、疼痛、排尿异常、尿道异常分泌物增多等临床症状,且症状反复发作,部分CNP患者可伴发性功能障碍(sexual dysfunction,SD)以及引发男性不育等并发症。目前对CNP的发病机制、病理生理学改变的作用机制虽然尚未十分清楚,但免疫反应异常是发病的重要原因之一。众多研究表明,患者的前列腺液中细胞因子的变化可以更早、更准确地体现前列腺的炎症状况,其中细胞因子IL-6、TNF-α和IL-10是主要参与前列腺炎症的免疫反应。IL-6 主要介导B细胞产生多种炎症介质,从而参与免疫调节。当机体存在感染或炎症时,大量产生的IL-6可与TGF-β1共同诱导细胞的分化,进而促进炎症反应[9]。TNF-α主要来源于活化的单核-巨噬细胞、抗原激活的T细胞和自然杀伤细胞,肥大细胞也分泌TNF,具有介导抗肿瘤以及调节机体免疫功能、参与发热和炎症的发生等作用。在前列腺局部,TNF-α可以激活中性粒细胞和单核-巨噬细胞,刺激它们合成 IL-1 、 IL-6 、 IL-10 和TNF,增加某些黏附分子的表达而促进炎症细胞黏附、游走、浸润及中性粒细胞脱颗粒,同时也通过自分泌方式作用于巨噬细胞本身而释放炎症介质(如白三烯、前列腺素等)促进炎症反应。IL-10作为另一种抗炎性细胞因子,在人类免疫反应中占有极为重要的地位,产生主体为Ⅱ类辅助性T淋巴细胞(Th2),又称细胞因子合成抑制因子,能够对T细胞增殖、多种介质及炎症因子的产生进行抑制,促进炎性反应的减弱,限制炎症的发展,而正常免疫状态得以维持的基础就是要保持促炎性细胞因子和抑炎性细胞因子之间的平衡[10]。本次研究结果表明,研究组患者前列腺液中IL-6、TNF-α和IL-10等细胞因子水平均显著高于对照组,差异有统计学意义,说明CNP的发生发展受到炎症介质的直接影响。GF-β1是TGF-β超家族重要成员之一,是一种重要的促增殖介质,由双硫键联结的碱性细胞因子,具有调节细胞生长、分化、发育、炎症和凋亡等多种生物学活性的多肽类细胞因子[11]。邝世航等[10]研究结果显示,CP大鼠前列腺组织中TGF-β1的表达强度明显高于对照组。李永伟等[12]研究结果亦显示TGF-β1在CNP病人前列腺液中的表达水平也明显高于正常对照者。而本次研究发现,研究组前列腺液中TGF-β1、IL-6、IL-10及TNF-α含量显著高于对照组,其表达量与IL-6、IL-10及TNF-α含量呈正相关,且TGF-β1水平越高,CNP患者症状越明显,这些结果充分说明,TGF-β1在CNP的发病及进展中扮演重要角色。由于TGF-β1与IL-6、IL-10及TNF-α存在明显正相关关系,说明TGF-β1和细胞因子(IL-6、IL-10及TNF-α)可能共同参与CNP的发病和进展。
MicroRNA (miRNA) 是一类由内源基因编码的长度约为22 个核苷酸的非编码单链RNA分子[13]。miRNA可通过自身的种子序列与其靶基因的3’端非编码区域进行完全或不完全配对结合,降解其靶基因的mRNA或抑制靶基因翻译的方式来进行基因表达的调控[14]。最新研究显示,大量miRNA在男性生殖腺器官组织中也有较高表达,并可定位表达于相关炎症细胞。miR-150在正常生理状态下对淋巴结和脾脏两组主要靶器官呈现高表达,它通过调控靶基因的表达直接或间接地参与细胞的生理调控过程,参与机体免疫系统和造血系统发生、胚胎发育以及干细胞的分化,影响生物体的生长和发育[15]。在本研究中,为了解miR-150在CNP中的发生和发展过程中属高表达还是低表达情况,以及miR-150表达情况是否与炎症反应后改变了的前列腺液中TGF-β1有相关性,我们分别采集了CNP患者与正常体检者的前列腺液样本,运用实时荧光定量PCR 方法对上述样本中miR-150与TGF-β1的表达情况进行了检测,最终研究结果显示:研究组TGF-β1的表达量明显高于正常对照组,而miR-150表达量低于对照组,差异有统计学意义。因此得出结论:在CNP的病理生理进展过程中,miR-150呈现低表达。
综上所述我们得出结论:miR-150表达下调可能调控TGF-β1的水平改变及表达异常进而参与CNP的发生与发展,而且TGF-β1的异常表达与细胞因子水平的改变可能共同参与CNP的发病和进展。
