二氢杨梅素通过Sirt1通路促进自噬改善糖尿病肾病大鼠肾损伤*
2019-11-04张建东王悬峰吕玮鑫吴素珍
张建东,王悬峰,彭 湾,吕玮鑫,吴素珍,肖 海
(1.江西医学高等专科学校,江西 上饶 334000;2.赣南医学院 a.基础医学院;b.第一附属医院病理科,江西 赣州 341000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病中严重的并发症之一,引起肾小球硬化和肾功能损害[1]。目前,DN发病机制包括高糖、糖基化终末产物、炎症因子以及氧化应激诱导等[2]。自噬是维持肾脏细胞内稳态不可或缺的生理活动,在上述损伤机制中起着重要作用[3]。目前国内外对DN尚无确切有效的治疗方法。因此,寻找有效防治DN的新方法具有重要的实际意义。
二氢杨梅素(dihydromyricelin,DMY)是藤茶中主要成分之一。DMY具有抗炎、抗氧化、抗肿瘤和抗纤维化等多种生物活性作用[4-6]。研究表明,DMY具有降血糖作用,能有效改善糖耐量异常状态[7-8]。DMY还能通过增强自噬活性保护高糖诱导的脐静脉内皮细胞损伤[9]。然而,DMY在糖尿病动物肾脏自噬的作用尚不清楚。研究发现自噬与DN的发生发展共同受到Sirt1信号通路的调控[10]。本文通过建立DN大鼠模型,探讨Sirt1/自噬信号通路在DMY抗糖尿病肾损伤中的作用。
1 材料与方法
1.1动物和试剂雄性SD大鼠40只,体重为(200±20) g,由赣南医学院动物中心提供。将动物置于25 ℃环境下饲养,普通饲料喂食,自由饮水,适应性喂养1周。Sirt1、Beclin-1抗体购自于英国Abcam公司。Bcl-2、Bax购自于武汉博士德公司;LC3购自于美国proteintech公司;二抗购自于福州迈新公司,二氢杨梅素购自成都德思特公司,链脲佐菌素(STZ)购自于北京索莱宝公司。
1.2 DN模型的制备和实验分组大鼠禁食不禁水12 h后,除正常对照组外均采用55 mg·kg-1STZ一次性腹腔注射大鼠并给予普通饲料喂养12周后建立DN模型。造模72 h后大鼠尾静脉取血测空腹血糖,以血糖>16.7 mmol·L-1视为造模成功。将大鼠随机分为模型组和低、中、高剂量DMY组(DMY浓度分别为125 mg·kg-1、250 mg·kg-1、500 mg·kg-1),每组8只,另设正常对照组8只。DMY组采用灌胃给药,模型组和正常对照组以等量的生理盐水灌胃,每天一次,持续12周。
1.3透射电镜观察自噬水平将肾脏组织置于2.5%戊二酸缓冲液中固定2 h,再用四氧化锇固定液固定2 h,PBS冲洗,依次置于不同浓度的乙醇中脱水。包埋处理后,将肾脏组织切片并进行染色,透射电镜下观察样本并拍照。
1.4免疫组化检测蛋白水平肾脏组织切片常规脱蜡至水,采用柠檬酸高压修复抗原,PBS冲洗后甩干。分别加入LC3、Bcl-2、Bax抗体37 ℃孵育1 h,PBS做阴性对照,PBS冲洗,滴加二抗孵育15 min。DAB显色,苏木精复染。常规脱水、透明、中性树胶封片。显微镜下采集图像,采用Image-Pro Plus 6.0软件进行分析。计算各组大鼠肾脏组织中LC3、Bcl-2、Bax阳性表达的平均光密度。
1.5 Westernblot检测蛋白水平肾脏组织充分裂解1 h后采用BCA方法进行蛋白定量,将蛋白煮沸变性,经SDS-PAGE凝胶电泳,电转移至PVDF膜,5%脱脂牛奶封闭后,加入Sirt1、Beclin-1一抗4 ℃过夜,二抗室温孵育1 h。最后用Bio-Rad软件扫描蛋白条带及测定灰度值,并与对照组结果进行对比。

2 结 果
2.1各组大鼠肾脏组织的自噬水平比较DMY给药12周,通过透射电镜检测发现,与正常对照组相比,模型组肾脏组织系膜区可见低密度电子致密物,基底膜明显增厚,足细胞线粒体轻度肿胀,但都未见自噬体。与模型组比较,中剂量DMY组可见少量自噬体,但基底膜未见明显增厚(图1)。通过免疫组化进一步检测发现,与正常对照组相比,模型组自噬关键蛋白LC3表达水平下降(P<0.05)。DMY各剂量组相较于模型组LC3蛋白水平出现不同程度的增加(P<0.05),见表1和图2。
2.2 DMY对各组大鼠肾组织中Bcl-2、Bax表达水平的影响免疫组化检测结果显示,与正常对照组比较,模型组肾脏组织中凋亡相关蛋白Bax表达水平显著增加,Bcl-2蛋白表达水平下降(P<0.01)。与模型组比较,各剂量DMY组凋亡相关蛋白Bax出现不同程度的降低,而Bcl-2蛋白表达水平增加(P<0.05),见表1和图2。
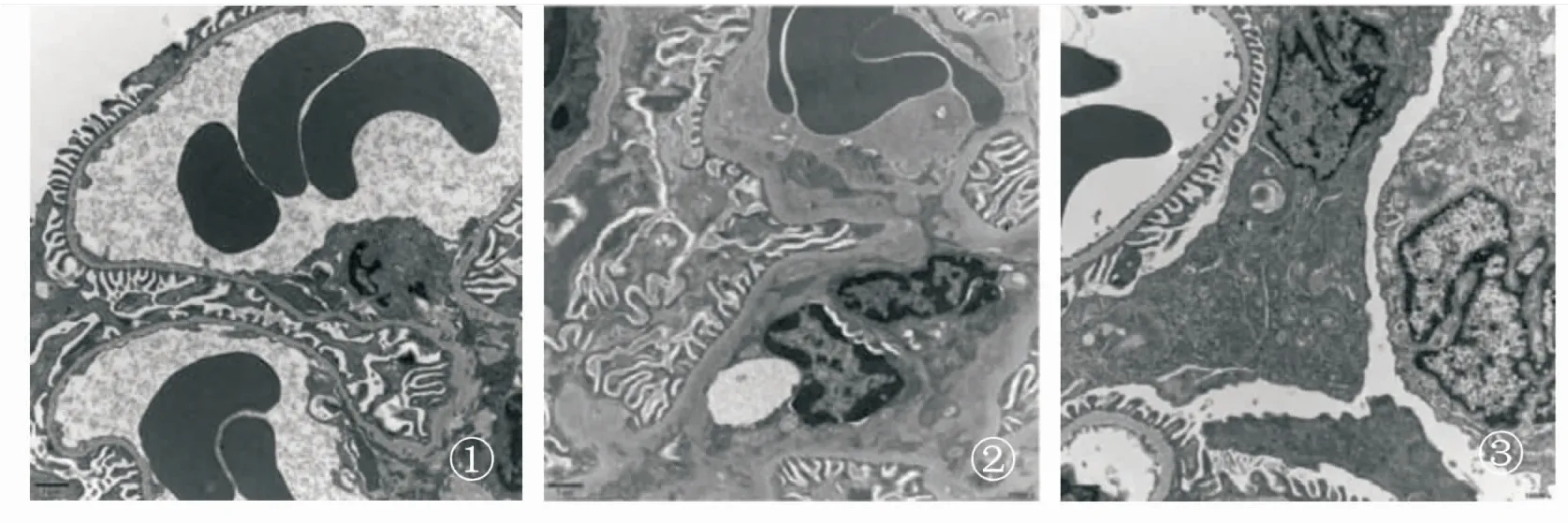
①正常对照组;②模型组;③中剂量DMY组。
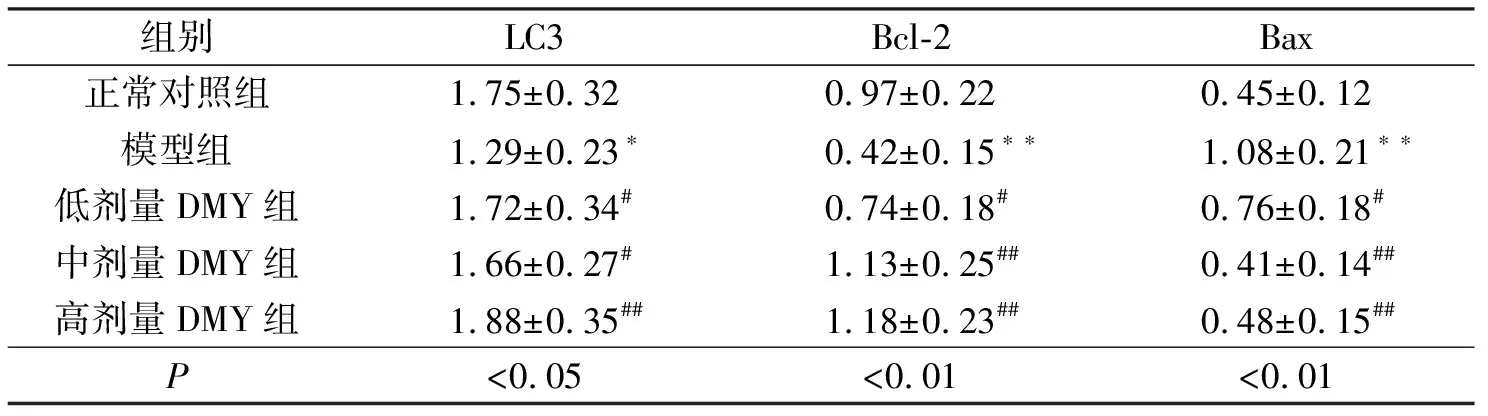
组别LC3Bcl-2Bax正常对照组1.75±0.320.97±0.220.45±0.12模型组1.29±0.23∗0.42±0.15∗∗1.08±0.21∗∗低剂量DMY组1.72±0.34#0.74±0.18#0.76±0.18#中剂量DMY组1.66±0.27#1.13±0.25##0.41±0.14##高剂量DMY组1.88±0.35##1.18±0.23##0.48±0.15##P<0.05<0.01<0.01
注:与正常对照组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01。
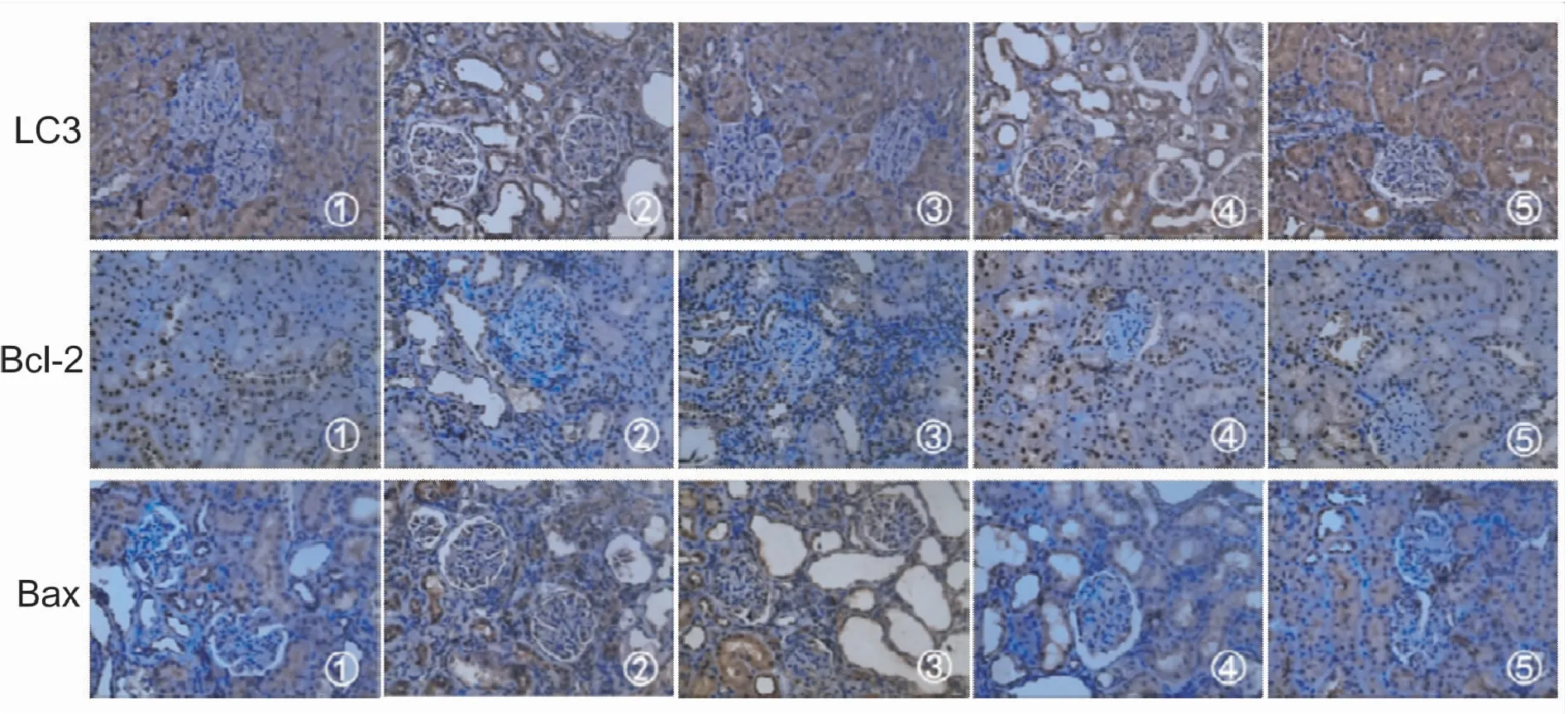
①正常对照组;②模型组;③低剂量DMY组;④中剂量DMY组;⑤高剂量DMY组。
2.3 DMY对各组大鼠肾组织中Sirt1和Beclin-1表达水平的影响Western blot检测结果显示各组肾脏组织中Sirt1、Beclin-1蛋白表达有统计学差异(P<0.05),与正常对照组比较,模型组肾脏组织中Sirt1、Beclin-1蛋白表达水平下降(P<0.05)。DMY处理后,低、高剂量DMY组相较于模型组可显著促进肾脏组织中Sirt1、Beclin-1蛋白的表达(P<0.05),见图3。
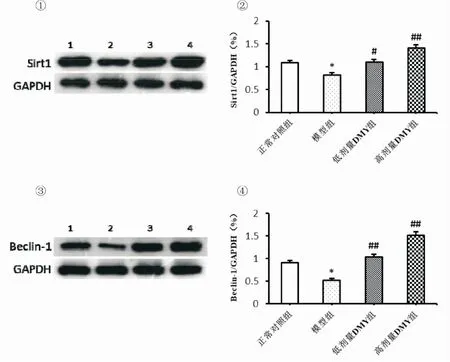
①Sirt1蛋白条带;②各组Sirt1蛋白表达水平的比较;③Beclin-1蛋白条带;
3 讨 论
自噬是一种高度保守的“自食”途径,通过溶酶体降解途径清除细胞内的细胞毒性物质以及受损的细胞器以维持细胞的内稳态和完整性。自噬在人类健康和疾病中起着重要作用,其是维持肾小球和肾小管平衡的重要机制[11]。研究发现,自噬活性受损引起糖尿病条件下的肾小球和肾间质病变,表明自噬受损与DN的发病机制有关[12]。本文也发现模型组相较于正常对照组肾脏组织中自噬关键蛋白LC3表达水平下降,而凋亡相关蛋白Bax表达水平增加,Bcl-2表达水平下降,提示高糖环境可引起大鼠肾脏损伤。因此,以自噬途径为靶点激活或恢复自噬活性可能具有肾脏保护作用。
近年来发现DMY能诱导癌细胞自噬,还能促进细胞自噬抑制高脂诱导动脉粥样硬化[13]。另外,DMY还能促进人脐静脉内皮细胞自噬相关蛋白LC3及Beclin-1的表达[14]。这些研究表明DMY可以正向调控细胞自噬,但DMY能否通过影响细胞自噬对DN产生保护作用尚不清楚。自噬相关基因(autophagy-related gene,Atg)在自噬过程中发挥重要作用,它控制自噬途径的主要步骤,如自噬泡的诱导、延伸以及自噬体和自噬溶酶体的形成。Beclin-1是哺乳动物中调控自噬的重要因子,Beclin-1可诱导前自噬体结构的形成,促进自噬泡的产生[15]。Beclin-1与几种配体结合发挥多种生物学效应,包括调控细胞代谢、凋亡和自噬[16]。研究发现Beclin-1与PI3K相互作用促进LC3的加工导致自噬活性的增加,而与Bcl-2相互作用抑制细胞凋亡[17]。本研究发现,DMY能促进糖尿病肾组织中Beclin-1、LC3蛋白的表达和自噬体的形成,从而增强DN细胞自噬活性。此外,DMY能抑制凋亡相关蛋白Bax的表达,上调Bcl-2蛋白的表达。这些结果表明DMY通过促进自噬,抑制细胞凋亡来发挥对DN大鼠的保护作用。
沉默信息调控因子1(silence information regulator 1,Sirt1)是一种高度保守的NAD+依赖的组蛋白去乙酰化酶,与自噬体的形成密切相关。Sirt1去乙酰化自噬相关蛋白(如Atg5、Beclin-1、LC3等)促进细胞自噬[18]。Beclin-1的表达水平与其赖氨酸残基的乙酰化有关,其乙酰化可抑制自噬体形成。Sirt1对Beclin-1赖氨酸残基的去乙酰化影响自噬体的形成和随后的生物学效应,表明Beclin-1是Sirt1的一个去乙酰化靶点。因此,可通过Beclin-1的去乙酰化来恢复DN自噬活性发挥肾保护作用。研究发现,在糖尿病肥胖大鼠模型中通过饮食控制可恢复Sirt1水平,继而通过提高细胞自噬活性和改善线粒体功能发挥肾保护作用[19]。在人类糖尿病受试者,Sirt1可调控足细胞的功能防止蛋白尿的产生[20]。本研究发现,DMY能上调糖尿病肾脏组织中Sirt1、Beclin-1蛋白的表达。提示DMY可能通过Sirt1对自噬相关蛋白的去乙酰化来促进细胞自噬发挥肾保护作用。
总之,本文通过建立DN大鼠模型,初步证明DMY可能是通过激活Sirt1/自噬信号通路来促进细胞自噬和抑制细胞凋亡,继而对DN大鼠肾脏产生保护作用。本文为DMY用于DN的预防和治疗提供理论和实践参考价值。
