低脂与低碳水化合物饮食治疗非酒精性脂肪肝的meta分析
2019-11-04张玉亭黄一沁陈洁保志军
张玉亭 黄一沁 陈洁 保志军
目前,推荐治疗非酒精性脂肪性肝病(nonal-coholic fatty liver disease,NAFLD)的重要措施包括改变既往膳食模式,增加体育锻炼等。然而,对于NAFLD患者的饮食干预方面,目前并没有一致的观点,通常认为,限制热量及低脂饮食(low fat diet,LFD)有利于NAFLD患者病情的改善[1]。近年来低碳水化合物饮食(low-carbohydrate diet,LCD)也逐渐成为人们关注的热点[2]。本研究收集了国内外通过LCD与LFD改善NAFLD患者病情的相关文献,为治疗NAFLD患者提供一定依据。
资料与方法
一、文献检索策略
文献检索范围包括PubMed、EMBASE、Cochrane library、web of science、中国知网(CNKI)及万方数据库,时限为建库开始至2019年1月。中文关键词:非酒精性脂肪肝、低脂膳食、低脂饮食、低油饮食、低碳水化合物膳食、低碳水化合物饮食、低糖饮食、低糖膳食等;英文关键词:①Non-alcoholic Fatty Liver Disease,NAFLD,Nonalcoholic Fatty Liver Disease,Fatty Liver, Nonalcoholic,Liver, Nonalcoholic Fatty,Nonalcoholic Steatohepatitis,Nonalcoholic Steatohepatitides等;②Diet, Low Carbohydrate,Low Carbohydrate Diets,Carbohydrate-Restricted Diet,Carbohydrate Restricted Diet,Carbohydrate-Restri-cted Diets,Low-Carbohydrate Diet,Low-Carbohyd-rate Diets等;③Diet, Fat-Restricted,Fat-Restricted Diet,Fat Restricted Diet,Fat-Restricted Diets,Low-Fat Diet,Low-Fat Diets,Fat-Free Diet,Fat-Free Diets等。
二、文献纳入与排除标准
纳入标准:①国内外已公开的关于LFD及LCD对NAFLD患者进行干预的随机对照研究,研究文献为全文,语种包括中文与英文;②通过病理或影像学检查明确诊断为非酒精性脂肪肝患者;③文献对研究方法及样本量大小,以及所采取的膳食组成有明确说明;④通过各类方法可获取文献相关数据,或者可以通过相关数据计算得到所需数据。排除标准:①动物实验、摘要、病例报告、综述及重复发表的文献;②无法获取相关数据。
三、文献筛选与质量评价
分别对文献按照纳入和排除标准进行筛选,并按照Cochrane偏倚风险评估工具[3]评估所检索文献质量,同时通过Jadad量表进行评分[4],≤2分者为低质量临床试验,>2分者为高质量临床试验。
四、 亚组分类标准
目前,对LCD并没有一个明确的定义,通常认为,LCD意味着每日碳水化合物的摄入量在目前推荐的每日总能量摄入的45%~65%以下[5]。Feinman等[6]根据美国糖尿病协会(American Diabetes Association,ADA)的推荐,将其进一步划分为4种,①极低碳水化合物饮食(very low-carbohydrate ketogenic diet,VLCKD):碳水化合物摄入量为20~50 g/d或每天摄入总能量2 000 kcal左右,且碳水化合物供能<10%;②LCD:碳水化合物摄入<130 g/d或摄入量低于每日总能量摄入的26%;③中等碳水化合物饮食(moderate-carbohydrate diet,MCD):碳水化合物摄入为总能量的26%~45%;④高碳水化合物饮食(high-carbohydrate diet,HCD):碳水化合物摄入>45%。本研究根据该标准对纳入的文献进行亚组分类,并进行分析。
五、 统计学处理
使用Stata 11.0对所获数据进行分析,评价各研究间的异质性,若I2<50%,考虑研究异质性小,采用固定效应模型对所获数据进行研究,如I2>50%,则考虑研究异质性大,首先考虑采用亚组分析解释,如仍有较大异质性,则使用随机效应模型对数据进行分析,通过Stata软件对所获数据进行敏感性分析,同时,若纳入文献大于10篇,则使用漏斗图与egger检验评估发表偏倚。
结 果
一、文献检索结果
通过文献检索,共获得文献668篇,其中包括中文文献23篇,英文文献645篇,最终纳入符合要求的文献11篇,共计420例NAFLD患者。具体过程见图1。
通过Cochrane偏倚风险评估工具[3]及Jadad量表[4]对相关文献进行评分,见表1,2。

图1 纳入排除流程图
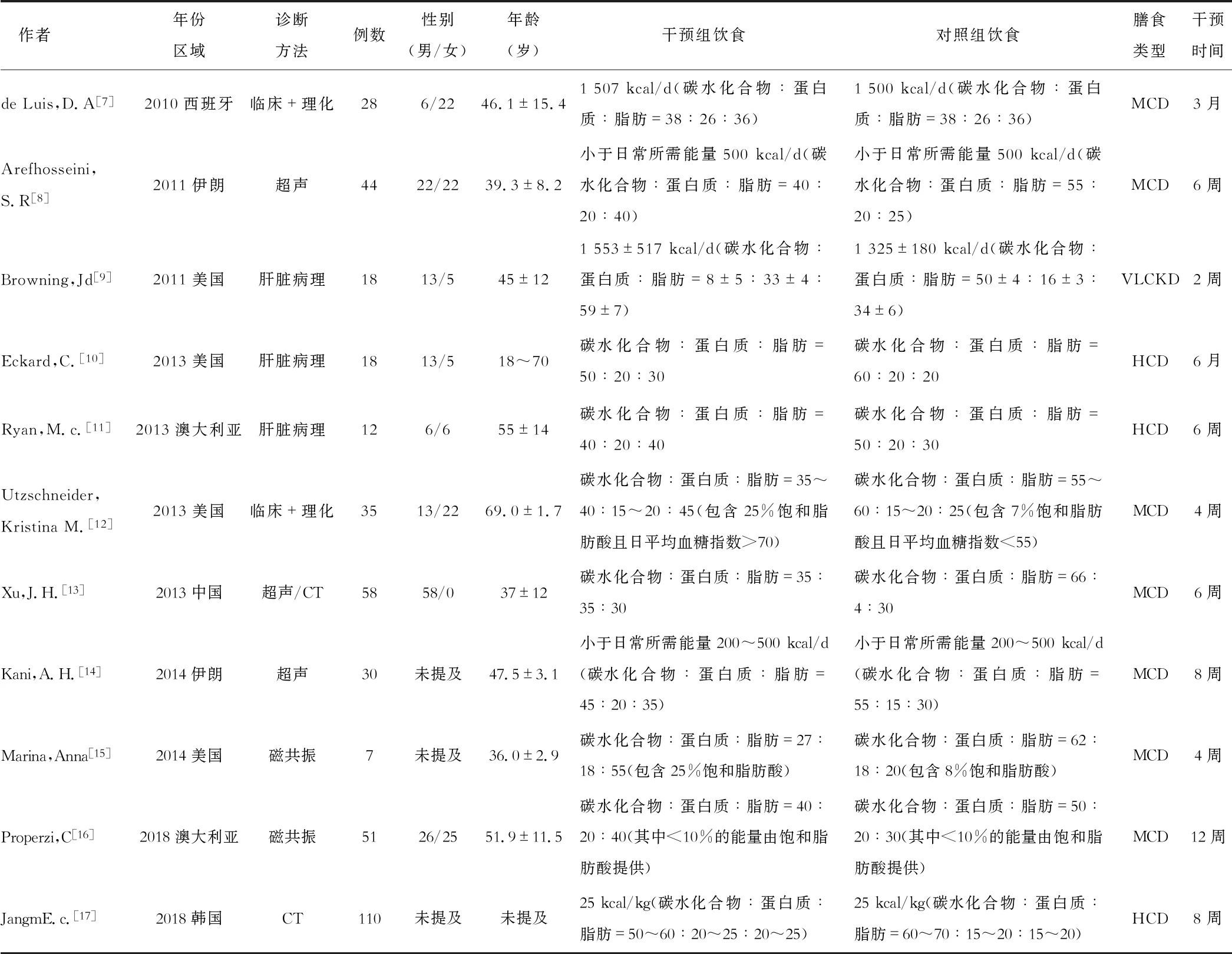
表1 纳入文献的基本特征
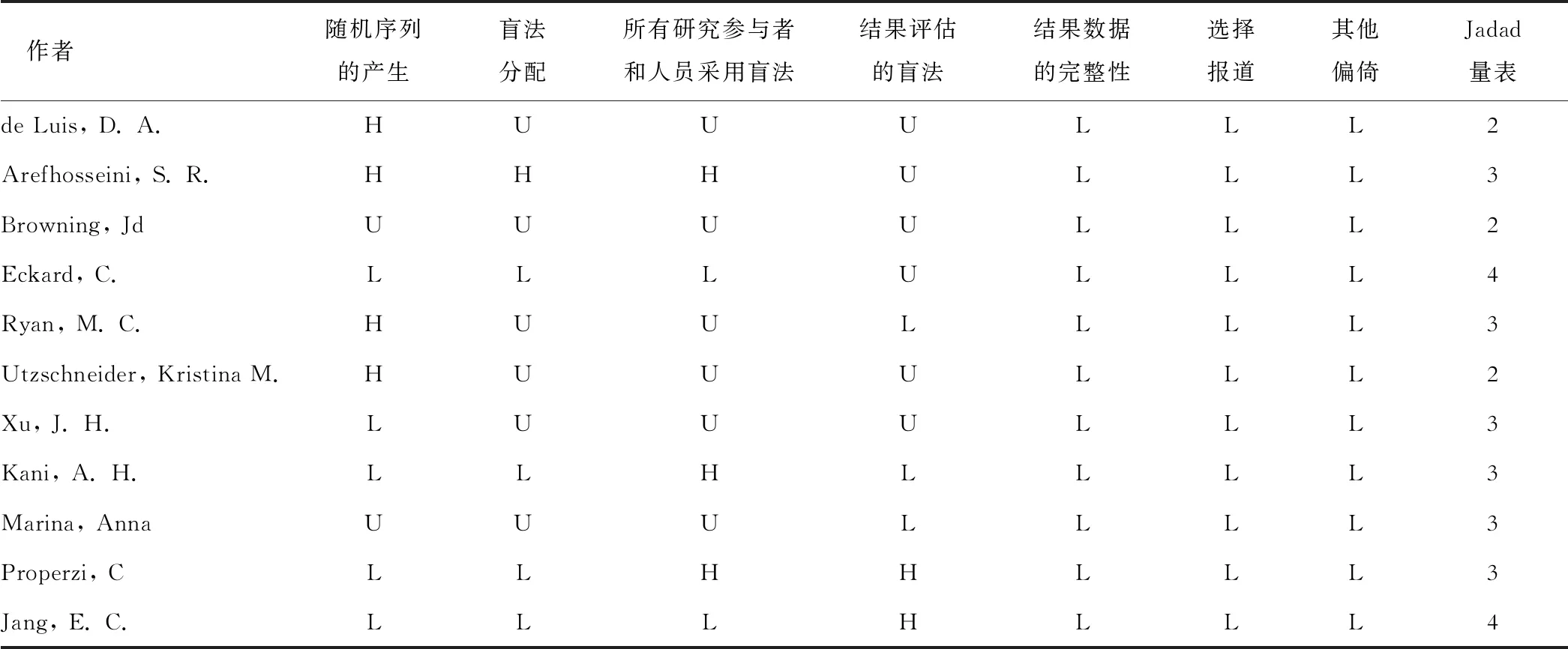
表2 Cochrane 风险偏倚评估和 Jadad 评分
注:根据Cochrane风险偏倚评估标准,H为高风险;L为低风险;U为未知的
二、Meta分析结果
(一)体质量的变化 在纳入分析的11个研究中,10个研究报道了患者体质量的变化[7-9,11-17],纳入373例患者。对数据进行异质性检验,结果提示I2=37.5%,P=0.109,提示异质性小,采用固定效应模型进行分析,合并效应值(MD)=0,95%CI[-0.116,0.277],Z=0.80,P= 0.421,MCD组[7-8,11-16]MD=0.126,95%CI[-0.110,0.363],Z=1.05,P= 0.294,VLCKD组[9]MD=0,95%CI[-0.924,0.924],Z=0,P= 1,HCD组[17]MD=-0.025,95%CI[-0.406,0.356],Z=0.13,P=0.898。提示不管是哪个亚组,LCD相对于LFD来说都没有改善NAFLD患者的体质量,继续进行敏感性分析,结果显示MCD组剔除单个研究后的合并结果均与未剔除时的结果一致,HCD及VLCKD组由于纳入研究过少,无法进行敏感性分析。各亚组纳入文献均少于10篇,故不进行发表偏倚的相关检验。
(二)胆固醇(total cholesterol,TC)和三酰甘油(triglycerides,TG)的变化 有9个研究[7-9,11-12,14-17]对患者TC的改变进行了分析,纳入384例患者,进一步进行亚组分析,MCD组[7-8,11-12,14-16]异质性检验提示I2=51.5%,使用随机效应模型进行分析,结果提示MD=-3.555,95%CI[-13.757,6.647],Z=0.68,P= 0.495,提示采用MCD饮食相对于LFD来说并没有改善脂肪肝患者的TC水平,对MCD组进行敏感性分析,剔除单个研究后,合并结果与未剔除时一致。VLCKD组[9]仅纳入1个研究,用固定效应模型进行分析,MD=-0.705,95%CI[-1.661,0.251],Z=1.45,P= 0.148,表明VLCKD饮食相对于LFD也未改善脂肪肝患者TC水平。HCD组[17]同样纳入1个研究,结果显示MD=-0.59,95%CI[-0.979,-0.201],Z=2.97,P= 0.003,提示HCD组相对于低脂饮食组可以降低NAFLD患者的 TG水平。
有9个研究[7-9,11,13-17]对患者TG的改变进行了分析,共纳入373例患者,其中MCD组[7-8,11,13-16]纳入研究7个,异质性检验提示I2=73.2%,P=0.001,提示具有异质性,用随机效应模型分析,MD=-32.141,95%CI[-58.280,-6.001],Z=2.41,P= 0.016,提示MCD饮食较低脂饮食组可以降低NAFLD患者的TG水平,敏感性分析显示剔除单个研究后,合并结果与总体一致。VLCKD组[9]纳入1个研究,分析所得结果MD=-0.297,95%CI[-1.226,0.633],Z=0.63,P= 0.532,表明两种饮食在降低脂肪肝患者TG水平上无差异。同样纳入HCD组[17]研究1个,固定效应模型分析MD=-0.153,95%CI[-0.535,0.228],Z=0.79,P= 0.431,提示相对于LFD组而言,HCD组并没有改善NAFLD患者的TG水平。
(三)高密度脂蛋白(high-density lipoprotein,HDL)和低密度脂蛋白(low-density lipoprotein,LDL)的变化 在纳入的11个研究中,有8个[7-8,11,12-16]共284例患者对HDL进行了分析,均属于MCD组,异质性检验结果提示I2=87.3%,P<0.01,使用随机效应模型进行分析,结果分析MD=1.319,95%CI[-3.818,6.456],Z=0.5,P= 0.615,提示MCD饮食较LFD组并不能降低NAFLD患者的HDL水平,敏感性分析显示剔除单个研究后,合并结果与总体一致。
8个研究[7-8,12-17]对LDL进行了分析,其中7个[7-8,12-16]属于MCD组,进行异质性检验,得到I2=98.7%,P<0.01,研究之间有异质性,使用随机效应模型进行分析,结果MCD组MD=-18.173,95%CI[-52.374,16.028],Z=1.04,P= 0.298,HCD组[17]MD=-10.100,95%CI[-21.067,0.867],Z=1.8,P= 0.071,提示无论是MCD饮食还是HCD饮食,其较LFD组都不能降低NAFLD患者的LDL水平,对MCD组进行敏感性分析,结果显示剔除单个研究后,合并结果与总体一致。
(三)ALT、AST和谷氨酰胺转移酶(gamma-glutamyl transpeptidase,GGT)水平的变化 一共有10个研究[7-9,11-17],对408例患者ALT进行了分析,其中MCD组[7-8,11-16]8个,VLCKD组[9]1个,HDL组[17]1个,MCD组异质性检验提示I2=95.9%,P<0.01,故用随机效应模型分析,结果提示MCD组MD=0.321,95%CI[-5.956,6.597],Z=0.1,P= 0.92,敏感性分析示剔除单个研究后,合并结果与总体一致;VLCKD组MD=17.000,95%CI[-16.632,50.632],Z=0.99,P= 0.322,HCD组MD=-25.800,95%CI[-44.411,-7.189],Z=0.28,P= 0.78,结果提示MCD以及VLCKD组较LFD并不能降低NAFLD患者的ALT水平,而HCD组饮食比起LFD可以更好地降低NAFLD患者的ALT。
7个研究[7-9,13-15,17]对AST的变化进行了分析,纳入298例患者,包括MCD组[7-8,13-15]5个,VLCKD[9]组1个,HDL组[17]1个,异质性检验提示I2=97.2%,P<0.01,表示研究之间存在异质性,采用随机效应模型进行分析,结果提示MCD组MD=-2.564,95%CI[-10.683,5.555],Z=0.62,P= 0.536,VLCKD组 MD=2.000,95%CI[-0.922,4.922],Z=1.34,P= 0.180,HCD 组 MD=-6.600,95%CI[-16.253,3.053],Z=1.34,P=0.180。提示 LCD 较 LFD 并不能降低 NAFLD患者的 AST 水平,MCD 组敏感性分析示剔除单个研究后,合并结果与总体一致。
5个研究[7,11,15-17]对GGT的水平进行了分析,其中包括MCD组[7,11,15-16]4个,HCD组[17]1个,对MCD组进行异质性检验,提示I2=21.6%,P=0.281,使用固定效应模型进行分析,结果提示MD=-0.092,95%CI[-0.458,0.274],Z=0.49,P=0.622,敏感性分析显示剔除单号研究后,合并结果与总体一致,表明MCD组较LFD组不能降低NAFLD患者的GGT水平;HCD组分析结果提示MD=-0.011,95%CI[-0.370,0.392],Z=0.06,P= 0.955,表示HCD组较LFD组并不能降低NAFLD患者的GGT水平。
(四)肝脏脂肪含量的变化 在纳入统计的11个研究中,有7个使用不同方法对肝内脂肪变化进行了评估,见表3,其中,有4个研究使用MRI对肝内脂肪变化进行了评估,其中包括VLCKD组1个[9],MCD组3个[11,15-16],MCD组异质性检验提示I2=45.3%,P=0.161,使用固定效应模型分析,结果提示MD=0.369,95%CI[-0.055,0.793],Z=1.71,P= 0.088,VLCKD组MD=-0.571,95%CI[-1.516,0.373],Z=1.19,P=0.236,表明LCD较LFD不能改善患者的肝脏MRS指标变化。同时根据实验持续时间对使用MRI评估肝内脂肪的文章进行分析,≤4周的实验有2个[9,15],异质性检验提示I2<0.01%,P=0.449,使用固定效应模型进行分析,结果MD=0.088,95%CI[-0.327,-1.029],Z=0.91,P=0.361,表明≤4周的亚组中,低碳水化合物饮食与LFD在改善患者的肝脏MRS指标变化上差异无统计学意义,在干预4~8周的亚组[10]中,通过评价患者肝内脂肪的变化,结果提示:无论是低碳水化合物组还是LFD组,实验前后,患者肝脏的脂肪含量均有减少(P<0.05),但就两组之间进行数据分析,发现MD=0.395,95%CI[-0.478,1.268],Z=0.89,P=0.375。同时,Jang等[17]也对肝脏CT值的变化进行了分析,结果提示LFD组实验前后肝脏脂肪变化差异无统计学意义(P=0.168),而LCD组实验前后肝脏脂肪减少,结果差异有统计学意义(P=0.05),组间分析显示MD=0.281,95%CI[-0.102,0.664],Z=1.44,P=0.150。Arefhosseini等[8]用肝脏超声测量肝纤维化水平,结果显示无论是低碳水化合物组还是LFD组,实验前后肝脏纤维化水平的变化差异均有统计学意义。

表3 各类低碳水化合物干预下肝内脂肪变化情况
讨 论
本次 meta 分析纳入了11个中英文临床研究,数量较少,且这些研究之间的异质性偏高,临床结果也不尽相同。分析结果表明,虽然纳入的研究中或多或少提及到LCD与LFD对NAFLD患者病情有改善作用,但LCD和LFD在降低NAFLD患者肝脏脂肪含量与和改善血液生化方面并没有显著差异。考虑原因可能有以下几点:首先,目前对于NAFLD的评估并没有一个公认的适合于临床的简便有效的评价标准,肝脏病理虽然是诊断NAFLD的金标准,但其有创性使其不可能常规应用于临床。在纳入的11个研究中,仅3个通过病理对NAFLD患者进行了诊断[9-11],仅有1个研究评估了患者通过饮食进行干预后的肝脏病理改变情况[10],大多数研究使用了MRS来评估肝内脂肪量,也有少部分采取了CT或者肝脏硬度数据测量评估肝脏脂肪变情况,或者仅仅通过血液化学指标来评估肝功能改善情况,这些并不足以充分地说明NAFLD患者的病情。第二,没有对碳水化合物的类型进行研究,即使摄入了同样数量的碳水化合物,但NAFLD的程度也可以根据摄入碳水化合物的类型发生改变,目前认为,包括果糖在内的单糖对NAFLD的发生有着不利影响[18],但纳入的11项研究中,仅有3个对患者摄入单糖的量进行了研究[12,15-16]。在Properzi[16]等的研究中,LCD饮食实验前后的单糖摄入量差异有统计学意义,而LFD实验前后的单糖摄入量变化差异无统计学意义,结果显示LCD组实验前后改善的指标要明显多于LFD组。第三,世界各地对低碳水化合物的定义并不统一,考虑到地区之间的差异与居民的接受程度,大部分研究对LCD组中碳水化合物的比例进行了调整,在韩国的研究中,LCD被设置为50%~60%的比例,这甚至高于某些地区正常碳水化合物的摄入量[17]。第四,研究的时限较短,纳入的11个研究时限均<6个月,最短的研究实验时间甚至只有2周[9]。无法说明长期干预下患者的依从性。最后,纳入研究的人数较少,多数研究仅纳入了几十例患者,甚至仅对7例患者进行了研究[15],限制了研究的代表性。
总之,在此次meta分析中,几乎没有证据表明LCD与LFD相比更有利于脂肪肝的治疗,LCD与LFD在NAFLD治疗上孰优孰劣,证据仍然缺乏,亟待进行更多的调查和循证研究来评估两种饮食的效果与长期作用。
