比格犬生理遥测系统的建立
2019-11-04刘艳菊徐德璐兰天龙周博宇
刘艳菊,葛 鹏,徐德璐,钟 飞,兰天龙,周博宇,胡 雷*
(1.天津药物研究院新药评价有限公司,天津 300301; 2.天津市新药非临床评价技术工程中心,天津 300301)
比格犬血压的检测方法包括传统的麻醉动物插管法和新兴的生理遥测技术。插管法是通过插管手术检测麻醉动物的生理信号,由于手术创伤和麻醉剂的作用,容易引起动物应激,导致血压、心电、呼吸等生理信号产生较大波动,并且监测时间很受限制,很难实现对血压等生理参数进行长期有效监测[1]。应用生理遥测技术可以同时对动物在清醒状态下的心电、血压、呼吸等指标[2]进行检测,由生理遥测技术所采集数据的可靠性已经得到各国专家的认可,因此《药物安全药理学研究技术指导原则》建议采用遥测技术进行清醒动物心血管系统指标的测定。
目前国内通过遥测技术检测比格犬血压的方法主要分为尾套法和植入法。尾套法是在比格犬尾根部绑上压力绑带,应用遥测技术通过周期性循环充放气间接检测动物血压。相较于传统的插管法,尾套法检测的是清醒动物的血压,排除了麻醉药对生理指标的干扰,但是该方法只能间断性的、间接的检测动物血压,无法持续、直观的观察血压的变化,数据离散度大、重复性差[1-3],并且受充气放气时间限制,测量数值少,不适合应用于对血压影响较敏感的药物实验[4]。植入法是通过手术方法将生物传感器植入动物体内,再由接收和显示等一系列装置来测定清醒状态下实验动物的生理指标,如血压、心率、心电图、呼吸等。目前国内比较常用的生物传感器为DSI公司生产的植入子[5-7],但是DSI植入子造价较高,限制了其在GLP实验室的广泛应用。
本研究旨在建立一种数值更加稳定、可靠,并且造价更为低廉的模型犬生理遥测系统,为我国安全药理学研究提供技术支撑与参考。
1 材料和方法
1.1 实验动物
普通级10~11月龄比格犬,体重为9~11 kg,上海新冈实验动物场提供[SCXK(沪)2017-0006]。饲养于天津药物研究院新药评价有限公司动物实验楼[SYXK(津)2016-0009],单笼饲养,饲养间温度控制在16℃~26℃,湿度40%~70%,换气次数每小时不少于8次全新风,光照为12 h明12 h暗交替。实验动物的使用完全遵守中华人民共和国的相关实验动物福利的管理规定,动物使用前向本中心的动物福利委员会(IACUC)提出申请,经动物福利委员会批准后使用。
1.2 主要试剂与仪器
戊巴比妥钠(每瓶25 g,德国默克);注射用氨苄西林钠(每瓶0.5 g,石药集团中诺药业);硫酸阿米卡星注射液(2 mL∶0.2 g,齐鲁制药有限公司);硫酸阿托品注射液(1 mL∶0.5 mg,天津金耀氨基酸有限公司);肝素钠注射液(1 mL∶1.25万单位,天津生物化学制药有限公司)。
生理信号遥测系统(型号EMKApack8A-6E-2RESP-ACT-TEMP-NIBP-VAP,法国EMKA公司生产);VAP血管通路(产品编号INLINEPORT-AC-7IS,美国Norfolk医药生产);手术器械、注射器、敷料等。
1.3 实验方法
1.3.1 术前准备
术前1 d,剃除犬颈部至背部之间的被毛,并用纱布蘸取温水擦拭裸露皮肤,隔夜禁食。为避免麻醉或手术过程中发生呕吐,麻醉前30 min肌注1支硫酸阿托品注射液。
(一)VAP植入手术(见图1)
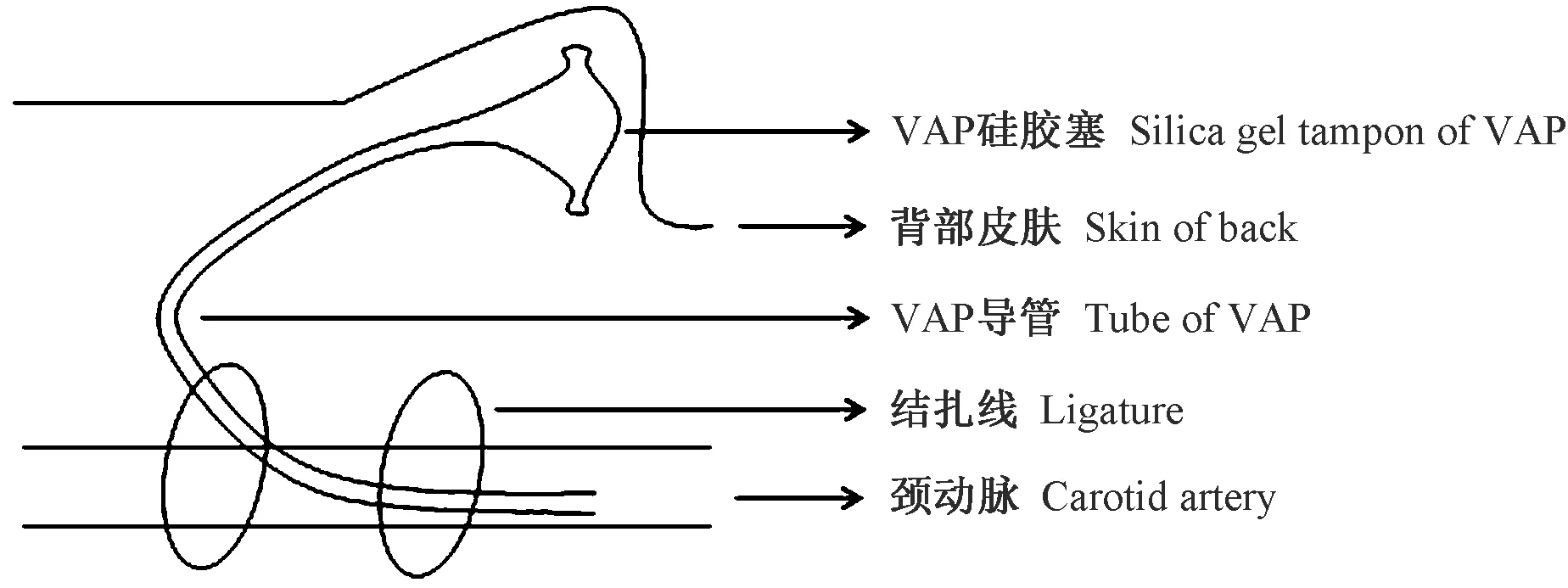
图1 VAP植入示意图Figure 1 Schematic diagram of the VAP implantation
动物麻醉后剥离一侧颈动脉,在动物背部做一切口,从背部切口向颈部切口做一皮下隧道,将注满生理盐水的VAP血管通路穿过皮下隧道,一端置于背部切口,另一端置于颈部切口。将分离出的颈动脉近心端用静脉夹夹住,远心端结扎并在近心侧剪一小口,将颈部切口处的通路导管从动脉切口处向近心端方向插入4~8 cm,双侧结扎,将埋在背部皮下的通路导管套上硅胶塞固定,并用生理盐水冲洗导管,1000 IU/mL的肝素钠溶液封管,最后缝合包扎,放回笼内饲养。
1.3.2 术后护理
(一)抗感染处理
术后应给予常规抗感染治疗,肌注2支注射用氨苄西林钠和1支硫酸阿米卡星,抗生素治疗至少5 d,视动物恢复情况可适当延长疗程。每天用碘伏涂抹创口消毒并及时更换纱布,保持创口的清洁。如发生创口感染,应用大量生理盐水冲洗伤口,涂抹碘伏,并适当加大抗生素剂量或更换抗生素品种。通常7~10 d可拆除缝合线,拆线后根据创口情况予以消毒。
(二)抗凝处理
术后连续3 d,每天用注射器插入硅胶塞抽取导管内陈旧血液,然后用生理盐水冲洗导管,最后用2 mL∶1.25万单位的肝素钠注射液封管,之后每隔3 d进行一次抗凝处理,连续3周后改为每周1次。
(三)减压处理
术后部分动物颈部创口会有血性渗出导致局部肿胀、内压增高,此时要及时穿刺抽取渗出物,以减轻局部压力,利于手术恢复。穿刺时,动物采取站位,专人保定,局部消毒,选择低位作为进针点。观察抽出液体的颜色、澄明度和体积,穿刺完毕要及时消毒。
(四)术后营养补充
由于受到手术的刺激与损伤,有些动物会出现食欲下降的情况,可以适当通过静脉推注葡萄糖注射液和生理盐水来补充能量,对于饮食正常的动物可适当增加喂食量,使动物多摄入营养,尽快恢复体力,以利于创口愈合。
(五)模型犬数据采集
动物创口愈合后,将模型犬胸腹部被毛剃出,分别在左、右两侧第6肋间与胸骨的连接处和第1对乳头下缘的皮肤表面粘上心电电极贴,然后将模型犬固定于输液架上的布兜内;将呼吸绑带系于动物胸腔剑突处,连接呼吸换能器;将压力换能器上的采集针与埋入动物体内的VAP血管通路的硅胶塞相连接,最后将心电电极、呼吸换能器和压力换能器与采集盒连接,打开采集盒即可检测血压、心电和呼吸指标。
(六)观察指标
血压指标:舒张压(DBP)、收缩压(SBP)、平均动脉压(MBP);心电指标:心率、PR间期、QRS波群、R波电压、P波电压、S-T段电压、QT间期、QTc间期;呼吸指标:呼吸频率和呼吸幅度。心电指标采样频率为500 Hz,血压指标采样频率为200 Hz,呼吸采样频率为200 Hz。应用EMKA生理信号遥测系统的iox软件采集数据,ecgAUTO软件分析各指标。
1.4 统计学处理
2 结果
2.1 比格犬生理遥测系统稳定性的验证
6只VAP模型犬每周检测一次血压、心电和呼吸指标,数据采集时间限定在08:00~10:00之间,避开饲养员喂食和清扫时间,检测周期为四周,将比格犬四次的生理指标进行多重比较可见:模型犬四周的血压平稳、心率较齐、心电各指标未见明显波动,尽管呼吸频率和呼吸幅度出现轻微波动,但是未出现统计学差异(见表1~3)。
2.2 清醒犬与麻醉犬生理指标的比较
应用EMKA生理信号遥测系统采集24只VAP模型犬清醒状态下和24只麻醉犬稳定状态下的生理指标。从数据上看,麻醉犬舒张压、收缩压和平均动脉压均明显高于模型犬;与清醒模型犬比较,麻醉犬心率明显加快,P-R间期缩短,QTc间期显著延长,并且R波、P波和S-T段电压也出现统计学差异;此外,麻醉犬呼吸频率和呼吸幅度均低于模型犬(见表4~6)。
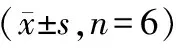
表1 VAP模型犬血压
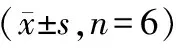
表2 VAP模型犬心电
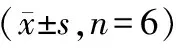
表3 VAP模型犬呼吸
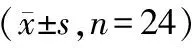
表4 清醒犬与麻醉犬血压的比较
注:与清醒犬组相比,*P<0.05。
Note.Compared with the conscious dog group,*P< 0.05.
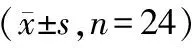
表5 清醒犬与麻醉犬心电的比较
注:与清醒犬组相比,*P<0.05。
Note. Compared with the conscious dog group,*P< 0.05.
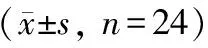
表6 清醒犬与麻醉犬呼吸的比较
注:与清醒犬组相比,*P<0.05。
Note. Compared with the conscious dog group,*P< 0.05.
2.3 比格犬生理遥测系统敏感性的验证
6只VAP模型犬灌胃给予阿齐沙坦酯,与给药前比较,药后1、2小时动物舒张压(DBP)、收缩压(SBP)和平均动脉压(MBP)降低(见图2),与文献[8-10]报道的阿齐沙坦酯降压的药理作用一致,说明本系统能灵敏检测到血压指标的的相关变化。特非那定为典型的QT 间期延长药物[11-12],4只模型犬灌胃给予特非那定,与给药前比较,药后比格犬心率下降,PR间期、QRS波群延长,QTc 间期明显延长,结果与文献[13]报道基本一致(见图3)。

注:给药后与给药前比较,*P<0.05,** P <0.01。图2 VAP模型犬给药前后血压的比较Note. Compared after administration with before administration, *P<0.05,** P <0.01.Figure 2 Comparison of the blood pressure before and after drug administration in the VAP model dogs

注:给药后与给药前比较,*P<0.05,**P <0.01。图3 VAP模型犬给药前后心电的比较Note. Compared after drug administration with before administration, *P<0.05,**P <0.01.Figure 3 Comparison of the ECG before and after drug administration in the VAP model dogs
3 讨论
要想获得成功的VAP动物模型,首先要有合格的实验动物作为保证,术前在挑选动物时,应选择体格健壮、比例匀称的成年比格犬,便于统一VAP血管通路的植入及位置固定;由于检测的是动物清醒状态下的指标,因此应选择性格温顺、依从性强的动物。其次,在手术过程中要做好消毒工作,尽量接近无菌条件;颈部和背部的创口不宜过大,以免破坏皮下小血管造成失血,影响术后恢复;不同动物导管植入位置尽量统一,例如均植入右侧颈动脉,硅胶塞埋入皮下位置不宜过深,否则影响血压采集针的进入,而且埋入位置应避开创口,以防影响创口愈合,导管在皮下的走形应尽量避免出现多次回弯和折叠,否则会影响血压的传导,导管进入血管的深浅和结扎线的松紧同样会影响血压信号的传导。最后,术后一定要做好抗感染治疗,根据动物恢复情况适当延长抗生素给药时间,或者及时更换抗生素,若皮下有渗出液应及时引流;术后抗凝处理是模型成功的关键,应定时对模型进行抗凝处理,针对个别容易产生血栓的动物可适当增加抗凝频率,在日常一般观察中应密切观察模型动物是否出现栓塞症状,对于栓塞动物酌情进行溶栓治疗,对于无抢救价值的动物应实施安乐死并进行剖检,便于总结积累经验,更好的指导下次手术。此外,在模型犬的使用过程中一些内外界的干扰因素也不容忽视,例如动物的指标存在正常生理波动、动物进食、人员靠近、外界噪音等也可以影响动物的生理活动,因此在动物进入正式实验前应对动物进行驯化,提高动物抗干扰能力,并且在采集数据时应尽量减少人工干预和外来刺激,例如减少实验人员的轮换、增强实验室的隔音效果等。
在VAP模型犬稳定性研究中可见,模型犬四周之内血压、心电基本上无差异变化,数据稳定,具有可重复性;四次呼吸指标两两比较均未出现统计学差异,但是从数据上看,与第一次检测结果比较,后三次模型犬的呼吸频率轻微降低,呼吸幅度略有增大,推测可能是由于动物在进行第一次指标检测会出现紧张、不适、应激[14]等情况,因此出现呼吸频率加快、呼吸幅度减小的现象,提示可以通过对动物进行多次驯化,提高动物抗干扰能力,以保证呼吸数据的准确性和稳定性。
与清醒的模型犬比较,麻醉状态下比格犬呼吸频率降低、呼吸幅度减小,分析可能是由巴比妥类麻醉剂呼吸抑制作用[15]引起的。在本研究中还发现麻醉犬血压明显高于模型犬,究其原因除了与血压检测部位不同有关,还可能与动物的麻醉程度有关,动物处于浅麻醉状态下交感神经兴奋,会出现血压升高和心率加快的情况,反之亦然。QTc间期是用心率校正后的QT间期,是反映心脏去极化和复极作用的指标,QTc间期延长表示心脏复极延迟,反映了心电异常,通常与心律失常敏感性增高密切相关,因此QTc间期是评价药物心脏毒性的重要指标。国内学者蒋文燕等[16]将动物麻醉后与麻醉前进行自身对照,发现QT间期在麻醉45 min后明显延长,在本研究中也发现麻醉动物的QTc间期明显大于清醒犬。若用麻醉动物评价药物心脏毒性,容易对评价结果产生干扰,产生假阳性,以致误杀具有研发价值的受试物。24只模型犬心率平均值为(116.37±25.58) bpm,接近文献报道值66~130 bpm[17-18]的上限,舒张压和收缩压平均值分别为(90.87±14.35)mmHg、(129.72±18.80)mmHg,与国外学者Nakagawa等[19]采用Telemetry方法所报道结果基本一致,但是略低于国内实验动物学教材所列举的舒张压和收缩压的值(100 mmHg、148 mmHg),分析原因可能是该方法对犬的刺激干扰较小,因此更加接近动物正常生理状态下的平稳血压。
VAP模型犬生理遥测系统应用于药物安全性评价具有诸多优势:(1)与传统的麻醉插管法比较,排除了麻醉药的干扰和限制,数据更接近动物自然状态下的数值,适合多种给药方式,可较长时间连续监测生理指标,洗脱后仍可重复使用多次,减少了动物的使用,更加符合AAALAC对动物福利的要求,同时也降低了药物研发成本;(2)尾套法采集的是外周血压,属于间接检测法,而本方法是直接检测大动脉的血压,数值更加准确、连续、稳定,在评价降压药时具有明显优势;(3)与DSI植入式遥测法比较, VAP模型犬的植入子更加低廉,较大程度上节约了研究成本。
目前遥测技术受到各地方GLP实验室的青睐,已广泛应用于药物安全性评价当中,然而将VAP植入手术与遥测技术相结合的试验方式在我国尚无充足的经验可借鉴,因此仍存在一些问题有待进一步研究和探索,例如导管植入的深浅、导管在皮下的走形、结扎线的松紧以及导管内的抗凝处理目前尚无统一标准。其中导管的抗凝处理是模型成功的关键,抗凝剂量过低,容易引起血栓形成,影响血压信号的传输;抗凝剂量过高,动物凝血功能异常,容易与具有抗凝作用的受试物产生协同作用,因此不建议将VAP模型犬应用于抗凝药的安全性评价中。
综上所述,本研究建立的比格犬生理遥测系统数值稳定、可靠、重复性好、灵敏性高,并且成本低廉、动物利用率高,将其应用于药物安全药理学评价中具有可行性。
