残次枣粉添加青贮苜蓿中微生物、发酵和营养品质动态规律
2019-11-04席琳乔张凡凡王旭哲马春晖
张 玲,席琳乔,张凡凡,王旭哲,马春晖
(1. 石河子大学动物科技学院,新疆石河子 83200;2. 塔里木大学动物科学学院/新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
0 引 言
【研究意义】紫花苜蓿(MedicagosativaL.)营养丰富,消化率高,苜蓿青贮饲喂奶牛,产奶量高,是优质牧草[1]。但因苜蓿较高的蛋白含量与缓冲度、较低的可溶性碳水化合物,单独青贮不易成功;同时原料上附着的乳酸菌数量少,不良微生物在发酵过程中占据主导作用,导致青贮饲料干物质损失和蛋白水解[2-4]。【前人研究进展】骏枣(ZiziphusRhamnaceae)作为南疆地区红枣产品中的龙头产业,近年来因天气、加工技术和供求等因素影响,每年产生年总产量10%~15%的残次枣果[5],这些残次枣果不仅容易储藏利用,而且含有较高的糖、维生素、氨基酸和矿物质等营养物质,其中总糖含量约为50.3%~80.9%[6]。然而其表面附着多种致腐微生物[7],不利于单独青贮。因此将其干燥后作为添加剂与高水分苜蓿青贮,不仅可抑制不良微生物繁殖,增加青贮早期有益菌乳酸菌数量,快速形成理想的酸性环境,降低pH,改善青贮发酵品质;而且可控制青贮饲料的水分含量,减少能量损失。【本研究切入点】目前有关紫花苜蓿青贮方面的研究主要集中于有氧稳定期青贮发酵品质的影响[3,8,9],但是枣粉添加至高水分紫花苜蓿中进行青贮研究较少[10],尤其是针对其青贮发酵过程中微生物数量、发酵和营养品质的变化规律未见报道。研究不同添加量的残次枣粉对紫花苜蓿青贮发酵过程中微生物数量、发酵和营养品质动态变化的影响。【拟解决的关键问题】研究设置不同添加量的残次枣粉与紫花苜蓿青贮,在青贮发酵过程中不同发酵阶段的不同时间点对青贮饲料微生物数量、发酵特征和营养品质的动态变化规律进行分析,筛选出适宜的枣粉添加量,为研究青贮发酵机理和广泛应用提供理论指导。
1 材料与方法
1.1 材 料
紫花苜蓿为第三茬盛花期三得利(Medicagosativa‘sanditi’),种植于新疆阿克苏地区温宿县沙河镇第一师五团试验田(N41°17′38.1′′~41°21′35.9′′,E80°40′07.1′′~80°47′38.2′′),其含水量为72%左右,粉碎(1~2 cm)备用。残次骏枣选自新疆阿拉尔市丰之源红枣加工厂,剔除发霉和变质的骏枣,带核干燥(65℃)至含水量10%以下,粉碎备用。
1.2 方 法
1.2.1 试验设计
依据青贮发酵所需的最低可溶性碳水化合物(占青贮鲜重的1~1.5%)标准,设计6个不同残次枣粉添加量处理,分别按照对照处理(T0处理),即不添加枣粉、0.5%(T1处理)、2.5%(T2处理)、5%(T3处理)、7.5%(T4处理)、10%(T5处理)的添加量添加至粉碎的紫花苜蓿中。添加后混匀,用喷壶喷洒去离子水(72%)以保证发酵体系含水量的一致性。取不同处理的青贮原料置于冰盒中,带回实验室,-20℃贮藏,用于微生物菌落、发酵品质和营养成分的测定。同时将不同处理的青贮样品装入33 cm×48 cm的聚乙烯青贮袋中,每袋1.5 kg,每个处理3次重复,用真空包装机(DZQ500-1D)抽真空密封,室温下贮藏60 d,分别于发酵的第1 d、3 d、7 d、15 d、30 d、60 d(模拟开窖)取不同处理样品,弃去上层,取中间样品,监测乳酸菌、酵母菌、霉菌、好氧细菌数量变化以及用于发酵品质和营养成分分析。
1.2.2 测定指标
利用稀释平板涂布法对微生物菌落进行计数。每个处理各取5 g样品加入45 mL灭菌水的三角瓶中,置于摇床振荡30 min,用灭菌水将所得溶液稀释,制成10-1~10-7系列稀释梯度。乳酸菌(Lactic acid bacteria, LAB)在MRS培养基上,37℃厌氧条件下培养48 h;酵母菌(Yeast)和霉菌(Mold)分别在麦芽糖浸粉琼脂培养基和高盐察氏培养基上28℃条件下培养24~36 h;好氧细菌(Aerobic bacteria, AB)在营养琼脂培养基上,30℃有氧条件下培养24~48 h。采用菌落计数器计数。
发酵指标和营养品质主要测定pH、乳酸(Lactic acid, LA)、乙酸(Acetic acid, AA)、铵态氮(NH3-N)、总氮(TN)、干物质(Dry matter, DM)、粗蛋白(Crude protein, CP)、中性洗涤纤维(Neutral detergent fiber, NDF)、酸性洗涤纤维(Acid detergent fiber, ADF)、可溶性碳水化合物(Water soluble carbohydrate, WSC)。其中pH采用PHSJ-5智能酸度计测定,LA和AA采用HPLC测定,NH3-N采用苯酚-次氯酸比色法测定[8-9],TN和CP采用顶级碳氮元素分析仪测定(Vario MICRO cube,德国Elementar公司),DM采用重量法测定,NDF和ADF采用范氏(Van Soest)洗涤纤维法,WSC采用蒽酮-硫酸比色法测定[10]。
1.3 数据处理
运用Excel 2010软件对所有数据进行初步整理,采用SPSS 20.0软件进行方差分析,并采用Duncan法进行多重比较。
2 结果与分析
2.1 残次枣粉对苜蓿青贮发酵过程中微生物数量、发酵品质和营养成分的动态变化
添加残次枣粉对苜蓿青贮前后各处理微生物种类和数量动态变化为,青贮前乳酸菌数量为5.05~5.80 log cfu(g·FM),酵母菌数量为6.88~7.27 log cfu(g·FM),霉菌数量为3.40~4.06 log cfu(g·FM),好氧细菌数量为8.01~9.24 log cfu(g·FM)。可见附着微生物数量最多的是好氧细菌,其次是酵母菌,之后是乳酸菌,霉菌数量最少。T4处理的乳酸菌数量显著高于其余处理(P<0.05),T0处理的酵母菌和霉菌数量最高(P<0.05)。表1
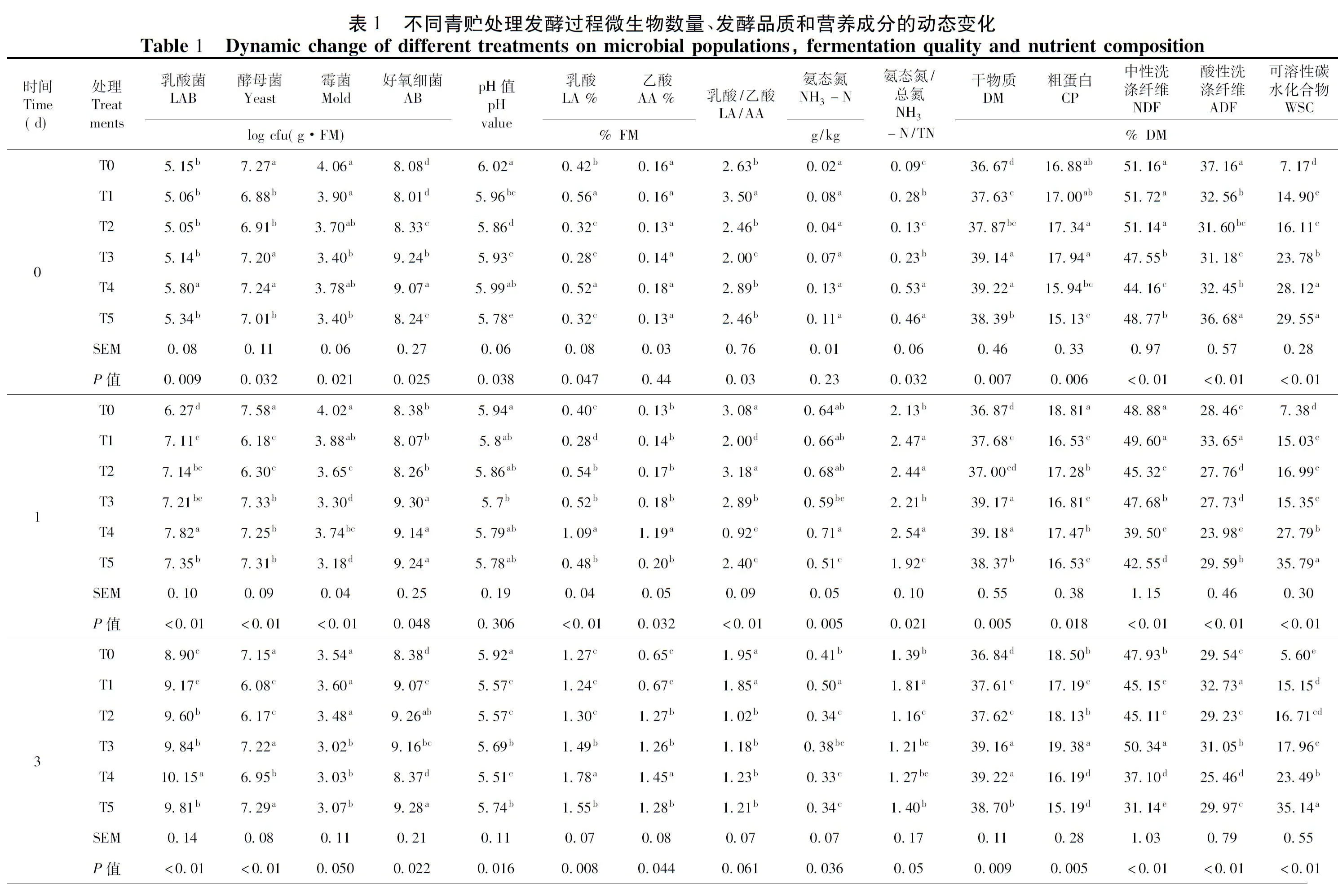
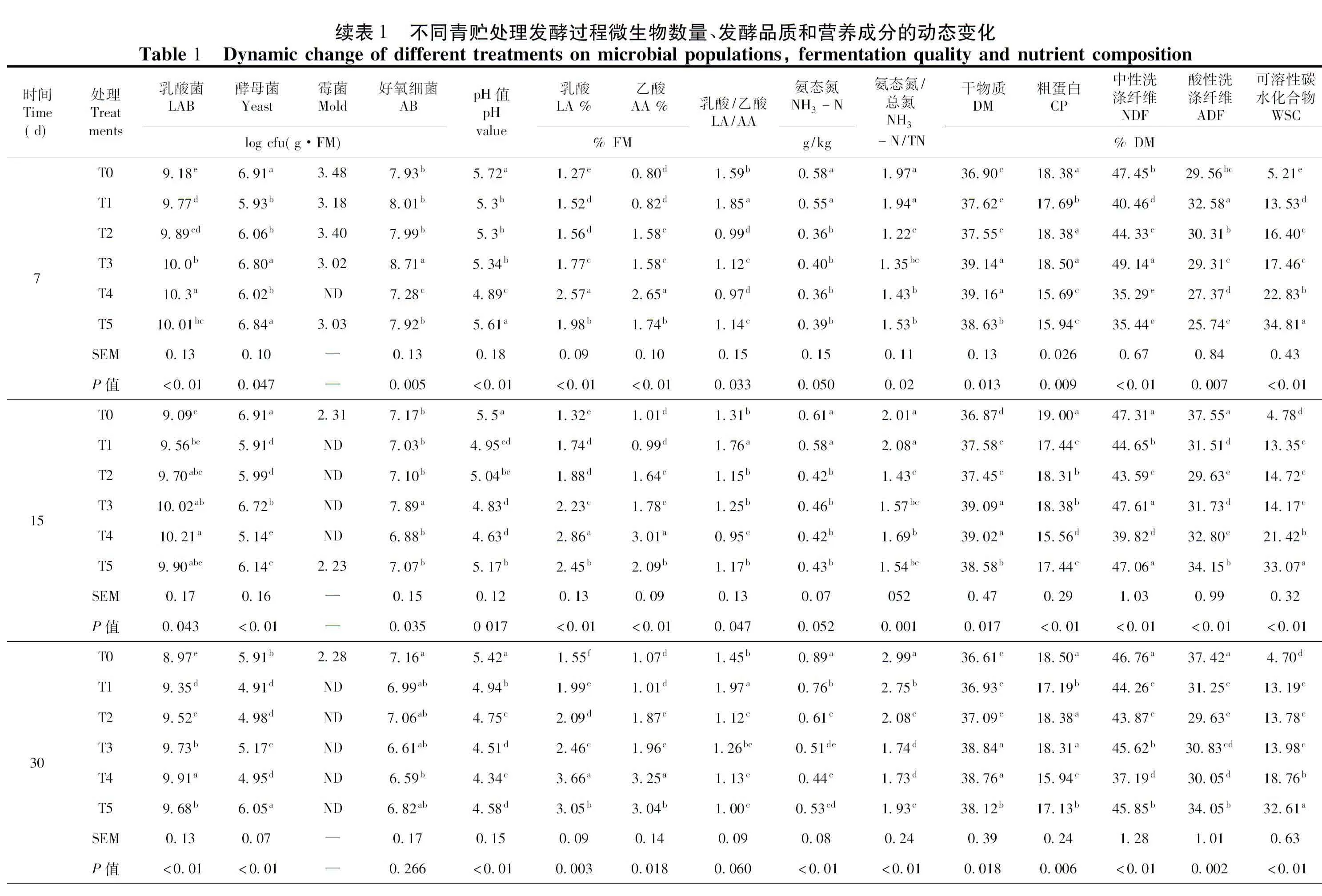
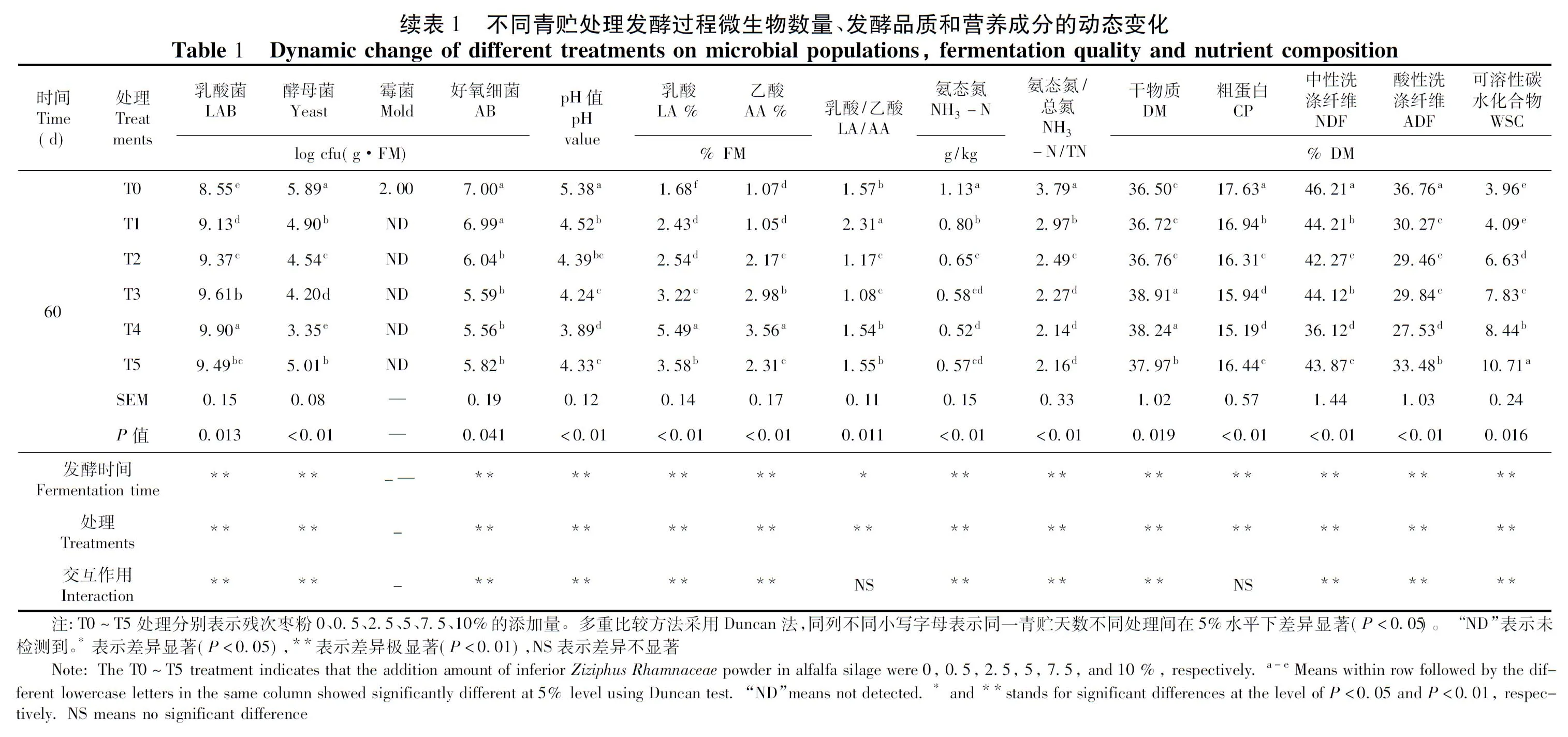
发酵初期,各处理乳酸菌数量逐渐增加,至第7 d各处理均达到最大值,T0处理显著低于其它处理(P<0.05),T4处理显著高于其它处理(P<0.05)。之后,各处理乳酸菌数量缓慢下降,发酵结束时,自高到低排序为T4处理>T3处理>T5处理>T2处理>T1处理>T0处理(P=0.013);各处理的酵母菌数量在发酵过程中呈现下降趋势,且T0处理高于其它处理(P<0.05)。发酵第60 d时,T4处理最低,仅为3.35 log cfu/(g·FM)(P<0.01);各处理霉菌数量在发酵进程中逐步下降,自发酵第7 d开始,T4处理未检测到霉菌数量。发酵至30 d开始,T1~T5处理霉菌数量均消失;发酵初期,T0、T1、T2和T5处理的好氧细菌含量缓慢上升至最大值,T4处理有所下降(P<0.05)。随后各处理的好氧细菌数量随发酵时间的推移,逐渐下降,发酵结束时,自高到底排序为T0和T1处理>T2、T5、T3和T4处理(P=0.041)。
枣粉与苜蓿青贮发酵过程中不同处理的发酵指标变化,发酵的第1~3 d,各处理pH值下降缓慢,第1 d,各处理pH值无差异性变化(P=0.306),发酵至第3 d,T0处理显著高于其它处理(P=0.016)。随着发酵时间的延长,各处理pH值下降迅速,其中T4处理的pH值下降最为明显,显著低于其它处理(P<0.05)。直至发酵第60 d,按高低排序为T0处理>T1处理>T2处理>T5处理>T3处理>T4处理(P<0.01);发酵初期(1~3 d)各处理LA和AA含量有所波动,T4处理和T5处理缓慢增加,发酵进行至第7 d时,各处理LA和AA含量逐渐增加,H4处理显著高于其它处理(P<0.05),而T0处理显著低于其它处理(P<0.05)。同时T1~T5处理随着枣粉添加量的增加,LA和AA含量显著增加。发酵结束时,各处理LA和AA含量均达到最大值,LA按高低排序为T4处理>T5处理>T3处理>T2处理>T1处理>T0处理(P<0.01),AA按高低排序为T4处理>T3处理>T5处理>T2处理>T0处理>T1处理(P<0.01);发酵前期(0~15 d),各处理的LA/AA值波动明显(表1),T1处理显著高于其它处理(P<0.05),之后各处理LA/AA值缓慢增加,发酵结束时,各处理LA/AA比值按大小排序为,T1处理>T0、T4和T5处理>T2和T3处理(P=0.016)。
随着发酵时间的延长,各处理NH3-N变化明显,发酵第1 d,自高到低排序为T4处理>T2处理>T1处理>T0处理>T3处理>T5处理(P=0.005),至发酵第3 d,各处理NH3-N含量均有所下降(P=0.036)。随着发酵时间推移,各处理NH3-N含量均逐渐上升,至青贮发酵结束时,各处理NH3-N含量均达到最大值,自高到低排序为T0处理>T1处理>T2处理>T3处理>T5处理>T4处理(P<0.01);发酵初期(1~3 d),各处理NH3-N/TN值有所波动,之后各处理的NH3-N/TN值逐步增加,并且T0处理显著高于其它处理(P<0.05)。青贮发酵第30 d后,NH3-N/TN值随着残次枣粉添加量的增加而降低,其中,T3和T4处理显著低于其它处理(P<0.05),至发酵结束时,T0处理的NH3-N/TN值最大(P<0.01)。
不同添加量的残次枣粉与苜蓿青贮发酵过程中营养成分动态变化明显,各处理DM含量在发酵初期(1~7 d),有所波动(P<0.05),至发酵第7 d时,按高低排序为T4和T3处理>T5处理>T1处理、T2处理和T0处理(P=0.013)。之后随着发酵时间延长,各处理DM含量均逐渐下降,至发酵60 d,各处理均达到最低值,自高到低排序为T3处理和T4处理>T5处理>T2处理、T1处理和T0处理(P=0.019);各处理CP含量在青贮发酵初期(1~7 d)有所波动,随着发酵时间的增加,各处理的CP含量逐渐下降,T1~T5处理低于T0处理(P<0.05),并且随着枣粉添加量的增加而降低。直至青贮发酵结束,各处理CP含量自高到低为T0处理>T1处理>T5处理和T2处理>T3处理和T4处理(P<0.01);发酵第1 d,各处理的NDF和ADF含量分别为39.50%~49.60%和23.98%~33.65%,随着发酵时间延长,各处理的NDF和ADF含量均有所下降,发酵至15 d以后,T0处理均高于其它处理(P<0.01),发酵结束时,各处理的NDF和ADF含量有显著差异(P<0.05),NDF按优劣排序为T4处理>T2处理>T5处理>T3处理>T1处理>T0处理(P<0.01),ADF按优劣排序为T4处理>T2处理>T3处理>T1处理>T5处理>T0(P<0.01);青贮发酵的第1~3 d,各处理的WSC含量有所波动,达到最大值,差异显著(P<0.01)。之后随着发酵时间的延长,各处理的WSC含量均表出现下降趋势。至发酵结束时,各处理的WSC含量均达到最低值,按高低排序为T5>T4>T3>T2>T1>T0(P=0.016);整个发酵过程中,T1~T5处理的WSC含量显著高于T0处理(P<0.05),并且随着残次枣粉添加量的增加,其WSC含量呈增加趋势。
发酵时间和处理分别对乳酸菌、酵母菌和好氧菌数量以及pH、LA、AA、NH3-N、NH3-N/TN、DM、CP、NDF、ADF、WSC含量影响极显著(P<0.01);发酵时间对LA/AA产生显著影响(P<0.05),处理对LA/AA变化产生极显著影响(P<0.01);发酵时间和处理的双因素交互作用对乳酸菌、酵母菌和好氧菌数量以及pH、LA、AA、NH3-N、NH3-N/TN、DM、NDF、ADF、WSC含量产生极显著的影响(P<0.01),对LA/AA和CP含量变化无显著影响(P>0.05)。表1
3 讨 论
3.1 添加残次枣粉对苜蓿青贮微生物的影响
微生物种类和数量直接影响着青贮饲料的品质[11]。研究中随着发酵进行,各处理的乳酸菌数量增加,至第7 d达到最大值,是由于发酵初期,植物呼吸和好氧微生物活动,青贮袋内氧气被逐渐耗尽,好氧微生物停止活动,形成厌氧状态,乳酸菌逐渐占据绝对优势。而T1~T5处理的乳酸菌数量明显多于T0处理,是由于枣粉WSC含量丰富,为乳酸菌的迅速繁殖提供更多的营养需求。之后,各处理乳酸菌数量缓慢下降,一是因为乳酸菌发酵,乳酸含量不断积累,pH降低至一定范围,反而对乳酸菌造成酸性胁迫,致使乳酸菌数量和活性下降;二是随着发酵时间延长,WSC含量逐渐被消耗,乳酸菌活动强度减弱。
酵母菌在无氧和有氧环境中均可繁殖,是引起青贮饲料好氧变质的原因之一,研究中各处理酵母菌数量逐渐下降,并且随着残次枣粉添加量的增加有所下降,原因是随着发酵时间推移,青贮袋内氧气逐渐减少,厌氧菌种通过糖发酵来获取能量。但各处理酵母菌仍未消失,可能是因为酵母菌耐酸强,在厌氧和耐酸条件下利用底物产生能量无法抑制其生长[12]。霉菌是引起青贮饲料腐败变质的有害微生物,部分霉菌会产生霉菌毒素,降低青贮饲料品质,危害家畜健康[13]。通过研究发现,各处理霉菌数量随着发酵时间延长逐渐下降直至消失,然而T0处理在整个青贮过程中都存在,表明添加残次枣粉为酸性环境和厌氧条件的形成提供充足的底物保障,有效地抑制了霉菌滋生。而好氧菌发酵初期的波动是因为发酵初期利用植物细胞机械压榨后排出含有可溶性碳水化合物的养分,使其有所增加,但随着乳酸菌不断积累,厌氧环境的形成,好氧细菌受到抑制。
3.2 添加残次枣粉对苜蓿青贮发酵品质的影响
青贮发酵的实质是在厌氧环境下,乳酸菌分解糖类,产生乳酸,促使青贮饲料pH显著下降,抑制微生物活动,从而使青贮饲料长期保存。低pH值可防止二次发酵,减少DM损失,提高青贮饲料有氧稳定性[14]。大量研究证实苜蓿半干青贮可提高青贮的成功率,然而基于高水分苜蓿青贮的调制,目前还未得到有效解决。研究中添加了富含发酵底物的骏枣粉进行青贮,随着发酵时间和枣粉添加量的增加而LA含量增加,pH降低,表明枣粉与苜蓿青贮后可促进乳酸菌发酵,产生较多的LA,从而使青贮饲料的发酵品质得到改善,该结果与Adesogan等[15]研究结果相似。但当添加量至10%时,LA含量降低,pH值升高,是由于骏枣粉过多添加提高乳酸菌的竞争性或是刺激同异型发酵乳酸菌活性,导致产酸性能受限。AA是异型发酵的产物,其生成主要包括2个途径,于青贮发酵后期可有效抑制酵母菌和霉菌生长,提高有氧稳定性,防止饲料腐败变质[16]。研究中,随着发酵的进行,pH逐渐降低,AA含量逐渐增多,这说明发酵类型由同型向异型转变,与未添加枣粉处理组相比,添加处理组增加了AA含量,可能是因为异型乳酸菌比同型乳酸菌在酸性和低pH条件下更具有耐受性。NH3-N是青贮发酵过程中饲料蛋白质和氨基酸被降解的结果[17]。NH3-N/TN越高,说明被降解的蛋白氮越多,品质越差,进而影响动物的采食量和饲料利用率[18]。苜蓿因蛋白质含量高,蛋白降解严重,NH3-N对苜蓿青贮发酵品质影响较大。本研究中,苜蓿单独青贮时NH3-N含量较添加枣粉处理组高,同时,NH3-N/TN表现出相同的规律,进一步表明增加枣粉极大的降低了青贮饲料腐败变质的可能性,改善了苜蓿青贮发酵品质,与Schmidt[19]等研究结果相一致。
3.3 添加残次枣粉对苜蓿青贮营养成分的影响
牧草种类、干物质含量、可溶性糖等因素直接影响着青贮品质[20]。制作青贮饲料的牧草须含有适宜的可溶性碳水化合物作为发酵底物(≥10%DM)[13],而紫花苜蓿的WSC含量低,决定了其单独青贮很难成功。在研究中,随着枣粉添加量的增加,青贮发酵体系中WSC含量逐渐增加,这为乳酸菌的发酵提供了丰富的底物,从而快速形成理想的酸性环境,有效地抑制有害微生物活动,减少不良发酵产物形成,这与西兰花茎叶稻秸苜蓿混合青贮中添加蜜糖研究结论相似[21]。随着发酵时间延长,DM含量逐渐下降,由于青贮初期水分含量相对较高,作为营养底物的WSC含量也相对较高,被微生物逐渐利用后,DM含量损伤逐渐增加。随着枣粉添加量的增加,DM含量有所增加,是因为枣粉作为营养添加剂,在增加青贮饲料中WCS含量的同时,也可降低水分含量,从而减少微生物对青贮饲料营养成分的消耗。CP是评价粗饲料品质的重要指标。通过研究发现,随着发酵时间推移,各处理的CP含量逐渐下降,是因为青贮发酵过程中的不良微生物分解氨基酸、嘌呤、嘧啶和氮盐类,产生氨态氮,导致大量的CP降解,这与许庆方等[22]研究苜蓿青贮与青贮前相比,真蛋白含量下降,约占总氮的60~80%的试验结果相似。但是由于枣粉CP含量较低,随着枣粉添加量的增加,青贮饲料的CP含量呈现下降趋势。在青贮制作的实际操作过程中,为了使青贮料的蛋白质和能量得到平衡,要对枣粉的添加量加以适当控制。NDF和ADF含量是反映纤维质量最有效的指标,含量越低,营养品质越好,其中ADF与动物消化率呈负相关,是指示饲草能量的关键。研究中,NDF和ADF含量随着发酵时间推移逐渐下降,是因为青贮初期含有部分纤维素酶的微生物[23],逐渐消耗青贮饲料中营养物质,产生纤维素酶,导致ADF和NDF逐渐下降。同时将枣粉添加至苜蓿中进行青贮与苜蓿单独青贮相比,其NDF和ADF含量显著降低,原因是枣粉所含的WSC含量高,产生的有机酸在青贮期间可水解更易消化的细胞壁部分[24]。
4 结 论
4.1 青贮发酵过程中,残次枣粉添加量为5%时,显著提高苜蓿青贮饲料的DM含量;当添加量增加到7.5%时,进一步显著增加青贮发酵体系中LA和AA含量,降低NH3-N、NDF和ADF含量;当添加量达到10%时,虽然对于DM、NDF和ADF含量以及产酸能力有所变差,但显著提高发酵体系中CP和WSC含量。残次枣粉添加量为5%~10%时显著降低发酵体系中蛋白腐败的程度。
4.2 整个青贮发酵过程中,残次枣粉添加量为7.5%时,均显著增加乳酸菌数量,抑制酵母菌、霉菌和好氧菌数量。
