重庆地区心脑血管疾病氯吡格雷抵抗与CYP2C19基因多态性等影响因素研究*
2019-11-01罗中兰王丽馨
殷 勤,黄 庆,罗中兰,臧 婉,王丽馨
(陆军军医大学大坪医院·野战外科研究所检验科,重庆 400042)
氯吡格雷是继阿司匹林后的心脑血管患者常用抗血小板聚集抑制剂,是一种药物前体,在肝脏生物氧化成2-氧基-氯吡格雷,再水解成具有生物活性的物质[1],起到抑制血小板聚集的作用。除了患者年龄、性别存在差异外,吸烟、糖尿病、高血脂、遗传、炎性因子等都是影响氯吡格雷药效的因素,起决定性作用的是人群中基因型别的多态性[2],遗传因素是所占比重最大的影响因素[3]。CYP2C19基因的研究重点在于抗抑郁药、质子泵抑制剂和心血管类药物(如氯吡格雷)的个体反应差异[4-5]。目前,将服氯吡格雷后用血二磷酸腺苷(ADP)诱导的最大血小板聚集率较基线水平下降≤10%定义为氯吡格雷抵抗(CR)[6]。本研究中探讨了 CYP2C19 基因多态性、超敏急性时相反应蛋白(CRP)、凝血时间(TT)、血糖、性别和年龄等高危因素对氯吡格雷反应性的影响,检测服用氯吡格雷治疗前后的心脑血管疾病患者的血小板聚集率差值,评估是否存在CR。现报道如下。1 资料与方法
1.1 研究对象
纳入标准:重庆地区无血缘关系的汉族;年龄29~90岁;临床诊断心脑血管疾病;服用氯吡格雷片抗凝治疗(赛诺菲杭州制药有限公司,规格为每片75 mg)75 mg/d。
排除标准:抗血小板治疗禁忌证,血小板<100或>45×109/L;氯吡格雷过敏或不耐受;住院前服用氯吡格雷或华法林,或使用过其他Ⅱb/Ⅲa受体拮抗药;严重肝肾功能损害(血转氨酶超过正常值2倍以上,血肌酐>177 mmol/L),严重心力衰竭或左室射血分数<30%;凝血功能障碍,半年内有卒中或出血性疾病,近期有出血史、输血史或肝素诱发血小板减少症;近期拟行外科手术,或介入治疗禁忌证;恶性肿瘤。
收集资料:前瞻性纳入我院神内科2017年6月至2018年8月需服用氯吡格雷常规治疗的心脑血管疾病患者526例,其中男317例,女209例。
1.2 基因型检测
应用血液DNA提取试剂盒(上海百傲生物科技股份有限公司)。样本处理:抽取2 mL静脉血,置EDTA抗凝管中上下颠倒混匀,DNA,CYP2C19基因引物由Primer 3软件生成。扩增条件:50℃,5 min;94 ℃,5 min;94 ℃,25 s;48 ℃,40 s;72 ℃,30 s。共 35 个循环,72 ℃延伸5 min。将扩增产物置1.5%琼脂糖中进行凝胶电泳,应用凝胶成像系统扫描电泳条带,并进行分析。
基因型别包括野生型CYP2C19*1/*1;突变杂合型 CYP2C19*1 /*17,CYP2C19*17 /*17,CYP2C19*2 /*17,CYP2C19*3 /*17,YP2C19*1 /*2,CYP2C19*1 /*3;突变纯合型 CYP2C19*2 /*2,CYP2C19*2 /*3,CYP2C19*3 /*3。根据不同基因型别所编码的酶对氯吡格雷的代谢速率,将CYP2C19*17/*17,CYP2C19*1/*17 归 为 超 快 代 谢 型 ;CYP2C19*1/*1 为快代谢型;CYP2C19*2/*17,CYP2C19*3 /*17,CYP2C19*1 /*2 和 CYP2C19*1 /*3 为中代谢型;CYP2C19*2 /*2,CYP2C19*2 /*3,CYP2C19*3/*3为慢代谢型。
1.3 血小板聚集率测定
分别于服用氯吡格雷前和服用75 mg氯吡格雷24 h后抽取静脉血,分别测定静脉血ADP诱导的最大血小板聚集率(MAP),其中ADP、海伦娜血小板聚集仪均为美国海伦娜实验室Helena Laboratories产品。以100g离心12 min、1 600g离心5 min血浆分别制备富、乏血小板血浆,分别各取225,250 μL,富血小板血浆加入浓度为50 μmol/L ADP试剂,采用比浊法检测血小板聚集抑制率。血小板聚集抑制率=治疗前后血小板聚集率差值/治疗前血小板聚集率×100%。血小板聚集抑制率≤10%称为 CR,>10%称为“氯吡格雷敏感”[7]。
1.4 CRP测定
深圳普门特定蛋白分析仪PA-990,EDTA抗凝服用氯吡格雷24 h后抽取静脉血2 mL,采用超敏急性时相反应蛋白试剂盒(散射比浊法)检测CRP。
1.5 凝血时间测定
TOP-700型全自动血凝仪(Beckman公司),Instumentation Laboratory 试剂 Thrombin Time,3.2% 枸橼酸钠抗凝,服用氯吡格雷24 h后抽取静脉血2.7 mL,2 h内检测。
1.6 空腹血糖(FBG)测定
DXC800型全自动生化仪(Beckman公司),Beckman试剂,服用氯吡格雷24 h后抽取静脉血3 mL,自然凝固析出血清,4 000 r/min离心后2 h内完成检测。
1.7 统计学处理
采用SPSS16.0统计学软件分析。计量资料用表示,两组间比较采用t检验,多组间比较采用方差分析,如有差异再用t检验进行两两比较;计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 CYP2C19基因型和代谢型分布情况
526例患者检测出的基因型包括野生型CYP2C19*1 /*1;突变杂合型 CYP2C19*1/*17,CYP2C19*2 /*17,CYP2C19*3 /*17,YP2C19*1 /*2,CYP2C19*1 /*3;突变纯合型 CYP2C19*2/*2,CYP2C19*2/*3;没有出现突变纯合型CYP2C19*17 /*17,CYP2C19*3 /*3。根据不同基因型别所编码的酶对氯吡格雷的代谢速率分型,超快代谢型占0.95%(n=5),快代谢型占 40.49%(n=213),中代谢型占 43.73% (n=230),慢代谢型占 14.83% (n=78)。男性和女性的CYP2C19基因型及代谢型在分布上差异显著(P<0.05)。详见表 1。
2.2 高危因素CYP2C19基因多态性的影响
根据不同基因型所产生的代谢类型进行分组,对纳入研究的526例患者行血糖、CRP、TT、性别和年龄等方面比较,高危因素与其代谢类型在发生性别上有一定差异,但无统计学意义(P>0.05)。

表1 CYP2C19基因分布情况(n=526)
2.3 CYP2C19基因型代谢型与CR发生率的关系
526 例患者中,发生 CR 73 例(13.88%),超快、快、中、慢代谢型4组患者中发生CR的例数分别为0例、26 例(12.21% )、33 例(14.35% )、14 例(17.95% ),其分布的差异有统计学意义(P<0.05)。与超快代谢组、快代谢组相比,中代谢组和慢代谢组CR发生率更高,差异有统计学意义(P<0.05)。另外,相比中代谢组,慢代谢组CR发生率更高,差异有统计学意义(P<0.05)。
2.4 不同代谢型患者服药前后血小板聚集率的变化
应用氯吡格雷治疗前,4组用50 μmol/L ADP诱导的不同代谢型患者血小板聚集率基础值差异无统计学意义(P>0.05)。服用75 mg负荷量氯吡格雷24 h后,4组患者血小板聚集率较服药前降低幅度差异均有统计学意义(P<0.05)。超快代谢组、快代谢组、中代谢组分别与慢代谢组比较,差异有统计学意义(P<0.05)。超快代谢组、快代谢组、中代谢组组间两两比较差异均无统计学意义(P>0.05)。详见表 2。
表2 各组患者应用氯吡格雷治疗前后血小板聚集率变化比较(±s,% )
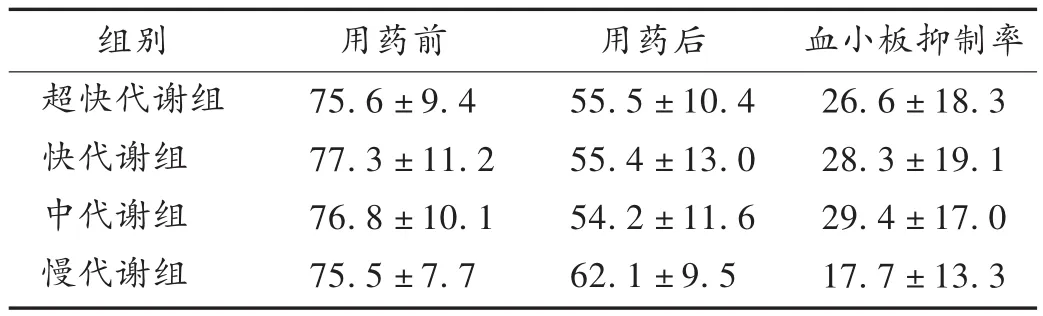
表2 各组患者应用氯吡格雷治疗前后血小板聚集率变化比较(±s,% )
组别超快代谢组快代谢组中代谢组慢代谢组用药前75.6 ±9.4 77.3 ±11.2 76.8 ±10.1 75.5 ±7.7用药后55.5 ±10.4 55.4 ±13.0 54.2 ±11.6 62.1 ±9.5血小板抑制率26.6±18.3 28.3±19.1 29.4±17.0 17.7±13.3
3 讨论
本研究中CR发生率为13.88%,与文献[5]报道的发生率4%~31%一致。氯吡格雷的抗血小板聚集作用受多种因素的影响,包括遗传、药物、剂量、炎性因子等,其中遗传因素占比最高[8],且遗传在CR中的作用逐渐被重视[9-10]。具有遗传多态性的CYP2C19酶的SNP位点的差异体现在种族和地区的分布[11],且个体间酶的活性也存在显著不同,正是这种差异性,可能会导致某些药物(如氯吡格雷)在机体的代谢能力存在民族、地区差异[12]。将氯吡格雷治疗后血小板聚集率≥60% 定义为残余血小板高反应性(HTR)[13]。HTR 必然增加心血管疾病的发生风险[2]。
我国汉族人群的CYP2C19基因呈多态性,CYP2C19基因突变的类型主要为CYP2C19*2和CYP2C19*3位点,且我国人群发生CYP2C19*2位点突变的比例较*3位点高[14]。这一结论与亚洲其他地区人群的基因多态性一致[15]。引起氯吡格雷的酶活性降低的也是CYP2C19*2或*3位点突变,与遗传相关,亚洲人99%以上是CYP2C19*2或*3突变。CYP2C19基因的主要突变体是CYP2C19*2,在氯吡格雷抗血小板聚集作用机制起决定因素[16]。我国患者的CYP2C19*2突变多态性与血小板聚集率密切相关[17],这就是与CR密切相关的根本原因。*2突变是CR的危险且独立因素[18]。携带CYP2C19*2基因突变位的个体具有更高的血小板活性,对氯吡格雷的代谢活性较野生型显著降低[6],使其最大血小板聚集率下降较少,导致CR风险增高。与CYP2C19*2基因不同,携带*3基因是发生CR的预测因素[3]。CYP2C19*3位点突变仅有杂交型[19],与研究结果中未出现 CYP2C19*3 /*3基因型的结论一致。本研究中,CYP2C19(*2及*3位点)基因的纯合突变率为14.83%,与文献[20]报道接近。CYP2C19*17等位基因的突变,是氯吡格雷在体内的活性遗传调控因子[21],CYP2C19*17基因与*2和*3基因的作用相反,携带*17基因的个体服用氯吡格雷后,能提高对血小板聚集的抑制率[22],从而不易发生CR[23],同时必然增加了出血风险[24]。携带 CYP2C19*17基因的患者被划为氯吡格雷代谢的超快代谢组,显著抑制血小板聚集活性[25]。
本研究结果显示,基因型为CYP2C19*1/*1的野生型比例为40.49%,与国内汉族人群CYP2C19基因多态性研究中,野生型比例为 42.4% (120 /283)[26]的结果非常一致。本研究结果还显示,男女性基因型比较,差异无显著性,说明性别在重庆地区CYP2C19基因多态方面无明显影响。
本研究中还试图分析多种心血管病的高危因素(如炎性因素C反应蛋白、高血糖、凝血时间、性别、年龄等)以找出与CR的相关性,但结果显示,高危因素与其代谢类型在性别上有一定差异,可能与纳入人群数量在性别方面的分布有关系,但未发现与CR的发生有显著关联性。
