前列地尔对早期2型糖尿病合并高血压患者血管内皮功能及氧化物质的影响
2019-11-01赵跃萍袁菲阳孙萌萌
赵跃萍,孙 喆,刘 静,袁菲阳,孙萌萌,苏 宏,宋 涛
随着生活方式的改变、生活节奏的加快、饮食谱的改变,我国成为了2型糖尿病(type 2 diabetes mellitus,T2DM)与高血压的高发国家,其并发症为糖尿病肾病(diabetic nephropathy,DN)与糖尿病视网膜病变(diabetic retinopathy,DR)[1]。糖尿病与高血压常伴行存在,均能导致血管内皮的损伤,两种疾病共同导致血管弹性降低及纤维化的发生[2]。AngⅡ受体阻滞药缬沙坦在降低血压的同时具有保护肾脏(高血压与T2DM共同靶器官)的作用[3],而前列地尔具有改善细胞膜功能、改善微循环、抑制血小板聚集、抗氧化等功效[4],因此,本研究选择缬沙坦和前列地尔治疗T2DM合并高血压病,旨在探讨缬沙坦联合前列地尔治疗早期T2DM合并高血压患者对血管内皮功能及氧化物质的影响。
1 对象与方法
1.1 对象 选择2017-05至2018-09我院收治的100例(最终86例符合研究标准)T2DM合并高血压患者,随机分为对照组和观察组,两组患者的基线资料比较,差异无统计学意义(P>0.05),见表 1。诊断标准:依照2011年美国T2DM及其相关并发张的诊疗方案[5]与2005年高血压治疗指南[6]。纳入标准:(1)较好的依从性与生活规律;(2)年龄<70岁的汉族人;(3)体重指数(body mass index,BMI)<25 kg/m2;(4)T2DM或高血压病程均<15年,且均能得到很好的控制,无相关靶器官损伤(DN与DR)。排除标准:(1)口服药物仍不能很好地控制血糖(需胰岛素)、血压(静脉药物),且出现相关并发症;(2)重要脏器出现功能障碍;(3)不耐受治疗药物(过敏反应)。
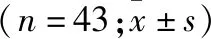
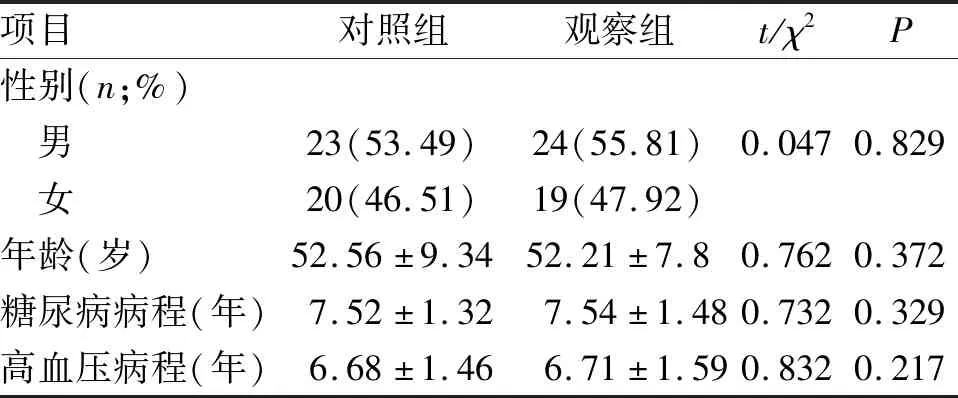
项目对照组观察组t/χ2P性别(n;%) 男23(53.49)24(55.81)0.0470.829 女20(46.51)19(47.92)年龄(岁)52.56±9.3452.21±7.80.7620.372糖尿病病程(年)7.52±1.327.54±1.480.7320.329高血压病程(年)6.68±1.466.71±1.590.8320.217
1.2 治疗方案 对照组给予二甲双胍(3次/d,每次1片,于三餐餐中空腹服用,美国百时美施贵宝公司产品,500 mg/片,商品名:格华止)+阿卡波糖(3次/d,每次1片,于餐中嚼服,由德国拜尔制药有限公司提供,50 mg/片,商品名:拜糖平)控制血糖,控制血压给予代文胶囊(1粒/d,晨起空腹口服,由北京诺华制药有限公司提供,规格 80 mg/粒,商品名:代文),改善循环给予银杏叶提取物(每次1片,3次/d,分别在三餐后口服,台湾济生化学制药厂股份有限公司生产、商品名:金纳多;规格:40 mg/片)。
观察组在此基础上加用前列地尔注射液10 μg(北京泰德制药股份有限公司提供,10 μg/支),加入0.9%氯化钠注射液10 ml中静脉注射,1次/d,两组连续治疗60 d。最后完成临床研究的共86例,对照组43例、观察组43例。所有患者糖尿病、低盐低脂饮食。治疗期间保持定期电话随访(1周1次)与门诊复查(2周1次),记录不良反应(我科室护士进行)。由本科室护理人员告知患者本人及其家属正确的血压仪及血糖仪使用方法,及其出现一过性高血压与低血糖的处理方法,做好胰岛素注射部位的皮肤护理工作,防治感染及皮下硬化,护理人员给予患者进行心理疏导以缓解患者的紧张情绪(我科室护士经过专业的心理护理相关培训)。征得医院医学伦理委员会批准进行,所有参与人员(医师、护士、患者本人及其家属)均充分了解本次临床研究,并在知情同意书上签字。
1.3 观察指标与测量方法
1.3.1 血液样品采集与血糖检测(免疫酶法) 抽取空腹静脉血(晨起6时进行,要求禁食水8 h)检测空腹血糖(fasting plasma glucose,FBG),采用口服葡萄糖耐量实验(oral glucose tolerance test ,OGTT)测定餐后2 h血糖(2-hour postprandial blood glucose,2 h PBG)。
1.3.2 血管舒缩张因子检测 一氧化氮(nitrogen oxide,NO)、内皮素-1(endothelin-1,ET-1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)的检测采用酶联免疫法(enzyme linked immunosorbent assay,ELISA)检测,具体方案严格按照试剂盒(武汉新启迪生物公司提供)说明进行。
1.3.3 FMD、NMD测定 采取荷兰飞利浦公司生产的IU22型彩色超声诊断仪(探头6-1MHz)对肱动脉内皮依赖性血管舒张功能(FMD)与硝酸甘油所介导的非内皮依赖性血管舒张功能(nitroglycerin mediated dilation,NMD)进行检测。FMD检测:患者仰卧位,检验者站立于患者的右侧位,患者右上肢外展(约15°),探头在肘窝上方2 cm进行检测,采用纵切位进行。首先检测出肱动脉的基础内径(心脏舒张末期进行测量),基础肱动脉内径(D0)检测后进行肱动脉最大内径(D1)的检测,检测方案:将血压计袖袋放在肱动脉远端,快速加压到250 mmHg,并在该压力下维持5 min,快速放气降压,放气后2 min测量肱动脉最大内径,静止休息15 min,当肱动脉直径恢复到正常时给予硝酸甘油0.5 mg舌下含服,5 min后再次测定其肱动脉直径,算D2,NMD(%)=(D2-D0)/D0×100%。注:测量时探头不能变换位置,必须始终保持一个位置[7,8],超声医师由我院超声科对本研究完全不了解的医师进行测量,每次测量3次,取平均值。
1.3.4 谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性、超氧化物歧化酶(superioxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、活性氧类物质(reactive oxygen species,ROS)检测方法 将抽取的空腹静脉血提取5 ml,注入玻璃试管中,静置10 min后离心(3000 r/min)10 min,分离上清液后置于-70 ℃保存。按照试剂盒说明测定上清液中的氧化相关指标,所有样品在1周内检测完毕(南京建成公司提供)。
1.3.5 降压疗效评价标准 显效,DBP下降≥10 mmHg(降低至正常水平)或SBP下降≥20 mmHg;有效,DBP下降<10 mmHg,但是已经达到正常水平,或SBP下降10~19 mmHg;无效,没有达到以上降压效果,糖尿病患者的血压控制达标标准为<130/80 mmHg[9]。
1.3.6 不良反应观察 治疗期间患者本人及其家属进行记录,二甲双胍、阿卡波糖均有出现胃肠道反应(恶心、呕吐、腹泻、腹胀)的可能,银杏叶提取物、前列地尔皮肤不良反应(皮疹、瘙痒),出现低血糖症状(二甲双胍、阿卡波糖)需自行检测指尖血糖<3.9 mmol/l均需要记录,出现低血压与干咳(由缬沙坦导致)症状需由患者家属测量血压并记录。
2 结 果
2.1 一般情况 对照组和观察组均完成43例(86.00%)。对照组中有3例依从性较差,退出研究,4例失访。观察组中有4例依从性较差,3例失访。
2.2 FBG、2 h PB、BMI、血压(SBP、DBP) 治疗前两组患者FBG、2 h PB、BMI、血压(SBP、DBP)差异均无统计学意义。治疗后两组FBG、2 h PB、SBP、DBP均较治疗前有所降低,差异有统计学意义(P<0.05),但两组间比较差异无统计学意义(表2)。
2.3 血管舒缩张因子及FMD、NMD 治疗后两组患者的NO、VEGF、FMD、NMD均高于治疗前,且观察组高于对照组,差异均有统计学意义(P<0.05);治疗后两组患者的ET-1均低于治疗前,且观察组低于对照组,差异均有统计学意义(P<0.05,表3)。
2.4 氧化相关物质 治疗后两组患者的SOD、GSH-Px均高于治疗前,且观察组高于对照组,差异均有统计学意义(P<0.05);治疗后两组患者的MDA、ROS均低于治疗前,且观察组低于对照组,差异均有统计学意义(P<0.05,表4)。
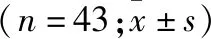
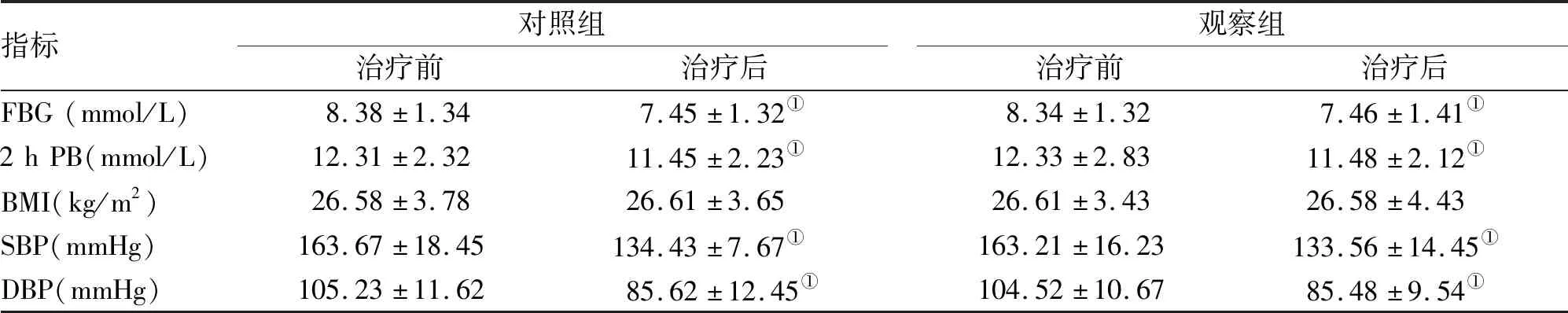
指标对照组治疗前治疗后观察组治疗前治疗后FBG(mmol/L)8.38±1.347.45±1.32①8.34±1.327.46±1.41①2hPB(mmol/L)12.31±2.3211.45±2.23①12.33±2.8311.48±2.12①BMI(kg/m2)26.58±3.7826.61±3.6526.61±3.4326.58±4.43SBP(mmHg)163.67±18.45134.43±7.67①163.21±16.23133.56±14.45①DBP(mmHg)105.23±11.6285.62±12.45①104.52±10.6785.48±9.54①
注:与治疗前比较,①P<0.05
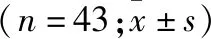

指标对照组治疗前治疗后观察组治疗前治疗后NO(μmol/L)23.23±3.6526.54±3.52①23.28±3.7228.62±4.21①②ET-1(ng/L)95.45±12.7891.13±10.27①95.32±13.4387.27±12.32①②VEGF(pg/ml)24.34±3.4528.48±4.21①24.46±3.3230.37±5.67①②FMD(%)3.67±0.524.13±0.83①3.65±0.564.58±0.92①②NMD(%)14.57±2.1315.58±3.23①14.54±1.8516.47±2.18①②
注:与治疗前比较,①P<0.05;与对照组比较,②P<0.05
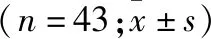
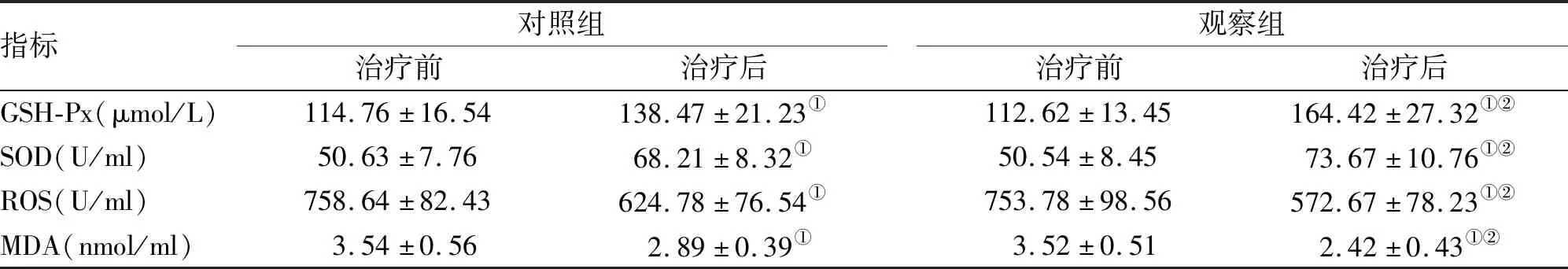
指标对照组治疗前治疗后观察组治疗前治疗后GSH-Px(μmol/L)114.76±16.54138.47±21.23①112.62±13.45164.42±27.32①②SOD(U/ml)50.63±7.7668.21±8.32①50.54±8.4573.67±10.76①②ROS(U/ml)758.64±82.43624.78±76.54①753.78±98.56572.67±78.23①②MDA(nmol/ml)3.54±0.562.89±0.39①3.52±0.512.42±0.43①②
注:与治疗前比较,①P<0.05;与对照组比较,②P<0.05
2.5 降压效果 治疗后观察组的临床疗效优于对照组,差异有统计学意义(P<0.05,表5)。
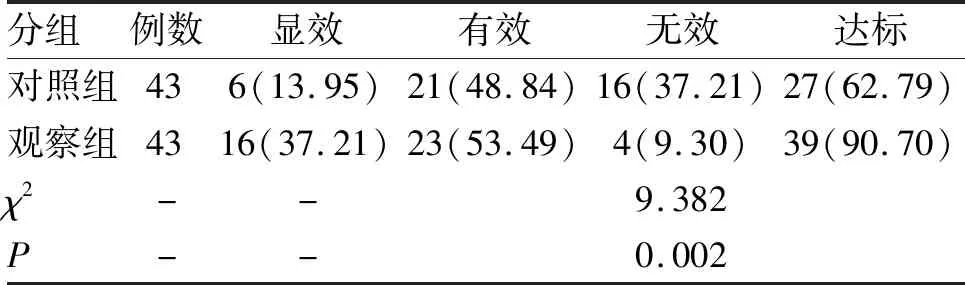
表5 两组2型糖尿病合并高血压患者治疗后降压疗效比较 (n;%)
2.6 不良反应 两组患者治疗过程中均未发生严重不良反应。胃肠道、皮肤不良反应及其干咳发生率两组比较差异均无统计学意义,且不需特殊处理均能缓解,低血糖、低血压发生率比较差异均无统计学意义(P>0.05),低血糖发生时立即口服糖块可以缓解,低血压发生后未行特殊处理均能缓解(表6)。
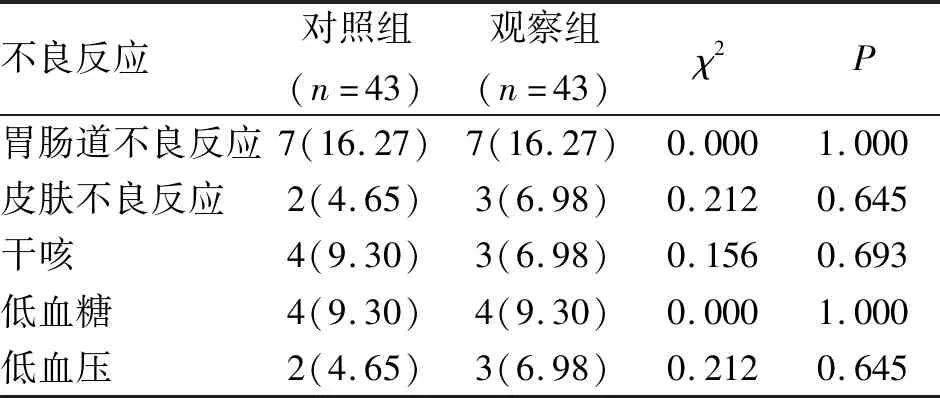
表6 两组2型糖尿病合并高血压患者不良反应对比 (n;%)
3 讨 论
糖尿病与高血压均为心血管疾病的独立危险因素,糖尿病患者中有28.4%~48.1%的合并高血压,且该类患者的病死率高于单纯的糖尿病与单纯的高血压患者,因此我们要积极预防与延缓心脑血管疾病的发生发展[10]。糖尿病早期(未发生微血管病变阶段)就该重视对血管功能的保护,通过监测血管内皮的功能来进一步了解血管病变的情况非常重要。
血管内皮细胞可以看成是一种分泌及其旺盛的细胞,分泌的各种物质来维持血管的舒缩平衡,高血糖、高血压均能导致这些物质失衡,而发生舒缩功能异常(收缩血管为主)[11]。其中NO是主要舒血管物质,是通过内皮一氧化氮合成酶催化产生的,生成的NO可以刺激血管内皮的环磷酸鸟苷的形成,这一物质最终导致血管舒张,使平滑肌松弛,对血管有一定的保护作用,同时还对相应的血供器官起到很好的血供调节作用[12]。ET-1是一种强力的缩血管物质,能引起平滑肌的强烈舒缩,而引起相应器官的缺血缺氧,进而导致血管内皮损伤[13]。VEGF能促进血管内皮的修复与新生血管的形成,此外还可以促进一氧化氮合成酶的生成,与NO共同作用发挥舒张血管的作用[13]。以上两种物质的浓度变化决定血管的舒缩状态,因此通过检测两种物质的浓度可以进一步明确血管内皮的功能。此外近年来出现的多普勒超声技术来测定FMD与NMD是一种无创检验手段,为评价动脉血管内皮功能提供了很好的依据[7,8]。因此本临床研究选取了以上5种指标来评价血管内皮功能。
缬沙坦是一种Ang Ⅱ受体阻滞药,能高选择性地抑制Ang Ⅱ,进而保护血管内皮,同时具有一定的降压和保护肾脏的功效,能很好地控制血管收缩,降低血压,抑制血管内皮细胞发生纤维化,同时有一定的调节氧化物质的功效[14]。T2DM患者均伴有不同程度的氧化与抗氧化失衡,体内大量氧化物质不能得到迅速的清除,因此加重其重要器官及其血管的损伤,且糖尿病患者自身免疫能力及其防御能力降低,这些均造成了损伤的加重,而伏杭江等[15]研究证实,前列地尔能很好地调节糖尿病患者的氧化与抗氧化失衡状态,在糖尿病肾病的治疗中受到广泛认可。但是与缬沙坦胶囊联合应用来治疗T2DM合并高血压既往还未有报道。
本研究结果显示:治疗前两组患者FBG、2 h PB、BMI、血压(SBP、DBP)差异均无统计学意义。治疗后两组FBG、2 h PB、SBP、DBP均较治疗前有所降低(P<0.05),但两组间差异无统计学意义;治疗后两组患者的NO、VEGF、FMD、NMD均高于治疗前,且观察组高于对照组,差异均有统计学意义(P<0.05);治疗后两组患者的ET-1均低于治疗前,且观察组低于对照组,差异均有统计学意义(P<0.05);治疗后观察组的临床疗效优于对照组,差异有统计学意义(P<0.05);两组患者治疗过程中均未发生严重不良反应。以上结果说明,联合治疗可以很好地改善血管内皮功能、提高降压效果、调节氧化与抗氧化失衡状态、提高临床疗效,且治疗方案安全有效。
综上所述,在早期未发生微血管病变的T2DM合并高血压患者在降糖、降压的治疗基础上加用前列地尔能很好地改善血管内皮功能,改善氧化与抗氧化失衡状态,提高临床疗效,安全可靠。
