免疫检查点抑制剂相关消化系统不良反应的临床诊治建议
2019-10-29李玥王汉萍郭潇潇周佳鑫段炼斯晓燕张丽刘小伟钱家鸣张力
李玥 王汉萍 郭潇潇 周佳鑫 段炼 斯晓燕 张丽 刘小伟 钱家鸣 张力
1 免疫检查点抑制剂(immuno-checkpoint inhibitors,ICIs)的肝脏不良反应
1.1 发生率 免疫相关肝毒性的发生率单药治疗(ipilimumab, nivolumab, pembrolizumab)约5%-10%,其中3级约1%-2%。联合治疗(如ipilimumab联合nivolumab)的发生率为25%-30%,其中3级约15%[1,3]。单药治疗(nivolumab)3级-4级肝毒性的发生时间是14.1周(1.9周-25.1周),联合治疗(如ipilimumab联合nivolumab)3级-4级肝毒性的发生时间提前,平均为7.4周(2.1周-48周),并且持续时间延长[3]。
1.2 诊断 irAEs肝毒性的发生通常隐匿,可不伴随明显的临床表现,用药后定期监测肝功能有助于早期发现。一旦出现肝功能异常,或较用药前水平上升,需尽早完善包括血生化、肝炎病毒检测、肝脏影像检查,必要时肝活检等一系列检查。通常在肿瘤患者药物治疗前,需完善慢性肝病病史的询问,如饮酒史、长期用药史、慢性肝炎病史、自身免疫性肝病病史等。用药前应筛查自身免疫性肝病相关抗体、病毒性肝炎如乙型、丙型肝炎病毒等。当治疗后出现肝功能异常,需重复上述肝炎病毒血清学检查,以及甲肝、戊肝血清学检查,必要时检测病毒载量(如HBVDNA、HCV-RNA)。还需常规完善机会性感染病原体,包括巨细胞病毒(Cytomegalovirus, CMV)、人类疱疹病毒第四型(Epstein-Barr virus, EBV)的相关检查。除上述病毒性肝炎、感染、酒精、其他合并药物等因素后,还需考虑肿瘤本身肝脏受累,治疗前的肝脏影像学评估对判断病因有一定帮助。以胆汁淤积(即胆红素升高,以直接胆红素为主,伴随GGT、ALP升高)为主要表现的患者,还需要行腹部影像学(如超声、MRCP)等除外胆道结石、肿瘤等梗阻性因素。
上述病因的鉴别应尽可能及早完善,强调用药治疗前的全面评估,以保证治疗过程中以最短的时间明确诊断,以免延误治疗时机。
对于不良反应严重程度分级为4级(表1)的患者,需考虑行肝活检,以判断预后。肝穿刺活检病理最常见的表现是小叶性肝炎,与自身免疫性肝炎无法鉴别。大多数病例为广泛小叶病变,如有窦组织细胞增生和中央静脉内皮炎的表现有助于ipilimumab相关炎症的诊断。罕见病例表现为门静脉炎症和胆管炎[4]。
1.3 处理 肝毒性的处理原则见表1,按照肝功能ALT/AST的升高水平和是否存在胆红素/INR/白蛋白的异常进行分级。通常G1无需停药;G2根据肝功能好转情况,可考虑择期恢复ICIs治疗;G3/G4需考虑永久性停药。激素是治疗肝毒性的主要药物。如分级为G3/G4,激素治疗有效,肝功能降至G2水平,可由静脉甲强龙转换为口服泼尼松龙,之后约4周逐渐减停。如G2,口服泼尼松龙治疗有效,可在2周内减停。在激素治疗的过程中,肝功能仍进行性加重,需考虑升级强化治疗。如:口服泼尼松龙转换为静脉甲强龙,静脉激素治疗2 d-3 d无效,加用口服麦考酚酸脂(mycophenolic acid, MMF)500 mg-1,000 mgbid;如MMF无效,可考虑加用他克莫司。也有采用抗胸腺细胞球蛋白(anti-thymocyte globulin, ATG)治疗MMF无效的爆发性肝炎的病例报道。ICIs相关肝毒性通常在4-6周恢复,对于持续不缓解的患者,需警惕其他因素导致的肝功能异常,再次排查其他病因,特别需要警惕其他药物、机会性感染(如CMV)等病因。
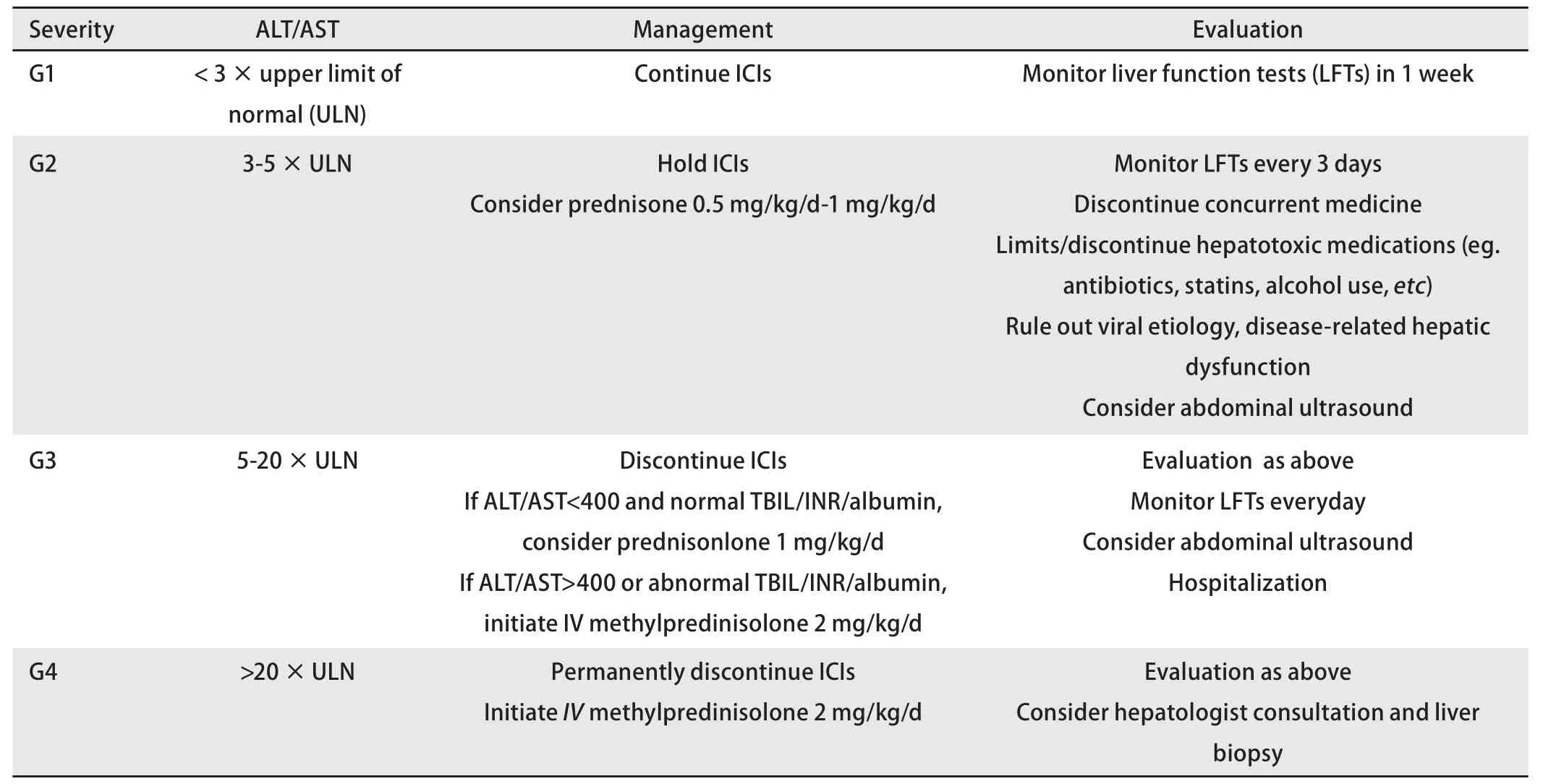
表 1 irAEs肝毒性的评估和处理Tab 1 Evaluation and management of liver toxicity of irAEs
2 ICIs的消化道不良反应
2.1 发生率 消化道是irAEs最常见的受累部位。不同作用靶点的消化道irAEs发生率不同,CTLA-4单克隆抗体消化道不良反应发生率高于PD-1单克隆抗体[6]。比较PD-1抗体治疗黑色素瘤、非小细胞肺癌、肾细胞癌的irAEs发生率,显示黑色素瘤患者的消化道不良反应发生率更高,肺炎的发生率较低。提示同一药物在不同的免疫微环境中可能驱动组织学特异性的irAEs模式[6]。
CTLA-4单克隆抗体治疗肿瘤患者腹泻的发生率为27%-54%。腹泻的发生率约占1/3,结肠炎的发生率为8%-22%[7]。消化道不良反应是CTLA-4单克隆抗体治疗最常见的irAEs,也是最重且最早出现的,常导致药物停用。有研究报道,1%-1.5%黑色素瘤接受ipilimumab治疗的患者发生结肠穿孔,肾细胞癌患者发生穿孔的比例高达6.6%[8]。PD-1单克隆抗体发生3级/4级消化道irAEs的比例为1%-2%[1]。
CTLA-4抗体消化道irAEs可出现在第1-10次用药的任何时间,甚至可在末次用药后数月出现[8]。消化道irAEs发生中位时间是7.4周(1.0周-48.9周)[3]。CTLA-4抗体与PD-1抗体联合应用消化道irAEs的发生率更高,程度更重,且发生时间更早[1]。
消化道irAEs的高危因素包括服用NSAIDs药物,有炎症性肠病病史等[9,10]。
2.2 诊断 消化道irAEs最常见的表现是腹泻,其他包括腹痛、便血、恶心、呕吐、体重下降、发热等。可同时伴随多种肠道外受累表现,如关节痛、内分泌异常、皮肤损害、肝炎、肾炎、心包炎、胰腺炎等irAEs。实验室检查可出现C反应蛋白升高、贫血、低白蛋白血症,少部分患者可出现自身免疫性抗体如抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibody, ANCA)等阳性[9]。内镜下表现多为左半结肠受累,黏膜充血、血管纹理消失、糜烂和溃疡,病变可弥漫分布,也可呈不连续性分布。组织学特点常表现为急性损伤(如中性粒细胞、嗜酸性粒细胞浸润),局灶或弥漫,可有隐窝脓肿。一部分患者可呈现组织学上慢性炎症如隐窝结构紊乱(分支、萎缩、出芽、扭曲等)、基底部浆细胞增多甚至肉芽肿表现[9]。消化道irAEs和消化道一类慢性非特异性疾病即炎症性肠病(inflammatory bowel disease,IBD)的临床表现、内镜表现、甚至病理特点均有相似、重叠之处,表2总结了消化道irAEs的临床、内镜、病理和发病机制等特点,以及与IBD的可鉴别之处[11]。消化道irAEs的诊断有赖于出现上述临床症状与ICIs

表 2 消化道irAEs的临床、内镜、病理特点总结Tab 2 Summary of clinical, endoscopic and pathological features of gastrointestinal irAEs
用药的时间关系,具有上述实验室检查、内镜、组织病理学特点。同时,需除外其他病因,包括:感染性肠炎,如艰难梭菌感染、CMV结肠炎等机会性感染;缺血性结肠炎;其他药物导致的结肠炎,如非甾体抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)等;放射性肠炎等。因此,建议完善粪便病原学检查(便常规、便培养、便艰难梭菌毒素检测、粪便寄生虫检测等)、血CMV-DNA等病毒相关病原学检测;同时建议完善腹盆部增强CT;经消化科医生会诊后完善消化内镜并内镜下组织活检。
2.3 处理 消化道irAEs的处理原则是尽早识别、及时足量治疗、快速升级、改善预后。根据腹泻的次数进行严重程度分级,给予分层治疗。表3详细列举不同严重程度消化道irAEs的处理方案。糖皮质激素是中重度消化道irAEs的主要治疗,如中度患者治疗有效,激素可在2周-4周减停;重度患者可在4周-8周减停。如激素治疗效果不佳,需及时调整激素剂量/剂型,必要时快速升级至英夫利昔单抗(infliximab,IFX)或维多株单抗。研究显示,与长期激素治疗比较,短期激素联合IFX治疗消化道irAEs合并各种感染的风险降低[12]。对于激素、IFX、维多株单抗均无效的难治性消化道irAEs,有病例报道显示肠道菌群移植治疗有效[13]。
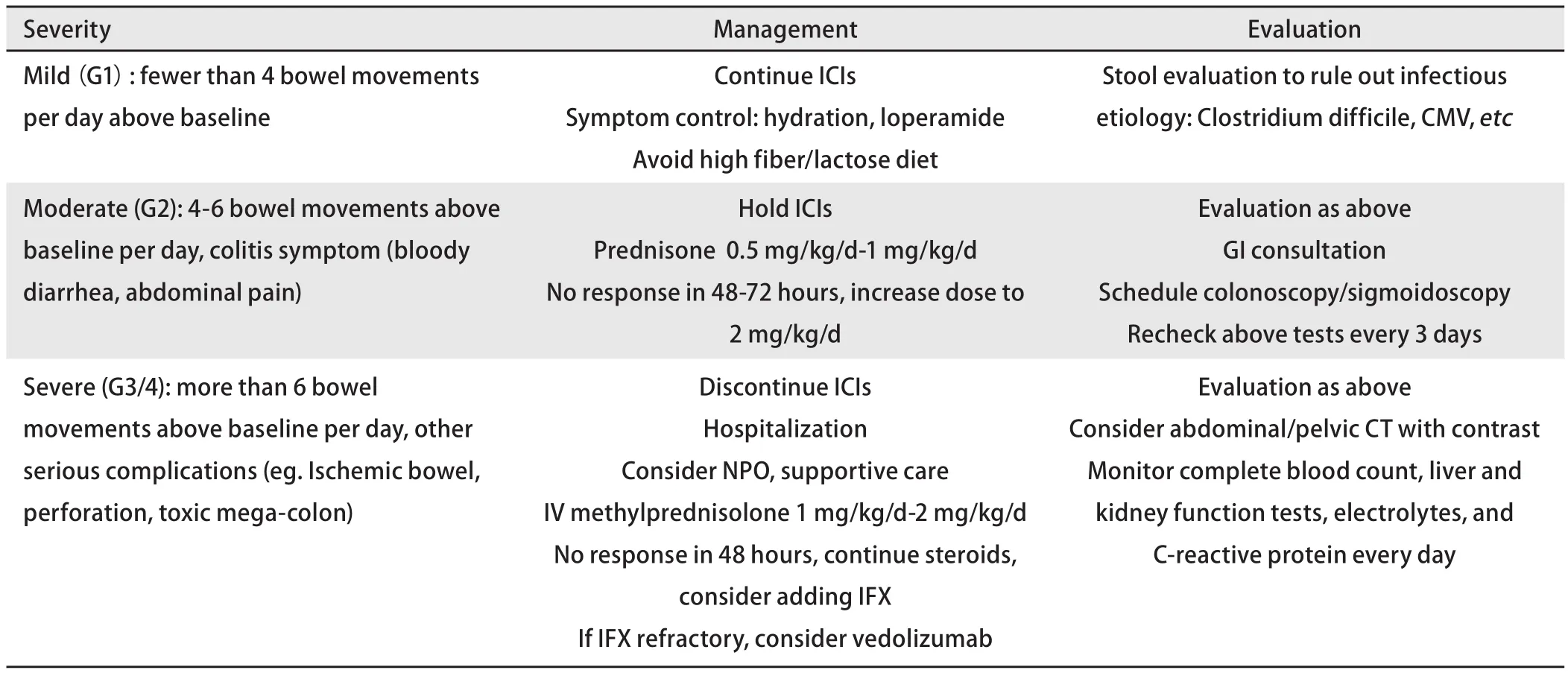
表 3 消化道irAEs的评估和处理Tab 3 Evaluation and management of gastrointestinal irAEs
3 肠道菌群与消化道irAEs及肿瘤预后
目前尚未发现可预测消化道irAEs的生物标志物。最新的研究探索,ICIs治疗前基线的粪便微生物群组成可预测ipilimumab诱导的结肠炎。研究显示,基线时富含梭菌属和其他厚壁菌门的肠道微生物群与ipilimumab的治疗效果好相关,同时免疫相关结肠炎发生率高[14]。2018年初发表于Science上的多项研究提示治疗前特定的粪便微生物群组成与肿瘤对于ICIs的治疗反应相关[15,16]。这将为进一步提高ICIs治疗肿瘤的疗效、改善预后带来前景。
4 总结
伴随ICIs在肿瘤治疗中的广泛应用,irAEs也越来越被肿瘤科医生以及所涉及的各个专科医生所重视。消化系统以消化道受累(腹泻/结肠炎)最为突出,其次是肝脏受累。irAEs的基线筛查、早期识别、及时诊断和快速足量的治疗是解决该类临床问题的关键。肠道微生物群组成是否能预测消化道irAEs以及预测ICIs治疗肿瘤的预后值得进一步的研究探索。
