针对结核分枝杆菌潜伏感染的DNA疫苗V569免疫原性及保护性的初步研究
2019-10-29粟海波刘梓健周洋洋彭宝洲龚青
粟海波,刘梓健,周洋洋,彭宝洲,龚青
广州医科大学,广州医科大学-中国科学院广州生物医药与健康研究院联合生命科学学院,广州 511436
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacteriumtuberculosis, Mtb)感染引起的传染性疾病。据世界卫生组织统计,全球约25%的人为结核分枝杆菌潜伏感染(latent TB infection, LTBI)者,其中5%~10%可能会发展为活动性TB[1]。每年因Mtb感染而死亡的人数达100万人以上,LTBI 者成为TB患者的主要来源[2]。因此,及早发现和治疗LTBI 者是控制TB传播的有效手段。目前,广泛使用的TB疫苗——卡介苗(BacillusCalmette-Guérin, BCG),仅能对抗儿童的原发性感染,却无法阻止成年人潜伏期Mtb的复发感染[3]。国内外进入临床研究的疫苗多数用于预防Mtb早期感染,对LTBI的预防效果不佳。因此,选择Mtb早、晚期不同感染阶段相关抗原研制新一代TB疫苗的策略将是可行的。Lin 等将Mtb早期分泌抗原Ag85B、SAT-6与潜伏感染相关抗Rv2660c蛋白相结合,开发了一种多阶段的H56 疫苗,对Mtb潜伏感染能起到有效的治疗作用[4-5]。Fan等通过融合表达Ag85B-HspX-Rv1813-Rv2660c-Rv2623抗原研制的A1D4疫苗对小鼠Mtb潜伏感染亦表现出良好的免疫保护效果[6]。因此,本研究选取了Mtb在不同感染阶段表达的抗原构建了针对LTBI的DNA疫苗。
前期研究利用Rv3425、PPE26和Rv2029c优势抗原构建的抗LTBI DNA 疫苗p-VAX1-Ag85B-Rv3425-v2029c(A39)在抗LTBI方面具有较好的保护性[7-9]。本研究在质粒DNA A39中导入PPE26基因,构建了质粒Ag85B-Rv3425-PPE26-Rv2029c (V569),转染HEK293T细胞后检测其所编码的蛋白在真核细胞中的表达水平,在C57BL/6小鼠中检测其免疫学特性,在斑马鱼-海分枝杆菌潜伏感染模型中初步检测其保护效果,为研制抗LTBI DNA疫苗提供了依据。
1 材料与方法
1.1 材料
6~8周龄C57BL/6小鼠和3~6月龄成年斑马鱼均购自广州赛柏诺生物科技有限公司,海分枝杆菌(Mycobacteriummarinum,M.marinum)、BCG、A质粒、A3质粒、A39质粒均由复旦大学王洪海教授惠赠,地塞米松、RPMI 1640购自Sigma公司,三卡因购自广州宝汇生物科技有限公司,小鼠细胞因子γ干扰素(interferon γ,IFN-γ)、白细胞介素4(interleukin 4,IL-4)和预包被enzyme-linked immuno sorbent assay(ELISA)试剂盒购自GENEEZYME公司和深圳达科为生物有限公司,质粒抽提和纯化使用QIAGEN 公司plasmid giga kit,PBS购自上海生物工程有限公司,聚合酶链反应(polymerase chain reaction, PCR)试剂、内切酶和连接酶试剂均购自赛默飞公司,DMEM高糖培养基和新生小牛血清购自Gibco公司,小鼠淋巴细胞分离液购自Cedarlane公司,OADC、Middlebrook 7H9和Middlebrook 7H10购自BD Biosciences公司,羊抗鼠 FITC-CD4和羊抗鼠PE-CD8抗体购自eBioscience公司。
1.2 方法
1.2.1 V569质粒的构建以Mtb H37Rv株基因组为模版,利用PCR扩增PPE26基因[10],使用BamHⅠ 和NotⅠ双酶切A39 DNA质粒[11],DNA 连接酶连接酶切后的DNA片段,构建重组质粒V569,并使用双酶切和DNA测序对质粒进行鉴定。质粒构建所需引物见参考文献[10-11]。将A39 和V569阳性克隆菌分别接种于3 mL LB液体培养基(含3 μL 1 μg/ml 青霉素),37 ℃摇床培养过夜,接种于100 mL LB液体培养基(含50 μL 1 μg/ml 青霉素)扩大培养。 质粒抽提和纯化后,采用NanoDrop 2000 测定质粒DNA 浓度。
1.2.2 重组质粒转染HEK293T细胞验证质粒编码蛋白在真核细胞的表达将HEK293T细胞接种于DMEM高糖培养基(含10%新生小牛血清)培养过夜,待细胞密度达到80%时,使用罗氏脂质体Lipo3000将重组质粒DNA(1 μg/皿)转染细胞。对照组转入1 μg对照质粒pVAX1和A39。转染48 h后收集细胞,用蛋白免疫印迹法检测细胞内质粒DNA编码蛋白的表达情况,所用一抗为抗Rv3425和抗PPE26小鼠血清抗体。
1.2.3 小鼠免疫将C57BL/6小鼠分为6组,分别为PBS组、A组、A3组、A39组、V569组和BCG组,每组5只。BCG悬浮于PBS中,终细菌计数 2×107CFU/mL。各组DNA质粒均溶于PBS中,终浓度为1 mg/mL。免疫程序:向小鼠左后腿肌内注射50 μL PBS和BCG(1×106CFU)、A、A3、A39、V569组各50 μg DNA。每2周免疫1次,共免疫3次。最后一次免疫2周后处死小鼠,并测定各项免疫指标。
1.2.4 流式细胞术检测眼球外周血CD4+T细胞和CD8+T细胞免疫2周后,取小鼠眼球外周血并置于含肝素抗凝剂(50 U/mL)的试管内,立即混匀。取100 μL抗凝外周血于5 mL试管中,加入2 mL红细胞裂解液,立即轻轻混匀,在室温下避光孵育3 min。然后以 2 000 r/min离心2 min,将沉淀物重悬于PBS中,重复2次后加入相应的荧光标记抗体(FITC anti-mouse CD4、 PE anti-mouse CD8),避光孵育30 min后洗涤,重悬于PBS中。滤膜过滤后使用流式细胞仪(Attune NxT,赛默飞公司)检测,用FlowJo 7.软件对数据进行分析。
1.2.5 脾淋巴细胞分离和培养将小鼠置75%乙醇消毒5 min后无菌分离脾脏。经200目钢网研磨,制备脾细胞悬液。加入4 mL淋巴细胞分离液后在4 ℃以 1 000 r/min离心10 min,小心吸取双层液面之间的淋巴细胞,用RPMI 1640培养液洗涤3次。计数后,将淋巴细胞悬液按照2.5×105个/孔加至24孔板中。每组细胞分别用Ag85B、 Rv2029c、Rv3478和PPE26抗原刺激,浓度为10 μg/mL。混合均匀后,于37 ℃、5% CO2培养箱中培养36 h。
1.2.6 ELISA检测脾淋巴细胞上清液中IFN-γ、IL-4的水平各组脾淋巴细胞经抗原刺激后,收集上清液用于细胞因子检测,所用试剂盒为小鼠IFN-γ和IL-4预包被ELISA试剂盒。将上清液以100 μL/孔加入96孔平板中,同时设空白孔。37 ℃孵育60 min,洗涤3次后,每孔加入生物素标记的抗小鼠IL-4或IFN-γ抗体100 μL。37 ℃孵育60 min,洗涤3次后,每孔加入生物素标记二抗100 μL。37 ℃孵育30 min,洗涤3次后,每孔加入OPD底物100 μL,避光15 min,每孔加入终止液100 μL。使用酶标仪在450nm波长依序测量各孔的吸光度(OD值)后,根据标准曲线计算出样品中IFN-γ和IL-4的浓度。
1.2.7 斑马鱼潜伏感染模型的构建将海分枝杆菌接种于7H9培养基(7H9+0.2% Tween 80+10% OADC增菌液),调OD600值至0.5左右。用0.02%三卡因溶液麻醉成年斑马鱼1~2 min。用无菌PBS稀释至8×103海分枝杆菌,通过微量注射器和腹腔注射方式向斑马鱼注射5 μL低剂量菌液(30~50 CFU/条)[12]。为检验细菌注射的数量,将5 μL低剂量稀释后菌液涂布于7H10 固体培养基(7H10+10% OADC增菌液)中,计算细菌菌落数为33±11CFU。4周后,斑马鱼全身切片行抗酸染色检测病理状况。同时,为进一步检测斑马鱼潜伏感染模型是否成功建立,我们使用微量注射器向斑马鱼腹腔内注射5 μL高剂量菌液(2561±238 CFU),分别统计斑马鱼在注射低剂量和高剂量菌液后的存活率[12]。
1.2.8 斑马鱼脏器菌落计数斑马鱼海分枝杆菌潜伏感染模型建立后,用DNA疫苗对斑马鱼进行免疫。实验共分6组,每组60条斑马鱼。免疫过程:各组分别腹腔内注射50 μL PBS、BCG、A、A3、A39和V569。其中,BCG含量为1×106CFU,质粒含量均为各10 μg。免疫4周后使用地塞米松饲料进行饲养,每条鱼给予饲料4 mg/d(即地塞米松10 μg/d),持续饲养4周,进行免疫抑制以复活潜伏海分枝杆菌。复活后第1、2周每组分别取5条斑马鱼处死,用于脏器菌落计数。取斑马鱼肝脏在无菌PBS中洗涤,放入组织研磨器后,加入无菌生理盐水1 mL,制成组织匀浆液。分别取10 μL接种于OADC平板培养基上,37 ℃培养4周后进行菌落计数,对比不同时间组、不同免疫组之间脏器菌落形成单位计数的差异。在实验过程中统计斑马鱼死亡数量,绘制生存曲线。
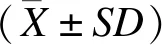
2 结果
2.1 重组质粒DNA编码蛋白可在转染HEK293T细胞表达
将PPE26(1 182 bp)导入质粒A39 (2 568 bp)中,构建了质粒V569(为 3 750 bp)(图1A)。质粒V569经双酶切后,可产生A39和PPE26两个片段(图1B)。
将A39和V569质粒分别转染细胞后,蛋白免疫印迹法检测重组蛋白表达。用抗Rv3425抗体检测重组质粒表达,结果显示,质粒V569转染细胞后,在蛋白相对分子质量(Mr)为110~175 kD处有明显条带;而质粒A39转染细胞后,在72~110 kD处有明显条带(图1C)。用抗PPE26抗体检测重组质粒表达,结果显示,质粒V569转染细胞后在Mr为110~170 kD处有明显条带,而经A39和pVAX1转染的细胞无条带(图1D)。以上表明V569编码蛋白可在真核细胞中表达。

A: PCR products of A39 and V569 analyzed by agarose gel electrophoresis. B: Digested products of A39 and V569 analyzed by agarose gel electrophoresis. C: Western blotting analysis of the expression of Rv3425 using anti-Rv3425 antibody. D: Western blotting analysis of the expression of PPE26 using anti-PPE26 antibody.
图1 蛋白免疫印迹法检测重组质粒DNA在HEK293 T细胞中的表达
Fig.1 The protein expression in HEK293T transfected with the constructed DNA by Western blotting
2.2 质粒V569免疫小鼠可以促进外周血CD4+、CD8+T细胞的增殖
取小鼠眼球外周血,用荧光标记抗体CD4+和CD8+分别标记T细胞,流式细胞仪进行检测。各组免疫后小鼠眼球外周血中CD4+和CD8+T细胞所占比例见表1。相比PBS,BCG、质粒A39和V569均明显刺激了外周血中CD4+T细胞,数量显示增加(图2A)。与A39免疫组相比,V569免疫组中CD4+T细胞数量并无变化,CD8+T细胞数量有所下降,但无显著性差异(图2A和表1)。同时,比较各组中CD4+T/CD8+T细胞比值,质粒V569免疫组中该比值为1.437±0.186,明显高于质粒A免疫组(1.163±0.241)、质粒A3免疫组(1.223±0.183)和BCG免疫组(1.257±0.267);与质粒A39免疫组(1.355±0.208)相比,前者CD4+/CD8+T细胞比值略有升高,但无显著性差异(图2B)。这表明V569可引起较强烈的CD4+T细胞免疫反应。
表1 小鼠眼球外周血CD4+和CD8+T 细胞百分比
Tab.1 The percentage of CD4+and CD8+T cells in PBMC of immunized mice
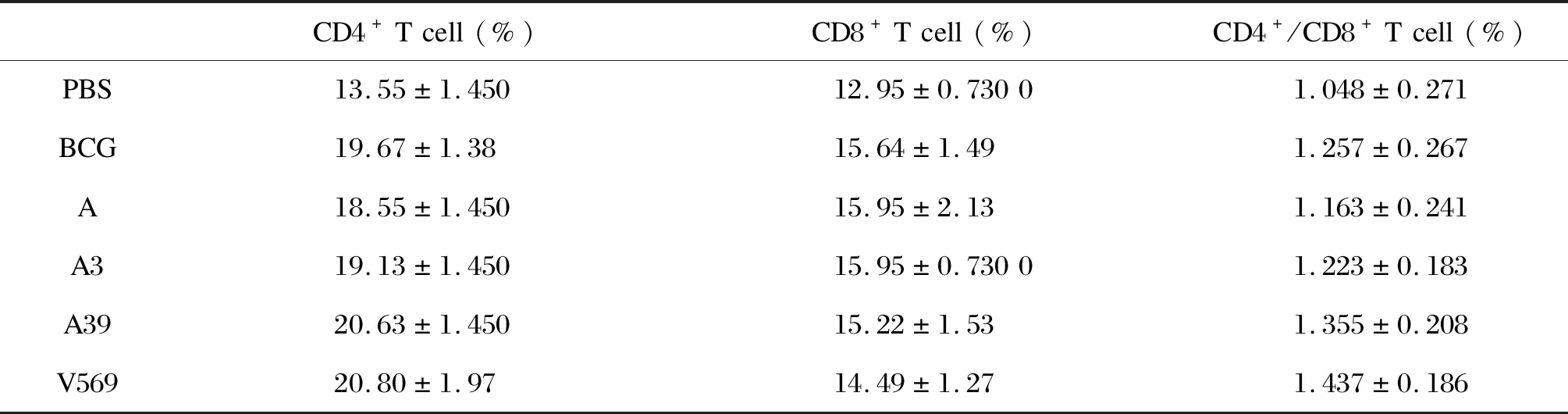
CD4+Tcell(%)CD8+Tcell(%)CD4+/CD8+Tcell(%)PBS13.55±1.45012.95±0.73001.048±0.271BCG19.67±1.3815.64±1.491.257±0.267A18.55±1.45015.95±2.131.163±0.241A319.13±1.45015.95±0.73001.223±0.183A3920.63±1.45015.22±1.531.355±0.208V56920.80±1.9714.49±1.271.437±0.186
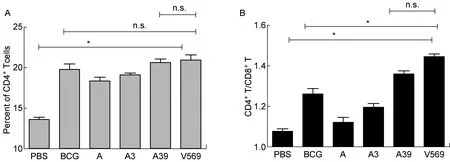
A: the percent of CD4+T cell in in serum of mice immunized with PBS, A, A3, A39 and V569. B: the ration of CD4+/CD8+T cell in serum of mice immunized with PBS, A, A3, A39 and V569.*:P<0.05; n.s.: no difference.
图2 V569对外周血CD4+、CD8+T细胞增殖的影响
Fig.2 The effect of v569 vaccination on CD4+and CD8+T cell in mice
2.3 V569免疫可促进IFN-γ的分泌
取免疫后小鼠脾淋巴细胞,分别经特异性抗原Ag85B、Rv3425、PPE26和Rv2029c刺激后,采用ELISA检测细胞培养上清液中的IFN-γ和IL-4分泌水平。如图3A所示,与PBS对照组相比,V569免疫组小鼠脾淋巴细胞培养上清液中的抗原特异性IFN-γ水平明显升高(分别经Rv3425、PPE26和R2029c 刺激,P<0.05 )。与其他各组相比,A39、V569免疫组中IL-4的分泌水平略有减少(分别经Rv3425、PPE26和R2029c 刺激,P>0.05 ),但各组间无显著差异,见图3B。以上结果提示质粒V569可以诱导较强的细胞免疫应答。
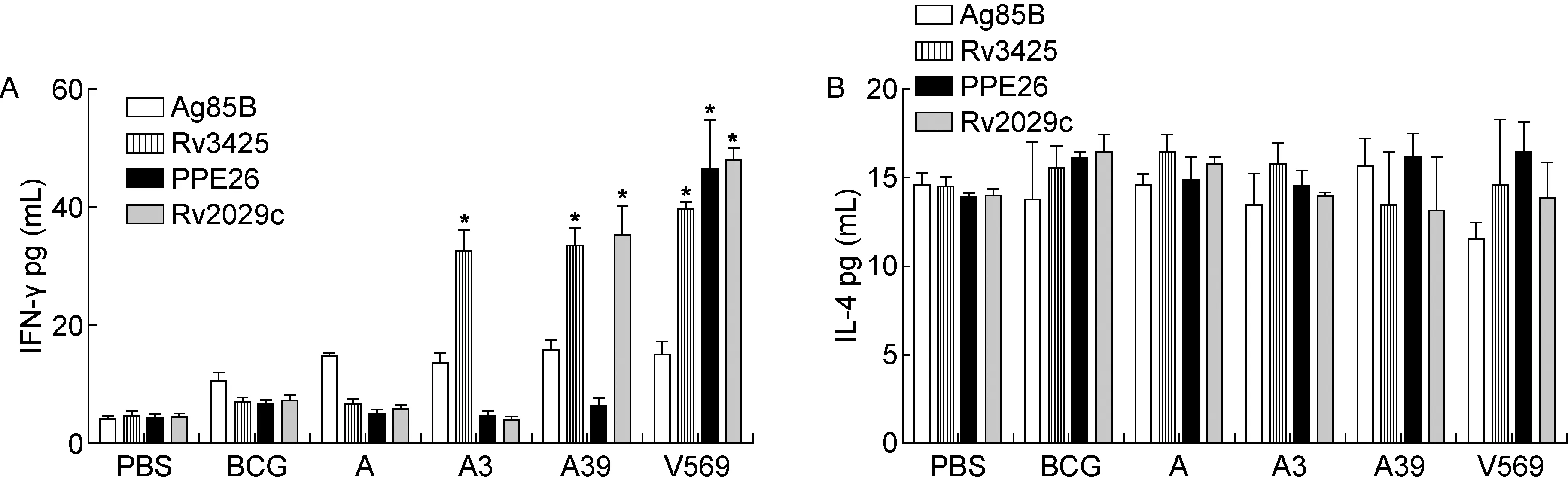
A: The concentrations of IFN-γ in splenocytes response to Ag85B, Rv3425, PPE26 and Rv2029c treatment. B: The concentrations of IL-4 in splenocytes response to Ag85B, Rv3425, PPE26 and Rv2029c treatment.*:P<0.05.
图3 脾淋巴细胞培养上清液中特异性细胞因子分泌水平
Fig.3 Concentrations of IFN-γ and IL-4 in supernatants of mouse splenocytes after vaccination
2.4 质粒V569可抑制斑马鱼-海分枝杆菌潜伏感染复发
利用斑马鱼-海分枝杆菌潜伏感染模型评价DNA疫苗抗潜伏感染保护效率(图4A)。斑马鱼-海分枝杆菌潜伏感染模型建立后,经斑马鱼全身切片抗酸染色观察到了肉芽肿类似结构(图4B)。肉芽肿结构形成反映了TB发生的病理阶段[12]。与高剂量海分枝杆菌感染相比,低剂量菌液感染后,斑马鱼存活时间明显延长(图4C),提示斑马鱼-海分枝杆菌潜伏感染模型成功构建。
将该模型用于评估疫苗抗潜伏感染保护效应。与PBS、质粒A、质粒A3和BCG组相比,质粒V569组斑马鱼14 d存活率接近80%(图4D)。肝脏细菌菌落计数结果显示,质粒V569组中细菌数量明显下降(图4E)。与A39组相比,V569组斑马鱼存活时间延长,菌落计数均有所减少,但无显著性差异(图4D 、4E)。这表明质粒V569也许能抑制斑马鱼-海分枝杆菌潜伏感染的复发。

A: Schematic representation of the experimental protocol for testing vaccine candidates against the reactivation of a latentM.marinuminfection in zebrafish. B: Acid-fast staining in zebrsfish-M.marinumlatent infection model. C: The survival curve of zebrafish infected with low-dose or high-dose bacteria. D: The survival curve of zebrafish after vaccination. E: colony-forming units (CFU) in zebrafish liver.*:P<0.05;**:P< 0.001; n.s.: no difference.
图4 V569抗潜伏感染的保护效率
Fig.4 The protective efficiency of DNA vaccine V569 in zebrafish model
3 讨论
DNA疫苗治疗LTBI是预防Mtb感染复发的有效途径[12]。本研究基于质粒A39 DNA构建了质粒V569 DNA疫苗,与BCG相比,质粒V569在小鼠体内可诱导更显著的Th1型细胞免疫反应;质粒V569对斑马鱼-海分枝杆菌潜伏感染复发表现出较好的保护效果,显著延长了病原菌感染后斑马鱼的存活时间。
Th1型细胞免疫反应对于Mtb感染所引起的机体免疫应答至关重要[13]。IFN-γ可促进Th0细胞增殖分化成Th1细胞和激活巨噬细胞,在抗Mtb感染中起重要作用[14]。本研究中,与PBS相比,质粒V569促进了小鼠淋巴细胞中IFN-γ分泌。IL-4是Th2细胞分泌的细胞因子,可抑制Th1细胞的增殖,拮抗IFN-γ的作用[15]。然而,本实验中PBS组小鼠淋巴细胞中IL-4分泌水平较高,与V569实验组相近。其中原因可能是: IL-4分泌水平在各组中可能都较高,故检测时PBS组与实验组差异不大;然而, IL-4分泌水平在各实验组中无差异,表明质粒V569不会促进免疫对象分泌IL-4。
CD4+T细胞百分比是评价Mtb疫苗效果的重要指标。CD4+T细胞可产生IFN-γ和IL-2,在清除Mtb过程中起关键作用。在Mtb潜伏感染模型中,CD4+T细胞与病原菌活化密切相关[16]。CD8+T细胞能溶解宿主细胞并参与清除Mtb[17]。 在本试验中,与PBS、BCG组相比,V569组的小鼠眼球外周血中CD4+/CD8+T细胞比例均明显升高。 与A39组相比,V569组中CD4+T、CD8+T细胞比例无显著差异。这可能是由PPE57(A39和V569均含有)引起的免疫交叉反应所致[18]。
斑马鱼-海分枝杆菌潜伏感染模型对于研究Mtb的感染、休眠和活化极为重要[12],本实验利用该模型评估V569疫苗抗潜伏感染保护效率,免疫后可较为有效地诱导Th1型细胞免疫反应。因此,质粒V569对斑马鱼中低剂量海分枝杆菌潜伏感染的复发有较好的保护作用;虽然增加了RD5区PPE26抗原,但其免疫原性和保护性并无显著增强,可能是不同PPE抗原之间存在一定程度的免疫交叉反应[18]。本研究为研发新的抗LTBI的DNA疫苗提供了依据。
