人内源性逆转录病毒W家族与疾病相关性的研究
2019-10-29李旭航朱帆
李旭航,朱帆
病毒学国家重点实验室,武汉大学基础医学院,武汉 430071
内源性逆转录病毒(endogenous retroviruses,ERV)在几百万年前侵入宿主生殖细胞或胚胎干细胞并将基因序列整合进入宿主基因组,以垂直传播遗传给子代,经过长年的进化,已成为宿主基因组的一部分[1]。20世纪60年代后期采用病毒学、免疫学及孟德尔遗传学相结合的方式发现了禽白血病病毒、鼠白血病病毒和鼠乳腺肿瘤病毒,证实了ERV的存在[2]。目前在所有的脊椎动物体内均发现了ERV序列[3]。
人内源性逆转录病毒(human endogenous retroviruses,HERV)是包括多发性硬化症(multiple sclerosis,MS)在内的多种疾病的可能病因之一,与人类健康密切相关。HERV主要通过插入诱变影响表观遗传调控和同源拷贝之间产生序列重组2种方式参与疾病的发生过程[4]。
1 HERV
HERV于1982年被发现[5],约占人类基因组的8%~12%[1]。在进化过程中,因基因突变及同源重组引起的缺失与重排等,阻碍了病毒颗粒的正常组装,进而影响其在个体间的水平传播。然而仍有部分HERV家族成员或保留了病毒所有蛋白的开放读码框架或可编码部分病毒来源的产物[6]。
1.1 命名与分类
逆转录病毒的类别众多,针对HERV的统一命名,既有利于对基因组信息进行注释,又可用于研究HERV对宿主基因组的影响。一般以在ERV前添加字母表示所属物种,以及用病毒引物结合位点所结合的第1个氨基酸命名。
HERV的分类学研究通常采用系统发育方法,主要依据高度保守的pol基因序列相似性进行分析。已发现的HERV家族成员有70个,其中经典的有39个,主要分为3个类别:Ⅰ类(gamma-like)、Ⅱ类(beta-like)和Ⅲ类(spume-like),见表1;非经典的有31个,被归为epsilon-like等未分类组[7]。基于Repeatmasker和Retrotector等新技术的应用及对HERV的深入研究,有人提出了兼顾传统命名方式、序列相似度与分子进化以及病毒结构与功能的新分类方法,但目前尚未形成系统[8]。
1.2 结构
完整的HERV结构由基因gag、pro、pol与env及两个长末端重复序列(long terminal repeat,LTR)组成。gag基因主要编码病毒的结构蛋白;pol基因主要编码参与病毒复制过程的酶, 如逆转录酶、整合酶等;env基因编码的包膜蛋白由胞外段和跨膜段组成,可辅助病毒的侵袭和感染;LTR包含HERV转录必需的启动子和增强子,调节HERV家族基因的表达[9]。
表1 HERV分类及主要成员
Tab.1 Classification of HERVs and major members
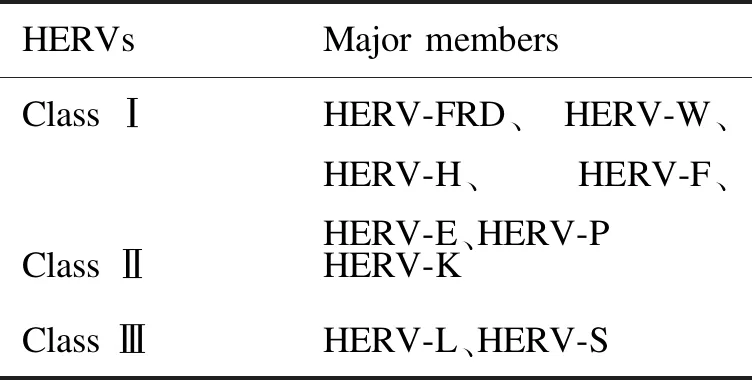
HERVsMajormembersClassⅠHERV-FRD、HERV-W、HERV-H、HERV-F、HERV-E、HERV-PClassⅡHERV-KClassⅢHERV-L、HERV-S
2 HERV-W
2.1 简介
HERV-W属于Class Ⅰ(γ逆转录病毒相似元件)家族成员。1989年Perron团队从MS患者体内分离到一种HERV颗粒,命名为多发性硬化相关逆转录病毒(multiple sclerosis associated retrovirus,MSRV)[10];此后与MSRV同源的序列在人类基因组中被发现,因此,统一命名为HERV-W[11]。位于7号染色体上的包膜蛋白基因(HERV-Wenv,又称ERVWE1)可编码ENV蛋白,主要在人胎盘中表达,参与合胞体形成并介导滋养层细胞融合,故又名为Syncytin-1。Syncytin-1可与中性氨基酸转运蛋白A(neutral amino acid transporter A,SLC1A4)和中性氨基酸转运蛋白B(0)﹝neutral amino acid transporter B(0),SLC1A5﹞ 结合而发挥作用[12]。
2.2 生理功能
HERV-W的转录活性在生理状态下受表观遗传调控,其表达产物在人胎盘形成过程中发挥重要作用。孕期母亲血液中HERV-W的表达水平上调,1周岁的小儿体内HERV-W已有转录活性[13]。HERV-W调控网络是保证相关基因发挥正常功能的重要组成部分[6]。
2.2.1 受表观遗传调控LTR对于HERV基因的转录与表达起重要调控作用,主要通过调节基因的甲基化等方式实现。LTR甲基化水平降低会导致HERV转录活性增强。由于人胎盘中HERV的LTR甲基化水平较低,因而可检测到许多HERV家族成员的表达,如HERV-W[6]。
2.2.2 参与免疫调节HERV-W对宿主免疫系统具有重要作用。Toll样受体4(toll-like receptor 4,TLR4)和白细胞分化抗原14(cluster of differentiation 14,CD14)是天然免疫重要的模式识别受体和共同受体。HERV-W编码的Syncytin-1可激活天然免疫。Syncytin-1通过胞外段与TLR4相互作用,导致外周血单核细胞中促炎细胞因子﹝白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin6,IL-6)及肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)﹞分泌,从而引起急性和慢性炎症[14]。
3 HERV-W与疾病关系
研究发现,在自身免疫性疾病、神经精神疾病等多种疾病中,HERV-W RNA和蛋白的表达上调可能引起宿主细胞的病理损伤,因此,HERV-W被认为是一类新的致病因子[15-16]。
3.1 与自身免疫性疾病相关
MS是一种中枢神经系统自身免疫性疾病,患者脑部发生脱髓鞘病变,进而导致中枢神经系统少突胶质细胞和轴突损伤[17]。在MS患者大脑和血液及脑部损伤的细胞表面均可检测到Syncytin-1表达上调[18-19]。而针对Syncytin-1胞外段的抗体在患者血清和脑脊液中显著升高,表明患者体内存在针对Syncytin-1的免疫应答[20]。
慢性炎性脱髓鞘多发神经病变(chronic inflammatory demyelinating polyneuropathy,CIDP)病理学表现为周围神经近端慢性脱髓鞘[17]。Syncytin-1在患者生物组织活检中表达上调,可刺激神经膜细胞﹝施万细胞(Schwann cell)﹞产生IL-6和C-X-C基序趋化因子10(C-X-C motif chemokine 10,CXCL10),进而促进细胞融合、增殖与转化[21]。
1型糖尿病(type-1 diabetes,T1D)是一种复杂的自身免疫性疾病,患者体内的免疫反应导致胰腺β细胞受损。Syncytin-1在患者血清、外周血单核细胞、腺泡胰腺细胞中上调表达[22],既可抑制胰岛素分泌,又与胰腺中巨噬细胞浸润相关,对于1型糖尿病的发病有双重病理生理学作用[4]。
3.2 与神经精神疾病相关
精神分裂症患者存在认知障碍,包括阳性性状(如妄想、幻觉等)和阴性症状(如消极行为等)。在患者脑部和血液中检测到HERV-W的Pol、Gag和Env蛋白表达上调[23-24],且针对HERV-W Pol蛋白的血清抗体水平显著升高;但脑组织前扣带皮质和海马回的神经元以及星形胶质细胞内Gag蛋白水平显著降低[25-26]。
双向情感障碍患者存在心理障碍,会经历亢奋期和抑郁期。研究发现,患者体内Syncytin-1的表达水平升高,而神经元和神经胶质细胞中的HERV-W Gag蛋白表达显著下调[26-27]。
3.3 与癌症相关
在膀胱上皮细胞癌组织(urothelial cell carcinoma,UCC)中,研究者发现了HERV-W 3′-LTR的突变,由于转录因子与突变位点结合Syncytin-1表达显著上调,促进了人尿道上皮细胞增殖,并参与膀胱上皮细胞癌的发生和发展[28]。
此外,在急性单核细胞白血病、淋巴瘤、乳腺癌、子宫内膜癌、精原细胞瘤等患者体内,Syncytin-1的RNA和蛋白表达水平均呈上调趋势[29-33],表明其有可能成为某些癌症患者的生物标志物。
3.4 与其他疾病相关
肌萎缩侧索硬化症患者脑部运动皮质区HERV-W env的转录水平降低[34],但肌肉组织活检中检测到Env和Gag蛋白表达增加[35]。此外HERV-W在克雅病患者脑脊液以及感染人类免疫缺陷病毒的母亲体内转录水平显著升高[4,36]。
4 HERV-W致病机制
HERV-W病毒蛋白在正常成年人器官中的转录活性极低甚至没有,但在自身免疫性疾病、精神类疾病以及部分癌症患者体内处于转录激活状态。HERV-W的激活受病毒感染或环境因素的调控[37]。
4.1 转录激活
4.1.1 病毒蛋白调控HERV-W转录激活多种病毒或病毒蛋白可引起HERV-W转录活性增加。
甲型流感病毒通过升高GCM基序蛋白1(GCM motif protein 1,GCM1)的转录水平及降低ERVWE1位点的甲基化水平,使HERV-W的转录去阻遏,从而激活HERV-W;通过干扰DNA甲基转移酶活力,使甲基化水平降低,从而激活HERV-W[38]。
乙型肝炎病毒(hepatitis B virus, HBV)可通过HBx蛋白(hepatitis B virus X protein)介导HERV-W的反式激活。HBx蛋白经细胞核因子κB(nuclear factor κB,NF-κB)信号途径上调人肝癌细胞中Syncytin-1的表达[39]。
Epstein-Barr病毒(Epstein-Barr virus,EBV)包膜糖蛋白GP350(glycoprotein 350,GP350)与白细胞分化抗原21(cluster of differentiation 21,CD21)结合诱导NF-κB的活化,而NF-κB与增强子结构域内相关元件结合在HERV-W激活过程中起重要作用[40]。
人巨细胞病毒(human cytomegalovirus,HCMV)调节DNA甲基转移酶的活性,引起HERV-W启动子甲基化水平降低,从而激活HERV-W。而具有高HCMV载量的肾移植受者体内HERV-Wpol转录水平显著升高,可能是HCMV诱导的细胞因子和生长因子增强了HERV转录活性[41-42]。
1型单纯疱疹病毒(herpes simplex virus type 1,HSV-1)可诱导HERV-W的转录激活。细胞内广泛存在的转录因子八聚体结合蛋白1(octamer-binding protein 1,Oct-1)可能是HSV-1激活HERV-W的重要物质。在神经母细胞瘤细胞系IMR-32中,HSV-1可诱导Gag蛋白和Env蛋白的上调表达[43]。
4.1.2 环境因素调控HERV-W转录活性除了病毒外,药物等因素也会增强HERV-W的转录活性。研究发现,咖啡因和阿司匹林可促进人神经母细胞瘤细胞系SH-SY5Y中HERV-W Env和Gag蛋白的表达[44]。
4.2 HERV-W致病作用
HERV-W如同癌基因一样,正常情况下,参与机体细胞的正常生理作用;异常情况下,则会引起宿主细胞的病理损伤。HERV-W编码的包膜糖蛋白Syncytin-1可能与多种疾病的发生相关,其致病机制研究主要集中于Syncytin-1蛋白引起免疫炎症方面。
具有超抗原特性的Syncytin-1在患者体内表达上调,会导致自身反应性T细胞异常活化,进而引起促炎性细胞因子如TNF-α和IL-6的大量分泌,从而导致患者体内炎症反应[45]。TLR信号途径在微生物感染引起的天然免疫中起关键作用。Syncytin-1可与内源性高效激动剂TLR4相互作用,因Syncytin-1的促炎特性,影响脑部髓鞘再生过程;影响TLR4介导的一氧化氮合酶表达和硝基酪氨酸的形成,最终影响少突胶质细胞分化和髓鞘表达[19],引起小鼠模型中的星形胶质细胞和少突胶质细胞损伤,以及多发性硬化症样疾病[46]。Syncytin-1介导的特异性免疫反应可能作为髓鞘蛋白的潜在分子模拟物而存在交叉反应[47]。研究发现由Syncytin-1介导的小胶质细胞极化作用可能引起患者的轴突损伤和神经变性[48]。
本课题组也证实Syncytin-1可能会导致神经炎症。在精神分裂症患者中,Syncytin-1和炎症标志物C反应蛋白(C-reactive protein,CRP)均上调表达且两者间存在正相关;在小胶质细胞中,Syncytin-1可通过与Toll样受体3(toll-like receptor 3,TLR3)结合,诱导IL-6的表达,活化CRP,引起神经炎症[49];一氧化氮(nitric oxide,NO)在细胞膜上自由扩散作为神经递质发挥作用,而Syncytin-1可增加精神分裂症患者NO的产生和小胶质细胞的迁移能力[50];Syncytin-1蛋白表面还具有细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)反应的HLA-A*0201+限制性抗原表位[51]。
另外,Syncytin-1可直接调节瞬时受体电位阳离子通道 C 亚族成员3(transient receptor potential cation channel subfamily C member 3,TRPC3)Ca2+通道,或通过下调精神分裂症断裂基因1(disrupted in schizophrenia 1,DISC1)激活TRPC3,使神经细胞中Ca2+内流[52],进而引起小电导Ca2+激活的K+通道蛋白3(small conductance calcium-activated channel,subfamily N,member 3,KCNN3,SK3)的开放[53]。Syncytin-1过表达可激活糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)信号传导途径,致GSK3β的9位丝氨酸的磷酸化水平升高及GSK3β活性下降[54];环磷酸 腺苷反应元件结合蛋白(cyclic adenosine monophosphate response element-binding protein,CREB)的磷酸化水平升高诱发大脑神经营养因子(brain-derived neurotrophic factor,BDNF)的表达上调。此外还可调控神经营养型酪氨酸激酶受体2及多巴胺受体D3的表达[55]。
总结以上研究,我们提出一个假说:Syncytin-1蛋白受外界因素的影响在神经细胞中高表达,“触发”(trigger)精神分裂症相关基因的异常表达,引起神经炎症,导致神经细胞异常,最终引发精神分裂症。Syncytin-1在此过程中起着重要的“桥梁”(bridge)作用(图1)。
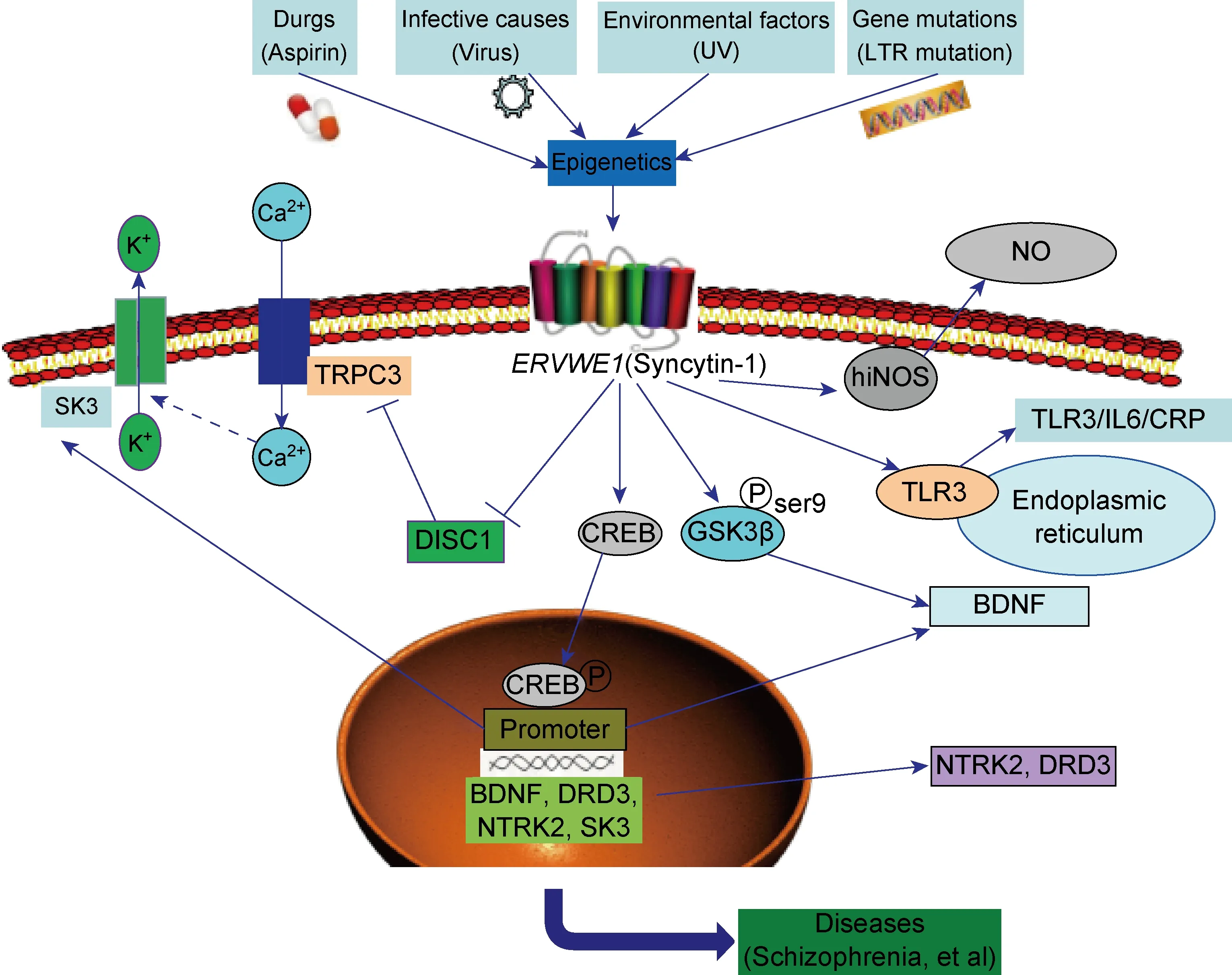
图1ERVWE1(Syncytin-1)参与疾病的可能机制
Fig.1 Possible mechanisms ofERVWE1(Syncytin-1)involved in diseases
5 GNbAC1——靶向Syncytin-1的治疗方法
人源化的GNbAC1是IgG4单克隆抗体,通过特异性结合Syncytin-1的胞外段,特异性中和其结合TLR4的能力,在体内外均可抑制TLR4的促炎特性,减少IL-6和TNF-α的释放[45],而且还能抑制IL-6和CXCL10上调表达。
GNbAC1可能促进MS患者的髓鞘再生过程,目前已在33名健康受试者的Ⅰ期临床试验和10名MS患者Ⅱa期的12个月临床实验中评估GNbAC1作用,发现其具有良好的安全性及血流动力学特性。接受治疗后大多数患者HERV-W的转录水平下降,脑部病变状况稳定[56]。针对270名患者Ⅱb期的临床实验发现,患者脑萎缩程度下降[57]。
GNbAC1靶向治疗MS、CIDP和1型糖尿病等疾病的临床研究正在进行中,为相关疾病的治疗提供了一种新的选择。
6 结语
HERV-W与人类健康密切相关。研究发现,HERV-W编码的ENV蛋白(Syncytin-1)在多种信号通路中起调控作用,可能作为环境因素与遗传因素间相互作用的“桥梁”,在自身免疫性疾病与精神疾病的发生、发展过程中扮演重要的角色。而针对此蛋白的人源化单克隆抗体GNbAC1已用于MS的临床研究,并具有较好的结果。因此,对HERV-W Syncytin-1 的研究,可为新药研发提供潜在的作用靶标。
对于HERV的研究,还可在临床器官移植过程中发挥重要作用。人体异种器官移植最合适的供体之一是猪,但猪体内存在的ERV有感染人类的潜在风险,而使用CRISPR/Cas9基因靶向修饰ERV聚合酶基因构建的基因工程猪,可能为患者临床治疗提供新希望[58]。因此HERV的研究对于人类健康意义重大。
此外,HERV-W编码的Gag蛋白在精神疾病等患者体内也存在表达异常的状况,这些蛋白的致病机制尚不明确。针对此类蛋白的探索,可为研究HERV-W提供新的方向。
