miR-124对胃癌细胞的生物学功能影响
2019-10-24符清胜吴克盛赵国海
符清胜,吴克盛,赵 军,赵国海
(皖南医学院第一附属医院 弋矶山医院 胃肠外科,安徽 芜湖 241001)
胃癌是第五位最常诊断的癌症,也是第三大癌症死亡原因,2018年新增病例超过100万例,死亡人数估计为783 000人(相当于全球每12人死亡中有1人死亡),亚洲是胃癌发病率最高的地区[1]。微小RNA(microRNA)是一类高度保守,由 18~25 个核苷酸组成的非编码小RNA,通过识别目标 mRNA 3′端非编码区的互补序列,诱导脱腺苷化,从而抑制 mRNA的表达[2]。近期相关报道指出 miR-124 在胃癌中呈低表达,且与胃癌的发生发展密切相关[3],但是miR-124 对于胃癌的作用及相关机制的研究相对较少。本项目旨在研究miR-124在胃癌中的表达情况及其对胃癌生物功能学的影响,并探讨其可能的分子机制,以期为胃癌的早期诊断和分子治疗提供新的靶点。
1 材料与方法
1.1 材料 人胃癌组织和距离癌肿5 cm的癌旁组织取自弋矶山医院;人类胃癌细胞株BGC-823、MGC-803、SGC-7901、AGS和正常胃黏膜上皮细胞GES-1购自中国科学院上海生命科学研究院细胞库;miR-124 mimics、micro Negative control(NC)(广州锐博生物);1640培养基(Hyclone);胎牛血清(Clark);FECTTM CP 转染试剂盒(广州锐博生物);TRNzol(TIANGEN);miRNA cDNA第一链合成试剂盒(TIANGEN),miRNA荧光定量检测试剂盒(TIANGEN);BCA试剂盒(碧云天);Antibody AKT,Antibody p-AKT(Ser473),Antibody PI3K,Antibody p-PI3K,Antibody β-actin(CST);使用的引物均购自锐博生物技术。引物序列为,miR-124正向:5′-GCGCCGTGTTCAGCGGACC-3′和miR-124反向:5′-GTGCAGGTCCGAGT-3′,U6正向:5′-CGCTGTCGCAGCAGCACATACTA-3′和U6反向:5′-CGCTTCTCTCACACGATTGGTGTCTCTCA。
1.2 方法
1.2.1 细胞培养 细胞株均在37 ℃加湿5%CO2+95%空气的条件下,加入10%胎牛血清+100 U/mL青霉素+100 mg/mL链霉素的1640培养基中培养,在完全1640培养基中分别用不同浓度miR-124 mimics、miR-NC处理细胞,采用qRT-PCR验证转染效率,最终浓度确定为100 nmol/L,转染时间确定为24 h;转染后BGC-823细胞miR-124表达上调最明显,所以功能实验我们选择胃癌细胞株BGC-823进行实验。所有细胞实验均重复3次,取平均值进行统计学分析。
1.2.2 细胞增殖实验 在96孔板中接种BGC-823细胞(每孔3000细胞),用100 nmol/L miR-124 mimics、NC处理BGC-823细胞24、48和72 h,用CCK-8法检测细胞BGC-823的增殖情况,37 ℃时加入10 μL CCK-8(5 mg/mL),在5%CO2和95%空气的加湿条件下孵育2 h。然后使用酶标仪在450 nm处测定吸光度。
1.2.3 Transwell迁移实验 对胃癌细胞BGC-823瞬时转染miR-124 mimics、miR-NC。转染 24 h后消化收集细胞,以5×104/孔接种于Transwell小室中。上层为 100 μL 无血清培养基,下层为 600 μL 含10%胎牛血清的培养基继续培养,24 h后弃去培养基,湿棉棒轻轻擦去小室内细胞,甲醇固定15 min,0.1%结晶紫染色5 min,倒置荧光显微镜下观察,并拍照取图。
1.2.4 流式细胞技术 瞬时转染方法同上,转染24 h后,胰酶消化后离心(2000 r/min,离心5 min)收集,PBS洗涤细胞两次(2000 r/min,离心5 min),加入500 μL的Binding Buffer悬浮细胞,再加入5 μL Annexin V-FITC混匀后,加入5μL Propidium lodide混匀,室温避光反应15 min,1 h内用流式细胞仪检测细胞的凋亡率。
1.2.5 实时荧光定量PCR(qRT-PCR) 使用TRNzol从收集的42对胃癌组织和癌旁组织以及转染前后的BGC-823、MGC-803、SGC-7901、AGS、GES-1细胞中提取总RNA。根据生产厂家的说明,使用逆转录试剂盒对总RNA进行 cDNA的合成(42℃反应60 min,95℃反应4 min),以GAPDH为内参,使用扩增试剂盒对cDNA进行扩增[95℃扩增15 min;(94℃扩增20 s、60℃扩增34 s×40个循环],以2-△△ct计算相对表达量,完成PCR。
1.2.6 Western blot 将BGC-823、SGC-7901细胞(每孔5×104个细胞)接种于6孔板中,瞬时转染miR-124 mimics、NC 24 h后,收集细胞加入蛋白上样缓冲液,置入沸水中煮5 min,BCA试剂盒检测蛋白浓度后,SDS-PAGE凝胶电泳后湿转75 min至NC膜上,5%胎牛血清(BSA)室温封闭2 h,加入p-PI3K、PI3K、p-AKT、AKT抗体或β-actin抗体, 4℃孵育14 h,TBST洗膜3次,每次5 min,置入二抗孵育1 h,再次洗膜3次,避光ECL显影,内参为β-actin,使用Image J软件对曝光结果进行分析。

2 结果
2.1 miR-124在胃癌中低表达 与癌旁组织(1.14±0.27)相比,胃癌组织(0.70±0.15,t=10.14,P=0.000)中miR-124的表达降低(图1),其中miR-124与临床及病理参数之间的关系见表2。另外与GES-1相比,4株胃癌细胞株BGC-823、MGC-803、SGC-7901和AGS(0.47±0.06、0.47±0.5、0.54±0.07、0.49±0.07)的miR-124表达也降低(P<0.05),而4株胃癌细胞之间miR-124的表达差异无统计学意义(P>0.05)(见表1)。
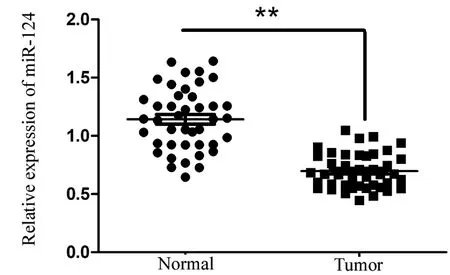
图1 PCR检测胃癌组织和癌旁组织miR-124表达情况
表1 正常胃黏膜上皮细胞与4株胃癌细胞miR-124表达(n=3)
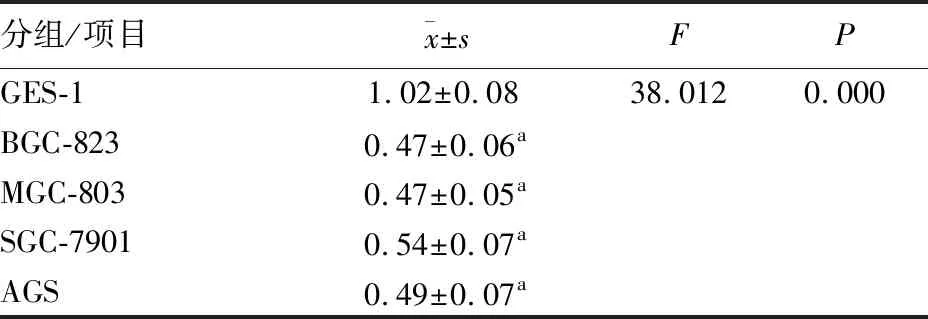
分组/项目x±sFPGES-11.02±0.0838.0120.000BGC-8230.47±0.06aMGC-8030.47±0.05aSGC-79010.54±0.07aAGS0.49±0.07a
注:与GES-1组比较,aP<0.05。
2.2 miR-124与临床及病理参数之间的关系 miR-124表达与肿瘤的T分期、TNM分期、淋巴结转移及分化程度相关,其中,T3、T4期的表达较T1、T2期低,Ⅲ、Ⅳ期的表达较Ⅰ、Ⅱ期低,有淋巴结转移的较无淋巴结转移的表达低,分化程度好的较分化程度差的表达低(见表2)。
2.3 过表达 miR-124抑制胃癌细胞的增殖 CCK-8检测结果显示,转染24 h后,相比于miR-NC组(0.94±0.09),转染miR-124 mimics(0.62±0.06,t=6.615,P=0.000)后,BGC-823细胞增殖能力降低(图2)。

图2 CCK-8检测过表达miR-124后细胞的增殖能力(n=5)
表2 不同临床特征的胃癌患者胃癌组织的miR-124表达

变量nmiR-124tP年龄/岁 < 60180.70±0.190.3700.713 ≥ 60240.72±0.16性别 男320.72±0.170.3160.754 女100.70±0.19T分期 T1,T290.84±0.142.5870.013 T3,T4330.68±0.17TNM分期 Ⅰ~Ⅱ150.87±0.166.2440.000 Ⅲ~Ⅳ270.62±0.10淋巴结转移 阳性220.60±0.105.6420.000 阴性200.83±0.16组织学分级 高、中分化140.62±0.142.6590.011 低分化280.76±0.17肿瘤大小/cm < 5200.69±0.180.7410.463 ≥ 5220.73±0.17
2.4 过表达 miR-124抑制胃癌细胞的迁移 Transwell检测结果显示,转染miR-124mimics后BGC-823细胞迁移的数目(53.67±12.58)低于转染miR-NC(152.33±14.05,t=9.061,P=0.001)的细胞(图3)。
2.5 过表达 miR-124促进胃癌细胞的凋亡 流式细胞检测结果显示,转染miR-124mimics后BGC-823细胞的凋亡率(8.30±0.31)高于转染miR-NC(2.10±0.56,t=16.777,P=0.000)的细胞(图4)。
2.6 过表达miR-124后PI3K/AKT表达量减低 Wstern blot实验结果显示,转染miR-124 mimic后,BGC-823细胞中p-AKT蛋白表达量(34.87±4.23)相对于转染miR-NC(118.90±10.51,t=12.847,P=0.000)的细胞降低,同样p-PI3K水平也降低(158.53±10.94vs. 71.07±4.51,t=12.802,P=0.000)(图5)。

A.转染miR-124 mimics和miR-NC后发生迁移的细胞(SP×100);B.两组迁移细胞数目的统计结果(n=3)。
图3 Transwell法检测胃癌细胞的迁移能力

A.转染miR-124 mimics和miR-NC后流式细胞检测胃癌细胞凋亡情况;B.两组细胞凋亡率的统计结果(n=3)。
图4 流式细胞仪检测过表达miR-124后胃癌细胞的凋亡情况

A.转染miR-124 mimics后Western blot检测磷酸化的AKT/P13K表达情况;B.转染miR-124 mimics后磷酸化的AKT灰度值统计结果;C.转染miR-124 CBmimics后磷酸化的P13K灰度值统计结果(n=3)。
图5 Wstern blot检测相关通路蛋白AKT、PI3K的磷酸化水平
3 讨论
越来越多的研究表明,在许多癌症中miR-124的表达下调,如miR-124在肝癌中表达下调,并且通过靶向BIRC 3调节NF-κb信号通路来抑制肝癌的增殖和迁移[4];另外Ji等[5]研究表明,miR-124在三阴性乳腺癌组织和细胞中表达下调,过度表达miR-124可抑制三阴性乳腺癌细胞的增殖、转移和上皮间充质转换(EMT)。同样,在胃癌中许多miRNAs在胃癌中发生了异常的改变[6],但它们在胃癌发生和进展中的分子机制仍然不甚清楚。因此,探索miRNAs在胃癌发生发展中的具体作用将极大地帮助我们加深对胃癌的了解,并为其诊断和治疗提供新的靶点。在本研究中,我们发现miR-124在胃癌组织中的表达相对于癌旁组织出现了下调,且与肿瘤的恶性程度相关。我们通过CCK-8实验、克隆形成、Transwell、流式细胞技术等多种实验,证明了miR-124的过表达抑制了胃癌BGC-823细胞的体外增殖和迁移,并促进胃癌BGC-823细胞的凋亡。这些发现表明miR-124在胃癌的发生发展中起着重要的调节作用。
PI3K/AKT信号通路是一种重要的信号转导通路,已被报道在抑制细胞凋亡和促进细胞增殖方面起着重要的作用[7]。激活磷脂酰肌醇3-激酶(PI3K)/AKT是促进细胞存活和抑制细胞死亡的重要步骤[8]。PI3K和AKT是磷酸化致癌的重要介导因子[9]。其中AKT是PI3K的主要下游靶点,磷酸化的AKT是活性形式[10],AKT的磷酸化与细胞凋亡过程密切相关[11]。同样,PI3K/AKT信号通路在胃癌中也有较多的研究。Wang等[12]研究发现miR-183可靶向调节和抑制PI3K/AKT信号通路来抑制胃癌细胞的增殖、迁移并促进胃癌细胞的凋亡。除此之外,PI3K/AKT信号通路还参与了胃癌的EMT过程,Song[13]研究发现,miR-340靶向SPP1可能通过抑制PI3K/AKT信号传导途径抑制胃癌细胞的EMT,并促进胃癌细胞的凋亡。
本研究在胃癌细胞株BGC-823中过表达miR-124后发现磷酸化的PI3K/AKT(p-PI3K、p-AKT)表达量均出现下调,提示PI3K/AKT通路可能参与了miR-124调控胃癌细胞的生长。而PI3K通路的激活参与了抗肿瘤治疗的发展,阻断PI3K信号通路可以增强对这些治疗的反应[14]。本研究确定了miR-124可能调节胃癌细胞PI3K/AKT信号通路,提示miR-124在临床治疗中具有重要作用。
