基于多维度集成算法的T2*定量成像对颅内出血的诊断
2019-10-23吴宗山彭传勇叶永泉陈艳玲张树恒徐启兰李运运项杨陈琪
吴宗山,彭传勇,叶永泉,陈艳玲,张树恒,徐启兰,李运运,项杨,陈琪
颅内出血(intracerebral hemorrhage,ICH)是常见的多病因脑血管疾病,常见病因包括高血压、创伤、缺血性梗塞出血转化、脑动脉瘤、脑动静脉畸形、脑淀粉样血管病、硬脑膜动静脉瘘和静脉窦血栓形成等。磁共振成像检测ICH的最有效方法是磁化率加权成像(susceptibility weighted imaging,SWI)[1-5]。SWI图像的计算结合了信号幅值的T2*加权(T2*W)信息和信号相位的偶极场分布信息,因此对出血灶中所含的铁元素造成的局部场扰动非常敏感,可产生较强的图像对比度。如对颅内微出血(cerebral micro-bleeds,CMB)的检测,研究表明SWI的敏感度要高于T2*W和CT[6-8]。
然而SWI技术也存在一定的局限性。由于利用了相位中的偶极场信息,因此SWI图像对比中存在一种扩大效应(blooming effect),即强磁化率的组织在SWI图像的显示范围要比实际尺寸大。这对于微出血灶的显示是有利的,然而对于面积较大而且铁沉积水平较高的出血灶而言,这种扩大效应会导致对出血灶真实尺寸估计和边界定位的错误。另外在固定的回波时间(TE)设置下,当出血灶铁沉积超过了一定的水平后,SWI图像的信号将饱和在噪声水平上不再变化,不能有效地进一步判断出血的程度。
另一方面, T2*弛豫时间是一个与成像协议参数无关的物理量,因此可以更好的反映生物组织在当前磁场强度下的磁化率特性。T2*定量成像(T2*mapping)技术通常通过采集不同TE下的幅值信号,并利用对信号-时间曲线进行拟合计算得到T2*弛豫时间[9,10]。最近Ye等[11]提出了一种新型的多维度集成(multi-dimensional integration,MDI)T2*定量计算方法,不仅可以利用复数形式的回波信号进行计算,更可以利用相位阵列线圈的通道维度进行信噪比T2*定量准确度的提升。
本研究探讨和比较基于MDI与拟合算法获得的T2*定量成像的图像质量,以及在ICH诊断上的应用价值。
材料与方法
1.临床信息
搜集2018年11月-2019年5月本院中老年患者93例MRI数据,排除其中运动伪影严重的5例,实采89例。其中男49例,女40例,平均年龄(63.7±13.4)岁。研究对象入选标准为可疑颅内出血或脑内多发梗死入院治疗患者,且无任何MRI检查禁忌症状。所有患者均具备完整的相关病史及实验室检查资料,愿意配合本研究要求并签署知情同意书。
2.图像采集及重建
图像扫描使用联影3T uMR770成像系统及配套24通道头颈联合线圈。扫描协议包括常规头颅DWI、T2WI、T1WI及FLAIR检查。T2*定量数据通过一个三维多回波SWI序列进行采集,扫描参数TR 32 ms,回波数6,回波时间TE 3.6~26.6 ms,回波间距TE 4.6 ms,体素尺寸0.5 mm×0.5 mm×1 mm,成像视野224 mm×190 mm,扫描时间3分42秒。
使用MDI定量计算T2*步骤:首先扫描获取每个回波信号对应的所有线圈通道的幅值与相位图像,然后将幅值图像与相位图像点点对应地合并为复数信号。由于数据中存在着6个回波以及24个线圈通道,因此共产生6×24=144组三维复数图像。利用MDI计算获得ΔTE内的复数信号变化ΔS[11],计算公式如下:
(1)
其中Ne为回波数目(Ne=6),Nc为信号通道数目(Nc=24),S(i,j)为对应第i个回波和第j个线圈通道的复数信号。计算式1的求解是基于单个体素的基础上进行的。当通过计算式1获得了某体素的ΔS后,该体素的T2*数值可直接通过以下关系得到:
T2*=-ΔTE/ln|ΔS|
(2)
使用拟合方法计算T2*数值图。首先先对所有通道的幅值信号进行平方和(sum-of-square,SOS)合并,获得共6组三维回波幅值图像。然后通过对应每个体素的所有回波幅值信号数值点进行拟合计算。对于线性拟合方法,先对回波幅值信号进行自然对数变换,然后根据线性方程ln(Ssos(TE))=a·TE+b进行最小二乘拟合,计算得到斜率a和截距b。对于指数拟合方法,则直接根据指数方程Ssos(TE)=b·e-aTE进行最小二乘拟合,计算得到拟合系数a和b。两种拟合均可得到T2*=1/a。
最后,为了对生成的T2*定量图信噪比及T2*数值可信度进行分析,使用蒙特卡罗方法分别计算3种算法从原始图像到T2*定量图的噪声传播系数图像[11]。
3.图像评分及统计分析
首先通过SWI图像对颅内出血灶进行初步定位。然后对3种方法获得的T2*定量图进行关于图像质量与对出血灶检测的敏感度进行评分。评分由3位放射科医生分别进行,观察图像时屏蔽所有患者信息,且各自随机化对不同患者、不同T2*定量图的观察顺序。
对于典型大脑组织的T2*数值分析,通过手动选取灰质、白质和脑脊液较为均匀的多个局部区域作为ROI,提取同一组织所有ROI的T2*值的平均值与方差,并与文献数值作对比。
对图像整体质量的评价使用5级评分。1分为图像质量极差,完全不具备诊断价值;2分为图像质量较差,诊断价值低;3分为图像质量一般,具有可接受的诊断可靠性;4分为图像质量良好,诊断可靠性较高;5分为图像质量优良,具有明确的诊断可靠性。
对出血灶检测敏感度的评价使用3级评分。1分为不可可靠检测;2分为可结合其他图像信息进行检测;3分为可单独进行可靠的检测。
评分结果使用Excel软件进行统计分析。对于T2*定量图质量评分结果,首先计算每位评分员对每种方法对应的所有病例的评分的平均值与方差,然后综合3位评分员的所有病例评分对每种方法分别计算平均值与方差。为了判断每位评分员对3种方法的评分是否存在差异,对对应的评分两两进行单边成对样本t检验(one tailed pairedt-test),P<0.0005可认为具有显著差异。
结 果
1.ICH影像学表现
根据多回波SWI图像,89例中有69例检出ICH,单发或多发的斑点状、团片状SWI及T2*WI极低信号或极低信号为主病灶,边界清晰;4例基底节区铁质沉积,双侧基底节区对称性斑片状SWI及T2*WI上呈极低信号为主病灶;5例检出脉络丛钙化,在SWI图像上呈团片状极低信号,在相位图上以高信号为主,在T2*WI上呈极低信号为主;1例脑肿瘤性病变未见出血,在各序列上均见等信号为主团块影,未见异常低信号;10例SWI图像正常,未见明确病灶。
2.图像对比分析
图1中显示和比较了3种算法得到的T2*定量图及对应信噪比图像。观察图像的脑组织对比度,3种方法得到的结果整体上而言是比较相近的。
图2显示的是MDI方法分别与线性拟合(图2a)和指数拟合(图2b)得到基于所有脑组织体素的T2*数值分布图。可以看到,MDI与线性拟合得到的T2*数值相近,单边成对t-test的P值为0.21,无显著差异。相对而言,指数拟合的T2*数值偏高,且与MDI及线性拟合得到的数值有显著差异(P<0.0005)。选取典型的灰质、白质ROI提取T2*数值(表1),与文献中的进行比较[12],可得MDI和线性拟合的T2*值与文献报告相近,而指数拟合则相对合理数值偏高。

表1 典型ROI区域不同拟合模型的T2*数值 (ms)
3.图像临床评分统计分析
对利用MDI、线性拟合以及指数拟合计算得到的T2*定量图的临床评分显示在表2中。表3显示了对不同方法的评分的pairedt-test结果,除了评分员1在线性拟合与指数拟合之间的病灶检测敏感度评分无显著差异之外(P=0.5),其他所有结果组合的均获得统计显著差异(P<0.005)的结果。
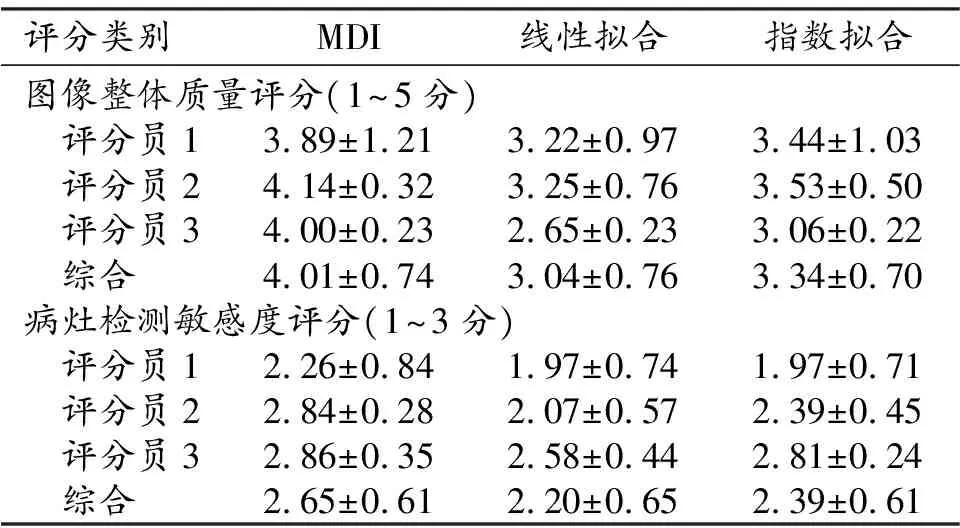
表2 T2*定量图临床评分统计表
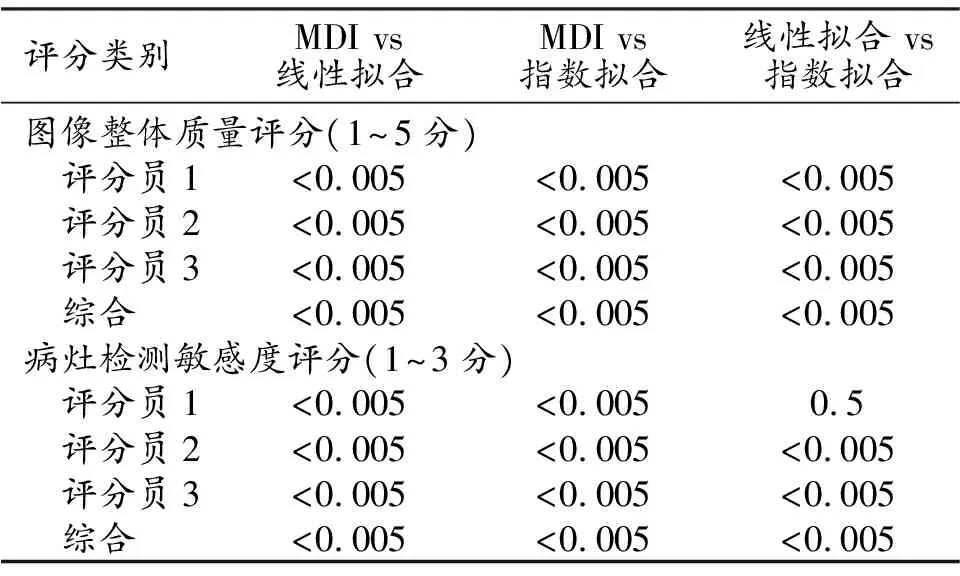
表3 T2*定量图临床评分在拟合模型之间paired t-test结果
讨 论
由于具有较强的顺磁性质,ICH可以显著影响其所在位置及附近的磁场分布,造成局部T2*弛豫时间的缩短。因此早期磁共振成像技术利用T2*WI序列对ICH进行检测。Haacke等[1]于2004年提出了SWI技术,结合磁共振信号幅值与相位中分别与磁化率相关的信息,从而提供了更强的磁化率信号对比度。由于ICH同时也影响局部的磁共振信号相位的变化,因此使用SWI可以非常灵敏地对包括小于单个体素尺寸的各种出血灶进行检测。
然而SWI是一种信号加权图像,并不能支持对病灶区域磁化率特性的定量分析。而不同阶段的ICH,其SWI图像对比度取决于出血时相。如当处于出血超急性(24h内)期、急性期(72h内)、亚急性期(3天~2周)及慢性期(>2周)内,出血灶中的铁元素的存在形式将经历从含氧血红蛋白、脱氧血红蛋白、高铁血红蛋白到含铁血黄素等一系列转变,并表现出不同的磁化率特性,从而导致SWI图像对比度随着出血时相变化,降低对出血时相的判断可靠性。另一方面,T2*-mapping作为一种快速、相对可靠的定量成像方法,可从量化角度来对出血时相或者铁元素沉积水平进行更准确的诊断。
迄今为止,T2*的定量方式是通过多回波序列进行数据采集后,通过曲线拟合算法计算得到弛豫系数R2*(即前述公式中的a),最后通过公式T2*=1/R2*得到T2*数值。由于热噪声与生理噪声的存在,以及ICH或者富铁组织的信号往往较低等因素,当使用信号拟合方法(根据线性或者指数模型)时,拟合得到的R2*的误差将会被放大到其倒数的T2*数值上。因此不仅降低T2*定量图的信噪比,还会降低其准确度,甚至造成局部数值突变,次现象在线性拟合结果中尤为明显。研究人员提出了多种改善T2*定量中局部数值突变的方案[13,14],但并没有从根本上解决此类问题。
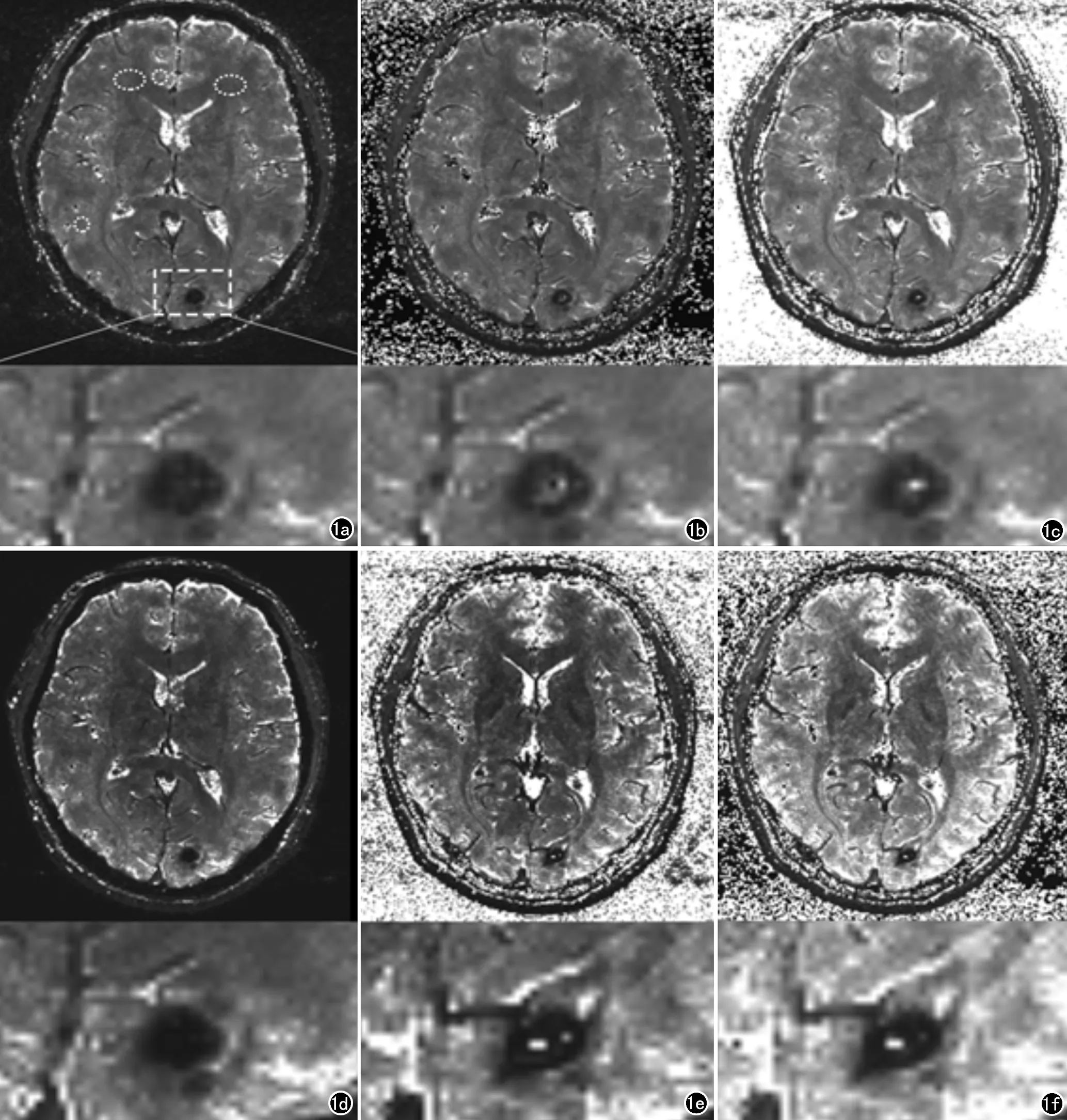
图1患者,男,28岁,阵发性头晕1个月入院。MRI头颅平扫疑脑出血,SWI诊断脑血管畸形伴出血。a) MDI方法得到的T2*定量图的整体与病灶局部放大图像,典型灰质、白质ROI(圈); b) 线性拟合的T2*定量图; c) 指数拟合的T2*定量图; d) MDI的噪声传播图像; e) 线性拟合的噪声传播图像; f) 指数拟合的噪声传播图像。
最近Ye等[11]提出的一种新式的基于MDI技术的T2*定量计算方法,其原理是通过回波间隔之间的复数信号变化直接提取T2*信号,因此不需要指定多点信号的衰减模型。MDI技术免除了多通道信号结合的计算步骤(如非优化信噪比的SOS算法),避免了由于这一步所带来的计算误差与信噪比损失,使得T2*定量的准确度与噪声控制效果达到最优化。

图2单个患者的所有脑组织体素T2*数值散点图。a) MDI vs.线性拟合; b) MDI vs.指数拟合; c) 线性拟合vs.指数拟合。虚线为等斜率参考线,当像素T2*值分布在该参考线附近时认为其数值在相应的两种方法中相似。
对比3种算法得到的T2*整体图像质量,主要差异体现在两个方面,即算法对噪声的传播方式与定量准确性。
从物理角度看,背景噪声并不具备任何弛豫特性,因此套用任何弛豫模型得到的数值本身是无意义的。MDI对背景噪声的T2*的处理是将其转换为极低的数值,因此可以明显地与正常组织区分开来。而基于拟合的模型则是表达为数值极高、差异也极高的结果,从而影响T2*定量图整体质量。对于本研究所用的以及一般的多回波SWI成像序列,短TR的使用造成了脑脊液由于T1加权效应而呈低信号,同时脑脊液和血液由于流动效应导致信号在不同回波之间产生扰动,因此脑脊液和血液信号在结果中将表现出类似背景噪声的扰动,造成图像中局部的黑点与亮点,使得基于ROI的数值分析不可靠。同样的,对于具有较多的含铁血黄素的出血灶,其极短的T2*将造成出血灶内部信噪比过低,也会导致错误的T2*数值。该现象在线性拟合结果中最为明显。然而对于MDI算法,噪声以低T2*数值形式传播意味着在最终的T2*定量图中可以获得更高的信噪比。因此MDI可保证任意信噪比条件下均可获得更接近真实数值的结果,且临床评估结果也证明了其T2*定量图质量显著高于两种拟合方法。
从定量角度分析,MDI与线性拟合得到的T2*值在统计上无显著差异,而指数拟合相对MDI和线性拟合的结果呈统计显著的偏高趋势。选取典型的灰质、白质ROI提取T2*数值,与文献中的进行比较[12, 15],可得MDI和线性拟合的T2*值与文献报告相近,而指数拟合则相对合理数值偏高。因此,3种方法中MDI和线性拟合的定量准确性是符合预期的。
另外,在使用相同的计算机硬件条件下,单层数据(448×380矩阵)在3种方法的平均计算时间为7×10-3s(MDI)、7×10-2s(线性拟合)及65s(指数拟合)。MDI计算时间几乎可以忽略,属于超高效率算法。
本研究的不足之处在于所搜集的ICH病例并非来自单一病种,不同病理的出血特征差异较大。但即便如此,结果表明使用T2*对各类ICH进行检测具有较大的普适性。因此我们认为本研究的结果与结论依然具有较好的代表性。
综上所述,在所比较的3种T2*定量算法当中,MDI是唯一既保证定量准确又可获得最优的信噪比的方法,并且具有极高的计算效率。相比之下,线性拟合方法定量准确但组织信噪比过低,指数拟合方法组织信噪比较好但定量数值整体偏高。且两种拟合方法在噪声区域得到的是极高T2*数值,严重影响图像的诊断价值。因此MDI技术作为一种新型的T2*定量计算方案,可以为临床ICH诊断提供更准确、更可靠的信息,有利于提高相关诊断的准确性与改善治疗与预后评估。
