1 273 K条件下铈铁砷的交互作用研究
2019-10-23杨云胜李玉莲付成辉罗锦校张金柱
杨云胜,黄 润,李玉莲,付成辉,罗锦校,张金柱*
(1.贵州大学 材料与冶金学院,贵州 贵阳 550025; 2.贵州大学 贵州省冶金工程与过程节能重点实验室,贵州 贵阳 550025)
稀土资源在我国具有储存量第一、产出量第一、销售量第一、消费量第一等特点,其在各种传统材料行业及新兴的高科技产业运用都非常广泛[1]。砷则是钢中的杂质元素,危害钢的多种性能[2]。如何将具有原子半径大、化学活性强、4 f屏蔽作用等特点的稀土铈与钢中低熔点杂质砷相结合,去除钢中砷的危害,同时将其转变为更有价值的化合物是目前行业发展的一个重要方向,也是发挥资源优势的一个重要举措。
关于铈铁与铁砷二元化合物研究较多并有相应的相图报道[3],其研究表明铁与砷可生成生成四种化合物,分别为Fe2As、Fe3As2、FeAs及FeAs2;铁与铈可以生成两种化合物,分别为Ce2Fe17和CeFe2;但是对于铈和砷的研究,未见相图的报道,只有CeAs、CeAs2和Ce4As3三种化合物及其晶体结构分析[4]。随着研究的深入,开始提出三元稀土铁砷化合物[5],特别是自2008年报道的稀土型铁基砷化超导化合物LaFeAs(O,F)[6]以来,现已发展成一个体系REFeAs(O,F)(RE为稀土元素)的超导化合物研究[7],其现在所报道的稀土铁砷化合物的超导转变温度Tc已经从最开始的26 K提升至50 K[8],证明研究铈铁砷的交互作用及其形成的产物具有非常重要的意义。
制备掺杂型稀土铁基砷化物超导材料的一个重要步骤是先制备纯的稀土铁砷化合物,目前RE-Fe-As三元系生成物主要有REFeAs(RE=La-Nd)[9]、REFe4As12(Re=La-Pr)[5,10]、Re12Fe57.5As41(Re=La-Ce)[11],前两类三元系生成物均是先在一定的温度下密封进行反应制备稀土砷化物,然后再将得到的实验产物与铁粉和砷混合升温至一定温度并保温一定时间使其反应而得到三元稀土铁砷化合物,第三类的制备为将块状稀土与铁粉和砷按摩尔比为1∶5∶3的比例在6倍质量的锡作溶剂情况下混合后逐步升温至1 173K并恒温4天,冷却至室温可得Pmmn型的RE-Fe-As三元化合物RE12Fe57.5As41。三类RE-Fe-As化合物的制备过程或是先使之形成二元砷化物再混合进行真空密封加热保温生成三元化合物,或是需要用到真空封管机及一定的溶剂,从而导致其过程繁琐、价格昂贵。
此外,由于砷的容易形成强毒性物质,故对其化合物的热力学研究较少,本文首先通过Miedema与离子熵模型计算了二元化合物Fe2As的生成热、生成熵,随后按理想固溶体模型计算了三元化合物的可能性,最后采用螺纹密封技术将稀土铈和砷按铈砷原子比为1∶3封入自制H08钢缸体中,研究1273 K条件下恒温30 h时稀土铈与铁和砷的交互作用及其产物。
1 实验
1.1 理论计算
由于铁砷化合物及铈铁砷三元化合物的热力学计算缺乏,故采用经典Miedema生成热模型与离子熵模型计算二元化合物Fe2As的生成热、生成熵,在理想固溶体条件下判断生成三元化合物的可能性,为实验提供相应理论指导。
1.2 实验装置及参数
本实验采用管式炉加热,其主要装置核心为SRJK-2-9控制的管式电阻炉,整个系统的装置示意图如图1所示,可以分为高纯氩气系统(1、2、3和4)、温度控制系统(5和6)与尾气处理与防倒吸系统(8和9),7为实验试样。实验所采用的H08钢缸体其化学成分(质量分数,%)为:0.35 Mn、0.03 Si、0.082 C、0.016 P、0.014 S和99.3 Fe。按表1所示的配比制备试样,然后将试样放置管式炉中,从室温采用2 h迅速升温至773 K,之后按10 K/10 min升温至923 K,10 K/20 min升温至983 K,10 K/30 min升温至1023 K,10 K/1 h升温至1073 K,10 K/2 h升温至1123 K,10 K/5 h升温至1173 K,10 K/6 h升温至1223 K,10 K/7 h升温至1273 K,在1273 K恒温30 h,结束后关闭电源随炉冷却至室温后停止通入保护气体得到所需实验试样。
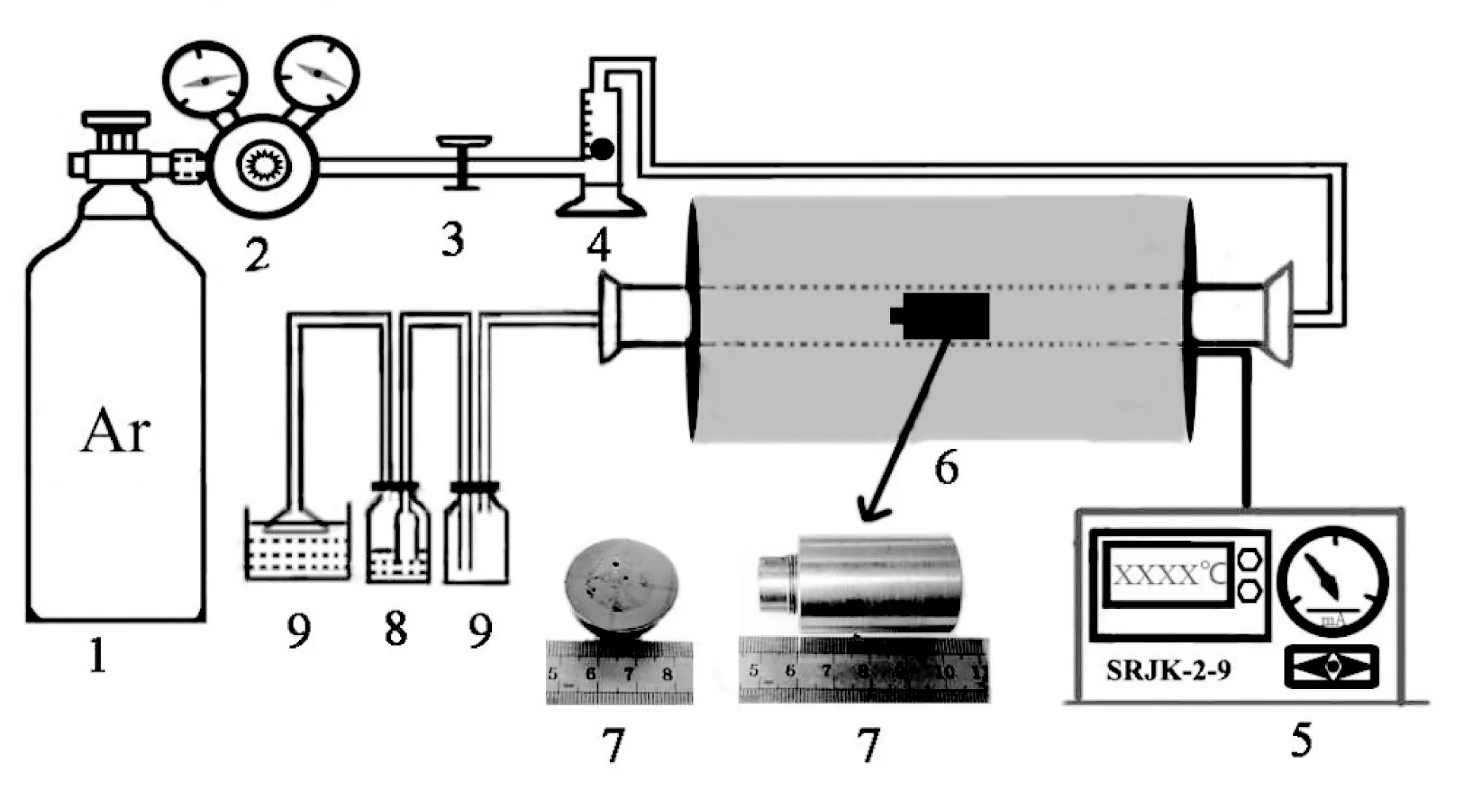
1.高纯氩气瓶;2.气压表;3.阀门;4.气体流量计;5.SRJK-2-9精密电炉温控仪;6.管式炉;7.实验试样;8.尾气处理装置;9.防倒吸装置。
图1 加热装置示意图
Fig.1 The figure of heating device installing

表1 实验参数Tab.1 The sample parameters
2 结果与讨论
2.1 热力学计算
对于于铈砷化合物的研究,李文超[12]在1983年时根据已知的数据计算出了CeAs反应产物的标准生成吉布斯自由能,并用实验验证了这一结果。对于其铈砷化合物的合成认为是:
0.5As2(g)+Ce(l)=CeAs(s)
(1)
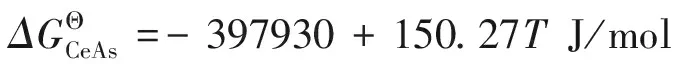
由二元铈砷与铁砷化合物到三元铈铁砷化合物的生成过程,可能是依据下面的方式合成:
12CeAs(s)+29Fe2As(s)=Ce12Fe58As41(s)
(2)
故在此只需要计算Fe2As的相关热力学参数,就可对三元化合物的自由能进行相应的计算,采用Miedema生成热模型[13]计算Fe2As的生成热,其所涉及的模型参数如表2所示。
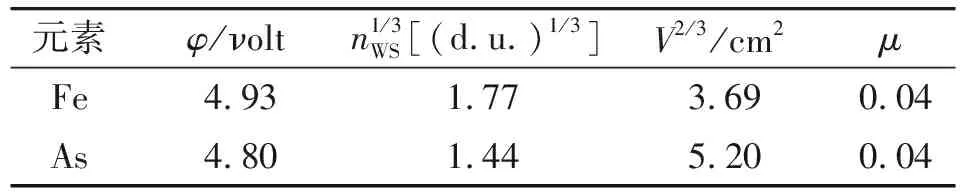
表2 铁和砷元素的Miedema模型参数[13-14]Tab.2 The Miedema model parameters ofiron and arsenic
其Miedema生成热模型的计算式为:
(3)
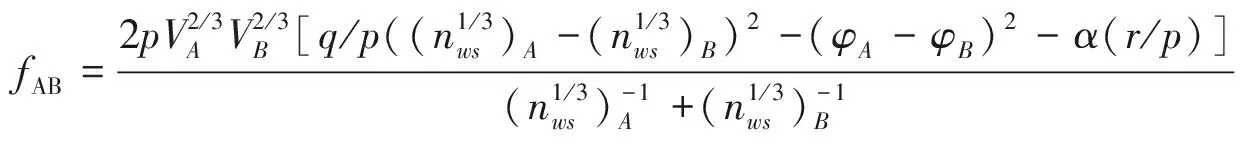
对于Fe-As系所形成的Fe2As化合物,其为过渡族元素或贵金属+其它元素,因此p=12.3,r/p=α×β=1.0×2.3=2.3;先求出铁和砷的摩尔分数χ,对组元中铁砷的体积参数V进行修正,再分别计算出铈和砷的表面摩尔浓度χS,最后将所得数值代入Miedema生成热模型计算出Fe2As的生成热为ΔHFe2As=-37 282.63 J/mol。
对于Fe2As的生成熵,由卡普金斯基(A.φ.KanyCTUHCKUN)单一气体离子熵与晶体离子熵计算,其计算式为[15]:
(4)
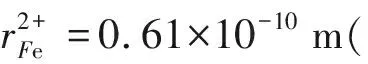
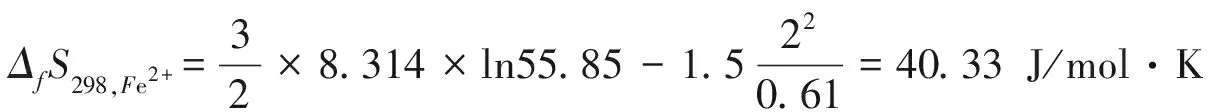
同理可得不同价态下铁离子的熵值,即ΔfS298,Fe2+=42.47 J/mol·K(+2价高自旋);ΔfS298,Fe3+=25.62 J/mol·K(+3价低自旋);ΔfS298,Fe3+=29.24 J/mol·K(+3价高自旋);砷离子的熵值为ΔfS298,As3-=47.75 J/mol·K。
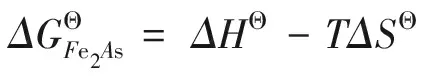
(5)
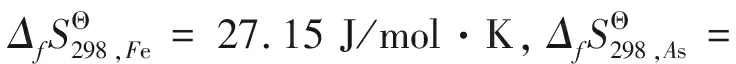
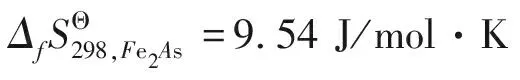
若二元化合物CeAs与Fe2As形成铈铁砷三元化合物时满足理想固溶体的条件[16],即ΔH=0 J/mol,取xCeAs=12/41、xFe2As=29/41,则反应的吉布斯自由能为:
ΔmixGΘ=-RT(xCeAslnxCeAs+xFe2AslnxFe2As)
(6)
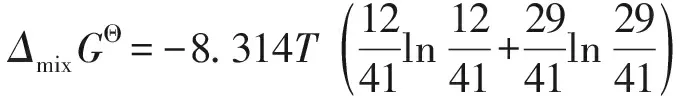
=-4.53TJ/mol,故对于生成三元系化合物的吉布斯自由能有:
(7)
将以上数据带入可得ΔG=-435 212.63-157.21TJ/mol,当温度指定为1 273 K时其可计算得ΔG﹤0,证明温度为1 273 K铈,二元CeAs与Fe2As化合物具有转变为三元铈铁砷化合物的可能性。
2.2 实验结果分析
图2为铈砷原子比为1∶3(Ce∶As=1∶3)试样在1273 K条件下恒温30 h所制备的金相试样观察所得结果,图3为该试样的X-射线衍射物相分析所得结果。
由试样金相可以看出,恒温30 h所制备的试样存在浅灰色、灰色和深灰色三种衬度,浅灰色组织呈不均匀的大块状分布于试样之中,灰色组织大量存在于试样中,深灰色组织成小颗粒状分散于试样中。由试样的物相分析可以看出在该条件下制备所得试样的主要产物为二元化合物CeAs和Fe2As以及三元铈铁砷化合物Ce12Fe57.5As41,此外物相中还含有少量的砷与铁单质,可能是因为砷的过量加入及铁原子进入缸体中尚未充分反应所造成。
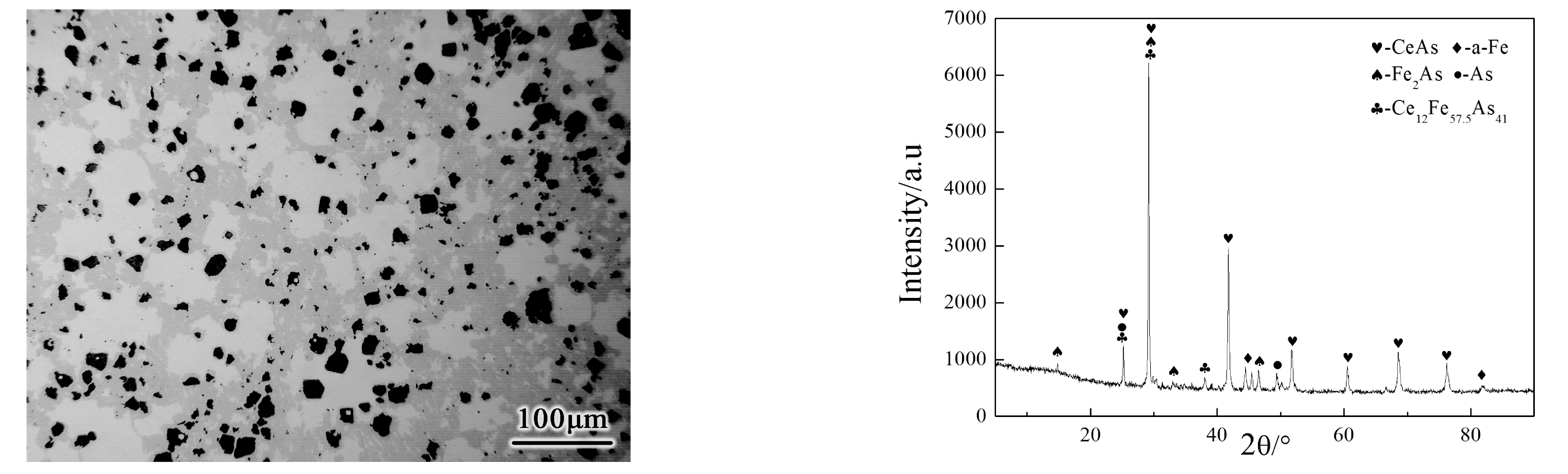
图2 试样的金相 图3 试样的物相 Fig.2 The metallographic of sample Fig.3 The phase of the sample

图4 试样的背散射电子像 图5 试样的面扫描 Fig.4 The BSE of sample Fig. 5 The surface scanning of sample
图4为铈砷原子比为1∶3(Ce∶As=1∶3)在恒温温度为1 273 K条件下恒温时间为30 h时的背散射电子像,从图上可以看出在该条件下试样的微观衬度呈现浅灰色、灰色、深灰色、暗灰色4种不同衬度的相组织,使用大写字母A、B、C和D分别进行标注。为了分析不同衬度组织的成分,对该微区的不同衬度标注点进行EDS能谱分析,所得的各个元素的原子百分含量如表3所示。
由表3对标记点的EDS能谱分析可知,浅灰色衬度组织的主要组成元素为Ce和As,灰色衬度组织的主要组成元素为Fe和As,深灰色衬度组织的主要组成元素为Fe,暗灰色衬度组织的主要组成元素为Ce、Fe和As。结合已经报道的几种铈砷化合物、铈铁与铁砷二元相图以及前面对该试样的物相分析可知,其对应的浅灰色组织主要为二元化合物CeAs,灰色衬度组织主要为二元化合物Fe2As,深灰色衬度组织的主要为单质Fe,暗灰色衬度组织的主要为三元铈铁砷化合物Ce12Fe57.5As41。
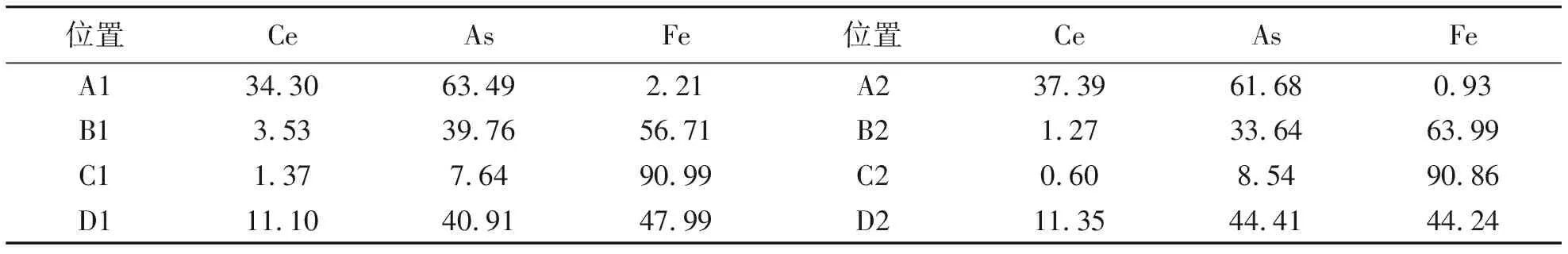
表3 试样的EDS结果分析Tab.3 The EDS analysis result of simple %
为对1 273 K条件下稀土铈与铁和砷的交互作用进一步研究,对铈砷原子比为1∶3在该温度条件下恒温时间为30 h的试样采用面扫描分析如图5所示,由面谱图可以看出,铈砷原子比为1∶3试样在1 273 K条件下保温30 h时,铁元素(深灰色衬度)在试样中分布较为均匀,与稀土铈元素基本不生成化合物;铈元素主要存在的区域(浅灰色衬度)在试样中呈现块状分布,与砷元素的区域相重合,证明在该温度下可形成一定的化合物,与铁元素存在的区域只有少部分重合,由上面的分析及结合面扫分层图可以看出铈铁在此温度下除了能与砷生成一定的三元化合物外基本不互存。
砷元素(灰色衬度)的熔点为1 090 K,而且在888 K时开始升华,所以在试样中分布相对均匀,此外砷与铁和铈元素均互溶,可形成相应的化合物,结合金相分析、物相分析、EDS能谱分析及背散射电子分析可知在该实验条件下其容易生成为CeAs、Fe2As以及一定的三元化合物Ce12Fe57.5As41且三元化合物在二元系化合物的交界处生成,故二元化合物CeAs和Fe2As是三元化合物Ce12Fe57.5As41形成的基础。
3 结论

(2)若Fe2As和CeAs形成三元化合物Ce12Fe57.5As41时满足理想固溶体条件,则其吉布斯自由能为:ΔG=-435 212.63-157.21TJ/mol(Fe为+3价,低自旋离子半径);
(3)在温度为1 273 K条件下,当铈砷原子比为1∶3(Ce∶As=1∶3)且恒温时间为30 h时,二元化合物CeAs和Fe2As及三元化合物Ce12Fe57.5As41是稀土铈与铁和砷交互作用的主要产物且二元化合物CeAs和Fe2As是三元化合物Ce12Fe57.5As41形成的基础。
