西太平洋添加营养盐培养实验中挥发性卤代烃含量动态变化
2019-10-23刘珊珊杨桂朋高旭旭
刘珊珊,杨桂朋,2,高旭旭,魏 英,何 真*
西太平洋添加营养盐培养实验中挥发性卤代烃含量动态变化
刘珊珊1,杨桂朋1,2,高旭旭1,魏 英1,何 真1*
(1.中国海洋大学化学化工学院,海洋化学理论与工程技术教育部重点实验室,青岛 266100;2.海洋国家实验室海洋生态与环境科学功能实验室,山东 青岛 2696071)
于2018年10月9日~11月1日采集西太平洋表层海水,通过营养盐添加船基培养实验,研究了不同营养盐条件下浮游植物的生长及其释放挥发性卤代烃(VHCs)含量的动态变化规律.结果表明,与对照组相比,氮磷营养盐的添加对叶绿素a(Chl-)的含量和三氯乙烯(C2HCl3),四氯乙烯(C2Cl4),一氯二溴甲烷(CHBr2Cl),三溴甲烷(CHBr3)的释放量表现出显著促进作用,但促进程度与添加氮磷营养盐的浓度及比值密切相关.高浓度氮更有利于浮游植物的生长及C2HCl3和C2Cl4的释放.N/P比符合Redfield比值更有利于CHBr2Cl和CHBr3的释放.相比NO3--N,NH4+-N的添加更有利于4种VHCs释放.
挥发性卤代烃;培养实验;营养盐;浮游植物;西太平洋
海洋是全球卤素的主要储库,其中挥发性卤代烃(VHCs)是海洋中卤素的重要载体[1].海水中广泛存在的三氯乙烯(C2HCl3)、四氯乙烯(C2Cl4)、一氯二溴甲烷(CHBr2Cl)和三溴甲烷(CHBr3)等VHCs能够通过海-气交换进入大气.在大气中VHCs发生光化学降解,释放出卤素自由基,进而催化破坏大气平流层的臭氧,直接造成臭氧减少[2].据文献报道,溴自由基对臭氧的破坏程度远大于氯,约为氯的50~100倍[2].研究发现CHBr3为平流层贡献约(0.5~1.8)pptv溴自由基,占总溴代烃贡献溴自由基的10%~35%左右(溴代烃能够每年向平流层提供约5.0~5.2pptv的溴自由基)[3].同时大气中VHCs参与多种大气化学反应,改变着其他温室气体的大气浓度.VHCs还与其他温室气体(如CO2、CH4、N2O)一样,可以通过吸收红外光辐射能而产生温室效应,直接影响全球气候[4].
海洋中VHCs的天然来源主要是海洋生物生产释放.大型海藻(红藻、褐藻和绿藻)[5]、浮游植物[6-11]、海草[12]、珊瑚和被囊动物和细菌[13]释放是海洋中VHCs重要的生物来源.现有研究表明,微藻(浮游植物)对海洋中VHCs的贡献可能要高于大型海藻[14].文献报道浮游植物能够生产释放多卤代烃如三氯乙烯(C2HCl3)、四氯乙烯(C2Cl4)、一氯二溴甲烷(CHBr2Cl)、二溴甲烷(CH2Br2)和三溴甲烷(CHBr3)[7].VHCs被认为是浮游生物次级代谢的产物,但浮游植物产生VHCs的机制仍不明确[7].有证据表明海藻产生的卤过氧化酶(氯、溴和碘过氧化酶),通过催化X-离子先被H2O2氧化成次卤酸(HOX),之后次卤酸(HOX)分解出的X+再与浮游植物在光合作用过程中合成的溶解有机物反应,生成多种VHCs[15-16].
营养盐浓度会对浮游植物初级产物产生较大的影响,特别是在寡营养的地区[17].通常认为丰富的营养盐能增加浮游植物的生物量,但这是否会导致其代谢过程的改变,特别是硝酸盐与磷酸盐的结构与平衡的变化是否影响浮游植物产生释放VHCs尚且不清楚.Smythe-Wright等[18]研究发现,浮游植物优势种和浮游植物生物量显著影响了VHCs浓度的变化,而且NO3--N,PO43--P和NH4+-N等环境参数主要通过影响藻类生长而间接影响VHCs的含量.同时,Smythe-Wright等[19]也通过大量实验室培养实验,已经证明了浮游植物释放VHCs含量受周围硝酸盐条件变化的影响.随着大气中氮向开阔海洋输入的增加,西太平洋海域及其它开阔大洋中VHCs的含量将产生怎样动态变化目前还没有文献报道.营养盐输入量的增加能否对开阔大洋中浮游植物生产和释放VHCs产生影响尚且不清楚?因此,本论文采集了西太平洋表层海水进行船基连续培养实验,选择了4种较为典型VHCs(C2HCl3,C2Cl4,CHBr2Cl和CHBr3)作为研究对象,研究了不同营养盐浓度及比例对浮游植物生长及其释放4种VHCs含量动态变化的影响,分析影响西太平洋水体中VHCs生产过程中的主要营养元素,探究氮磷平衡对开阔大洋VHCs含量的影响,此研究有助于了解全球开阔大洋海域大气中氮输入引起的VHCs浓度变化的生物地球化学行为及其对大气环境的影响.
1 材料和方法
1.1 船基围隔培养实验设计
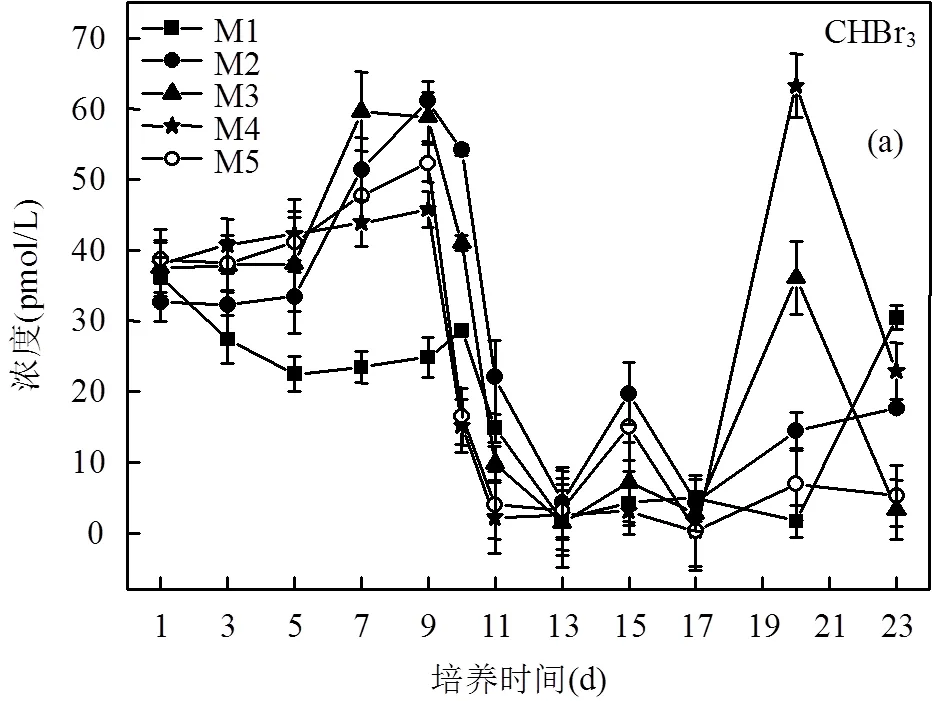
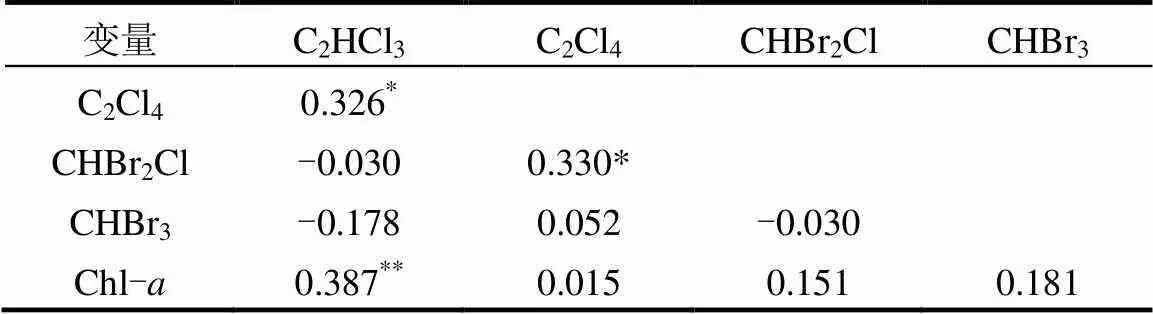
船基围隔培养实验于2018年10月9日~11月1日(共计23d)在“科学号”海洋综合调查船上完成,由12L Niskin采水器(安装于Seabird 911plus CTD上)采集E130-4站位(23°29.27’N, 129°59.88’E)表层海水(0~5m)进行培养.该采水站位的海水温度和盐度分别为27.4℃和34.5‰,营养盐浓度NO3--N为2.94μmol/L, PO43--P为0.08μmol/L, NO2--N为0.07μmol/L, NH4+-N为 表1 船基培养实验中营养盐初始浓度(μmol/L) 注:LOD为检出限. 浮游植物的生长周期通常为30d.VHCs通常会在浮游植物对数生长期(培养周期的第10d左右)出现峰值[6-11].同时由于航次时间的限制,培养周期设置为23d.培养实验中VHCs样品取样为隔天1次,到藻的指数生长期为每天取样1次,采样时间为上午09:00.用气密性硬质玻璃注射器取120mL水样注入棕色细口瓶避光密封4℃冷藏储存,6h内测完.采集的样品被转移至吹扫-捕集装置中的气提室内,用流速为60mL/min高纯氮气吹扫14min,同时用液氮(-176℃)冷阱捕集.捕集完毕后,用沸水加热解吸4min,把待测物导入连接电子捕获检测器(ECD)的气相色谱仪(Agilent 6890N)进行分析测定.利用外标法进行定量分析,方法的相对标准偏差为2.67%~ 3.21%.具体方法参照文献[20]. 营养盐现场用GF/F玻璃纤维滤膜(使用前450℃灼烧5h)过滤后用聚乙烯瓶贮存,-20℃冷冻保存,带回陆地实验室用营养盐自动分析仪(Seal Analytical AA3)测定,具体测定方法参照文献[21]. Chl-样品使用孔径为0.7µm Whatman GF/F玻璃纤维滤膜(直径47mm)过滤300mL海水样品.过滤完成后,将过滤膜对折,并用铝箔纸包好放入-20℃冷冻保存.回到陆地实验室后,Chl-的测定采用Parsons等[22]报道的荧光法测定,即在低温避光环境下用10mL 90%的丙酮溶液萃取样品滤膜24h左右,在4000r/min转速下离心10min,取上清液使用F-4500荧光仪(激发波长436nm,发射波长670nm)进行测定.利用外标法进行定量分析,该方法的检测限为0.01µg/L. 2.1.1 营养盐浓度的变化特征 船基培养过程中NO3--N、NH4+-N、PO43--P和NO2--N的含量变化曲线如图1所示. M2和M4桶中的NO3--N浓度前9d消耗速率较快,随后NO3--N消耗速率减缓.M3桶的NO3--N初始浓度最高, NO3--N的消耗速率最大(图1a),因此额外增加NO3--N的量可以提高浮游植物对NO3--N的吸收速率.M5桶中NO3--N的消耗速率最小,这可能是因为M5桶中加入的NH4+-N对NO3--N的吸收具有抑制作用,宋姣姣等[23]在营养盐和铁对二甲亚砜含量动态变化的影响围隔实验中也观测到类似的结果,这也与Dortch[24]的研究结果是一致的,即当NH4+-N和NO3--N同时出现在介质中时, NH4+-N对NO3--N的吸收具有抑制作用.此外,相比于M5号桶内的NH4+-N浓度在前7d持续降低,第9d几乎消耗完全.其它培养桶内NH4+-N无变化(图1b).侯继灵[25]在探究不同氮源和铁对浮游植物生长影响的围隔实验研究中指出当NH4+-N和NO3--N同时出现在介质中时,浮游植物优先吸收NH4+-N.由此推测M5培养桶内加入了一定量的NH4+-N,使得M5培养桶内藻类优先的快速繁殖及Chl-浓度的迅速提升,而NH4+-N浓度急剧下降. M1(对照组); M2(N/P=16:1); M3(N/P=32:1); M4(N/P=25:1); M5(约有90%的氮以NH4+-N的形式存在) 5组培养桶内磷酸盐浓度变化趋势一致,磷酸盐浓度持续减少到第11d降到最低值,实验结束时,所有培养桶内的磷酸盐几乎都被消耗尽; PO43--P初始浓度越高消耗速率越大(图1d)所示,表明额外增加PO43--P的量可以提高浮游植物对PO43--P的吸收速率.高生泉等[26]在中国黄海围隔实验的研究结果也证明了这点.本次培养实验并没有额外加入亚硝酸盐,由图1(c)所示,各个培养桶中亚硝酸盐的浓度变化无规律可循. 2.1.2 不同培养桶中浮游植物生物量(Chl-)的变化特征 Chl-是浮游植物生物量的重要指标,其浓度可代表浮游植物种群密度的大小.船基培养过程中浮游植物生物量的变化用Chl-的浓度变化描述.培养桶中Chl-含量变化曲线如图2所示.从图2看出,实验组(添加营养盐的培养桶)培养桶中Chl-的浓度均明显大于对照组,表现为M3>M5>M2> M4>M1.实验组及对照组在第9d,第13d及第20d前后分别出现三次生物量峰值.其中对照培养桶M1Chl-的最大值出现在第7d;M2、M3及M5中Chl-的最大值都出现在第9d, M4中Chl-的最大值出现在第10d.此外,营养盐含量与结构对培养桶中的生物量(Chl-)影响程度不同.表现为NO3--N添加量最多的培养体系Chl-水平最高,相比NO3--N, NH4+-N更有利于浮游植物吸收从而表现出较高的Chl-水平. 图2 船基培养实验中Chl-a浓度(μg/L)的变化 硝酸盐加入量为M4(N/P为25:1)>M2(N/P为16:1),然而实验室结果发现M2和M4培养桶内Chl-的水平表现为M2>M4(图2),VHCs生产量表现为M2>M4培养桶(图5).这些结果表明VHCs的释放量受营养盐结构的影响.这一结论与Smythe- Wright等[18]的报道一致.推测营养盐的结构可以影响浮游植物的生长,符合Redfield比值营养结构有助于浮游植物生长[39],从而促进M2培养桶内释放更多的VHCs[18].同时M2 ■: M1(对照组);●: M2(N/P=16:1);▲: M3(N/P=32:1);★: M4(N/P=25:1);○: M5(约有90%的氮以NH4+-N的形式存在) Duce等[43]提出由于人为活动和气候变化,2003年至2030年大气中氮向开阔海洋的输入可能增加四倍,虽然大气中氮沉积增加对开阔海洋表层水氮浓度的总体影响很低,估计最大值为~45nm[44],但最重要的影响将是氮磷平衡的变化,特别是在没有明显大气磷酸盐沉积的情况下.海水氮磷平衡将影响浮游植物的生长及开阔大洋生产释放VHCs的量[18],进而可能影响全球大气环境.由上文,我们发现添加营养盐(以M3培养桶为例)比不添加营养盐的培养桶(M1培养桶)中的C2HCl3,C2Cl4, CHBr2Cl和CHBr3释放量分别大约增加了6,5,3和6.5倍.这说明营养盐输入可能会影响西太平洋海域乃至整个开阔大洋中海水对海洋大气中VHCs的贡献,进而加大对臭氧层的破坏.同时我们也从以上研究发现海水中氮磷平衡能够影响VHCs的释放量.但大气中氮向开阔大洋输入的增加,对海洋大气环境产生的影响需要我们进一步探讨. 图5 船基培养实验中C2HCl3,C2Cl4,CHBr2Cl和CHBr3累积浓度(pmol/L)的对比 表2 船基培养实验中VHCs和Chl-a浓度的相关性 注:*.在0.05水平(双侧)上显著相关;**.在0.01水平(双侧)上显著相关. 3.1 船基培养过程中,培养体系的营养盐消耗速率随着营养盐浓度降低而降低,额外增加营养盐的量可以提高浮游植物对营养盐的吸收速率.此外,当NH4+-N和NO3--N同时出现在介质中时, NH4+-N对NO3--N的吸收具有抑制作用.营养盐含量与结构对培养桶中的生物量(Chl-)影响程度不同.表现为NO3--N添加量最多的培养体系Chl-水平最高,说明高浓度氮更有利于浮游植物的生长;相比NO3--N,较少NH4+-N添加就能造成的培养体系Chl-水平同种程度的增高,这说明NH4+-N可能更利于浮游植物吸收. 3.2 营养盐的含量主要通过影响浮游植物生长而间接影响其生产释放VHCs,主要表现为营养盐加入明显促进秋季西太平洋水体中浮游植物的生长,进而对4种VHCs的产生具有明显的促进作用.高浓度NO3--N更有利于C2HCl3和C2Cl4的释放. 3.3 营养盐结构对藻类释放不同种类VHCs的影响程度不同, N/P比符合Redfield比值更有利于CHBr2Cl和CHBr3的释放.此外,相比NO3--N,添加NH4+-N更有利于VHCs的产生.总体上培养体系中不同的营养盐结构及浓度对不同种类浮游植物生长及其释放VHCs量的促进程度不同. 3.4 船基培养结果显示,海水中VHCs和Chl-的变化趋势基本相似,均出现3次峰值,且时间上略微滞后,进一步表明VHCs来源于浮游植物的生成释放.VHCs的产生量受营养盐的含量与结构影响较为显著,由此初步推测随着大气中氮向开阔海洋输入的增加,营养盐输入会影响西太平洋海域乃至整个开阔大洋中海水对海洋大气中VHCs的贡献,进而加大对臭氧层的破坏. [1] Moore R M. Marine Sources of Volatile Organohalogens [J]. Handbook of Environmental Chemistry, 2003,3:85-101. [2] Solomon S, Mills M, Heidt L E, et al. On the evaluation of ozone depletion potentials [J]. Journal of Geophysical Research, 1992,97: 825-842. [3] Liu Y N, Yvon-Lewis S A, Hu L, et al. CHBr3, CH2Br2, and CHBr2Cl in U.S. coastal waters during the Gulf of Mexico and East Coast Carbon cruise [J]. Journal of Geophysical Research Oceans, 2011, 116(C10),doi:10.1029/2010JC006729. [4] Reifenhauser W, Heumann K G. Bromo- and bromochloromethanes in the Antarctic atmosphere and the South Polar Sea [J]. Chemosphere, 1992,24(9):1293-1300. [5] Nightingale P D, Malin G, Liss P S. Production of chloroform and other low molecular-weight halocarbons by some species of macroalgae [J]. Limnology & Oceanography, 1995,40(4):680-689. [6] Scarratt M G, Moore R M. Production of methyl chloride and methyl bromide in laboratory cultures of marine phytoplankton [J]. Marine Chemistry, 1998,54(3):263-272. [7] Abrahamsson K, Ekdahl A, Collén J, et al. Marine algae-a source of trichloroethylene and perchloroethylene [J]. Limnology & Oceanography, 1995,40(7):1321-1326. [8] Lim Y K, Phang S M, Sturges W T, et al. Emission of short-lived halocarbons by three common tropical marine microalgae during batch culture [J]. Journal of Applied Phycology, 2018,(2):1-13. [9] Colomb A, Noureddine Y, Jonathan W, et al. Screening volatile organic compounds (VOCs) emissions from five marine phytoplankton species by head space gas chromatography/mass spectrometry (HS-GC/MS) [J]. Journal of Environmental Monitoring, 2008,10(3):325-330. [10] Carpenter L J, Jones C E, Dunk R M, et al. Air-sea fluxes of biogenic bromine from the tropical and North Atlantic Ocean [J]. Atmospheric Chemistry & Physics, 2009,9(5):1805-1816. [11] Hughes C, Johnson M, Utting R, et al. Microbial control of bromocarbon concentrations in coastal waters of the western Antarctic Peninsula [J]. Marine Chemistry, 2013,151(151):35-46. [12] Manley S L, Dastoor M N. Methyl iodide (CH3I) production by kelp and associated microbes [J]. Marine Biology, 1988,98(4):477-482. [13] Amachi S, Kamagata Y, Kanagawa T, et al. Bacteria mediate methylation of iodine in marine and terrestrial environments [J]. Applied & Environmental Microbiology, 2001,67(6):2718-2722. [14] Platt U, H Nninger G. The role of halogen species in the troposphere [J]. Chemosphere, 2003,52(2):325-338. [15] Moore R M, Webb M, Tokarczyk R, et al. Bromoperoxidase and iodoperoxide enzymes and production of halogenated methanes in marine diatom cultures [J]. Journal of Geophysical Research Oceans, 1996,101(C9):20899-20908. [16] Bart V, Carsten P, Jan G, et al. Daily bursts of biogenic cyanogen bromide (BrCN) control biofilm formation around a marine benthic diatom [J]. Proceedings of the National Academy of Sciences, 2012,109(7):2412-2417. [17] Falkowski P G, Stone D P. Nitrate uptake in marine phytoplankton: Energy sources and the interaction with carbon fixation [J]. Marine Biology, 1975,32(1):77-84. [18] Smythe-Wright D, Peckett C, Boswell S, et al. Controls on the production of organohalogens by phytoplankton: Effect of nitrate concentration and grazing [J]. Journal of Geophysical Research Biogeosciences, 2010,115, G03020,doi:10.1029/2009JG001036. [19] Smythe-Wright D, Boswell S M, Breithaupt P, et al. Methyl iodide production in the ocean: Implications for climate change [J]. Global Biogeochemical Cycles, 2006,20,GB3003,doi:10.1029/2005GB002642. [20] 张颖杰,何 真,杨桂朋.东海海水和大气中挥发性卤代烃的分布 [J]. 中国环境科学, 2018,38(1):14-25.Zhang Y J, He Z, Yang G P. Distribution characteristics of volatile halocarbons in seawater and atmosphere of the East China Sea [J]. China Environmental Science, 2018,38(1):14-25. [21] State Oceanic Administration. Specifications of Oceanographic Survey [M]. Beijing: China Ocean Press, 1991:766. [22] Parsons T R. A manual of chemical and biological methods for seawater analysis [J]. Deep Sea Research Part A Oceanographic Research Papers, 1984,31(12):23-58. [23] 宋姣姣,张洪海,杨桂朋,等.夏季黄海培养实验中营养盐和铁对二甲亚砜(DMSO)含量动态变化的影响 [J]. 海洋湖沼通报, 2014, (4):104-111.Song J J, Yang G P, Zhang H H, et al. Study on the Influence of nutrients and iron on dimethylsulfoxide (DMSO) in mesocosm experiments in the Yellow Sea in summer [J]. Transactions of Oceanology and Limnology, 2014,(4):104-111. [24] Dortch Q. The interaction between ammonium and nitrate uptake in phytoplankton [J]. Marine Ecology Progress, 1990,61:183-201. [25] 侯继灵.不同氮源和铁对浮游植物生长影响的围隔实验研究 [D]. 青岛:中国海洋大学, 2006:2-6. Hou J L, Influence of nitrogen nutrients and iron to the growth of phytoplankton in mesocosm experiments [D]. Qingdao: Ocean University of China, 2006:2-6. [26] 高生泉,林以安,金明明,等.春、秋季东、黄海营养盐的分布变化特征及营养结构 [J]. 海洋学研究, 2004,22(4):38-50. Gao S Q, Lin Y A, Jin M M, et al. Distribution features of nutrients and nutrient structure in the East China Sea and the Yellow Sea in spring and autumn [J]. Donghai Marine Science, 2004,22(4):38-50. [27] Scarratt M. G, Moore R M. Production of methyl chloride and methyl bromide in laboratory cultures of marine phytoplankton [J]. Marine Chemistry, 1998,54(3):263-272. [28] Tokarczyk R, Moore R M. Production of volatile organohalogens by phytoplankton cultures [J]. Geophysical Research Letters, 1994,21(4): 285-288. [29] Hughes C, Johnson M, Utting R, et al. Microbial control of bromocarbon concentrations in coastal waters of the western Antarctic Peninsula [J]. Marine Chemistry. 2013,151(151):35-46. [30] 李冠霖,何 真,杨桂朋,等.秋季东海挥发性卤代烃的分布和海-气通量研究 [J]. 中国环境科学, 2017,37(5):1724-1734. Li G L, He Z, Yang G P, et al. Distribution characteristics and sea to-air fluxes of volatile halocarbons in the East China Sea in autumn [J]. China Environmental Science, 2017,37(5):1724-1734. [31] 宫 健,谢文霞,柴 娜.胶州湾潮滩湿地CHBr3通量特征及影响因素研究 [J]. 中国环境科学, 2018,(7):2699-2705. Gong J, Xie W X, Chai N. CHBr3 fluxes and controlling factors in tidal flat wetland of Jiaozhou Bay [J]. China Environmental Science, 2018,38(7):2699-2705. [32] 齐雨藻,洪 英,吕颂辉,等.南海大鹏湾海洋褐胞藻赤潮及其[J]. 海洋与湖沼, 1994,25(2):132-138.Qi Y Z, Hong Y, Lv S H, et al. Outbreak of chattonella marina red tide and its relations to ecological parameters in Dapeng Bay, South China Sea [J]. Oceanologia et Limnologia Sinica, 1994,25(2):132-138. [33] 朱从举,齐雨藻,郭昌弼.铁、氮、磷、维生素B1和B12对海洋原甲藻的生长效应 [J]. 海洋与湖沼, 1994,25(2):168-172.Zhu C J, Qi Y Z, Guo Z B. The effect of iron, vitamins B1, B12, nitrogen and phosphorus on the growth of prorocentrum micans [J]. Oceanologia et Limnologia Sinica, 1994,25(2):168-172. [34] 秦晓明,邹景忠.N, P, Fe-EDTA, Mn对赤潮生物锥状斯氏藻增殖影响的初步研究 [J]. 海洋与湖沼, 1997,28(6):594-598. Qin X M, Zhou J Z. Study on the effects of N, P, Fe-EDTA, Mn on the growth of a red tide dinoflagellate scrippsiella trochoidea [J]. Oceanologia et Limnologia Sinica, 1997,28(6):594-598. [35] 孙 军,刘东艳,陈宗涛,等.不同氮磷比率对青岛大扁藻、新月柱鞘藻和米氏凯伦藻生长影响及其生存策略研究 [J]. 应用生态学报, 2004,11(15):2122-2126. Sun J, Liu D Y, Chan Z T, et al. Growth of platymonas helgolandicavar. tsingtaoensis, cylindrotheca closterium and karenia mikimotoi and their survival strategies under different N/P ratios [J]. Chinese Journal of Applied Ecology, 2004,11(15):2122-2126. [36] 牟英春,褚 强,张 潮,等.南海浮游植物对沙尘和灰霾添加的响应 [J]. 中国环境科学, 2018,38(9):3512-3523. Mu Y C, Chu Q, Zhang C, et al. Responses of phytoplankton to dust and haze particle additions in the South China Sea [J]. China Environmental Science, 2018,38(9):3512-3523. [37] Flynn K J. Algal carbon-nitrogen metabolism: a biochemical basis for modelling the interactions between nitrate and ammonium uptake [J]. Journal of Plankton Research, 1991,13(2):373-387. [38] 张 诚,邹景忠.尖刺拟菱形藻氮磷吸收动力学以及氮磷限制下的增殖特征 [J]. 海洋与湖沼, 1997,28(6):599-603. Zhang C, Zhou J Z. Nutrient uptake kinetics and growth under nutrient limitation of pseudonizschia [J]. Oceanologia et Limnologia Sinica, 1997,28(6):599-603. [39] Hecky R E, Kilham P. Nurtient limitation of phytoplankton in freshwater and marine environments: A review of recent evidence on the effects of enrichment [J]. Limnology & Oceanography, 1988,4(33): 796-822. [40] 李瑞香,朱明远,陈 尚,等.围隔生态系内浮游植物对富磷的响应 [J]. 生态学报, 2001,21(4):603-607.Li R X, Zhu M Y, Chen S, et al. Responses of phytoplankton on phosphate enrichment in mesocosms [J]. Acta Ecologica Sinica, 2001,21(4):603-607. [41] 窦 勇,唐学玺,杨 震,等.山东近海黄海段营养盐结构对初级生产力的影响研究 [J]. 海洋环境科学, 2011,30(2):177-181. Hou Y, Tang X X, Yang Z, et al. Effect of nutrients structure on primary production in offshore of Shandong Province [J]. Marine Environmental Science, 2011,30(2):177-181. [42] 张昊飞.胶州湾无机营养盐对异养浮游细菌的影响研究 [D]. 青岛:中国海洋大学, 2004:2-13.Zhang H F. Study of the inf1ueneces of inorganic nutrients on heterotrophic bacterioplankton in Jiaozhou Bay [D]. Qingdao: Ocean University of China, 2004:2-13. [43] Duce R A, Laroche J, Altieri K, et al. Impacts of atmospheric anthropogenic nitrogen on the open ocean [J]. Science, 2008,320 (5878):893-897. [44] Michaels A F, Siegel D A, Johnson R J, et al. Episodic inputs of atmospheric nitrogen to the Sargasso Sea: Contributions to new production and phytoplankton blooms [J]. Global Biogeochemical Cycles, 1993,7(2):339-351. Variation of volatile halocarbon concentrations in the incubation experiments with the addition of nutrients in the western Pacific Ocean. LIU Shan-shan1, YANG Gui-peng1,2, GAO Xu-xu1, WEI Ying1, HE Zhen1* (1.Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China;2.Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 2696071, China)., 2019,39(10):4313~4320 Ship-based incubation experiments with the addition of nutrients were conducted with surface seawater of the western Pacific Ocean from October 9thto November 1th, 2018 to study the impact of the addition of nutrients on phytoplankton biomass and the production of volatile halocarbons (VHCs) by marine phytoplankton. The results showed that the addition of nutrients promoted the increase in the concentration of chlorophyll(Chl-) and the emissions of trichloroethane (C2HCl3), tetrachloroethylene (C2Cl4), chlorodibromomethane (CHBr2Cl) and bromoform (CHBr3) by phytoplankton, and the extent of promotion was closely related to the concentrations and ratios of nutrient addition. The maximum Chl-,C2HCl3, and C2Cl4concentrations occurred in the highest concentration of NO3--N. The ratio of N/P in accordance with the Redfield ratio could significantly increase CHBr2Cl and CHBr3concentrations. In addition, the release of four kind of VHCs with added NH4+-N were higher than that of added NO3--N. volatile halocarbons;incubation experiments;nutrient;phytoplankton;western Pacific Ocean X55 A 1000-6923(2019)10-4313-08 刘珊珊(1995-),女,山东滨州人,中国海洋大学化学化工学院硕士研究生,主要从事海洋界面化学研究. 2019-03-28 国家自然科学基金(41506088);国家重点研发计划项目(2016YFA0601304);中央高校基本科研业务费项目(201762030)海洋国家实验室“鳌山人才”卓越科学家计划项目(2015ASTP-OS12)资助 * 责任作者, 副教授, zhenhe@ouc.edu.cn
1.2 VHCs样品的采集与分析
1.3 营养盐的采集与分析
1.4 叶绿素a(Chl-a)的采集与分析
2 结果与讨论
2.1 船基培养过程中环境参数的变化特征

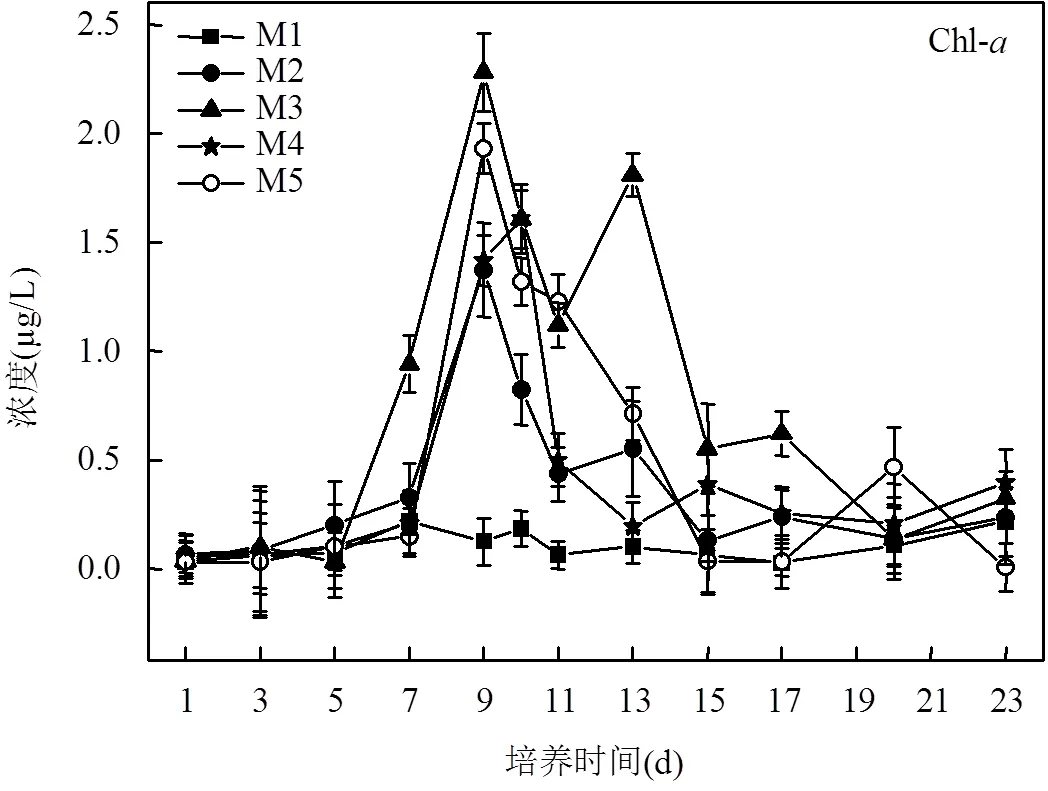
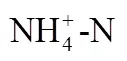
2.2 营养盐含量对浮游植物释放VHCs的影响

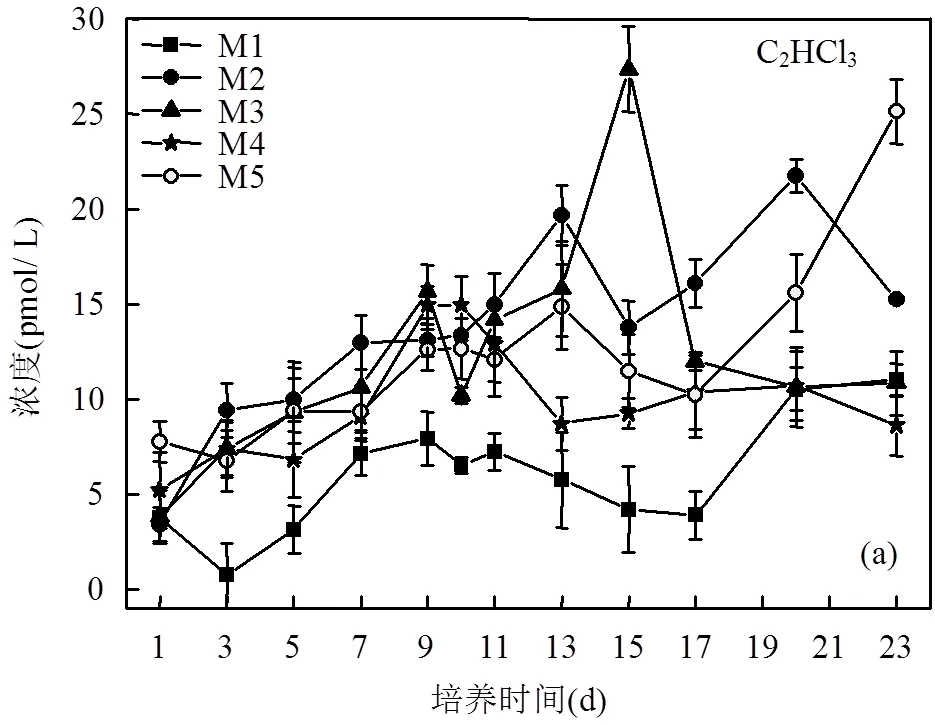
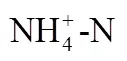
2.3 营养盐结构对浮游植物释放VHCs的影响
2.4 营养盐的输入对开阔大洋海洋大气环境的影响

3 结论
