五种挺水植物腐解过程及其对湿地水质的影响
2019-10-23胡红伟吴俊峰徐晓琴郭一飞
胡红伟,刘 盼,吴俊峰,梁 峰,徐晓琴,郭一飞,刘 彪*
(1.河南城建学院市政与环境工程学院,河南 平顶山 467036;2.河南省水体污染防治与修复重点实验室,河南 平顶山 467036)
氮、磷等营养盐是湿地生态系统初级生产力的重要限制因子之一,其对于湿地生态稳定和健康运行具有重要影响[1]。湿地生态系统作为氮、磷等营养盐的重要储存库,在地球化学循环过程中起着汇集、转化和迁移的重要作用[2]。挺水植物作为湿地生态系统的重要组成部分,主要生长在水陆交界区域,该区域被誉为生物地球化学循环的“热区”[3-4]。近年来,水生植物在湖泊富营养化预防和治理方面发挥着重要作用,但在实际应用中,植物进入冬季时会衰亡,大量植物残体腐解会对水体造成二次污染,如苦草的腐解导致水体TN和TP含量大幅增加[5];芦苇腐解引起水体水质的剧烈变化[6],并且与生物量密度有关[7],唐金艳等[8]的研究也得出类似结论。可见,大量植物腐解会导致水体一定时期内呈现富营养化状态,比较研究湿地不同挺水植物腐解过程及其对水质的影响,对湿地挺水植物管理和水质保护具有重要意义。
本文以北方湿地常见的5种挺水植物为研究对象,通过构建室内试验系统模拟挺水植物腐解过程,研究5种挺水植物腐解及其对水质的影响,以期为湿地水生态修复中挺水植物的选择及其残体的科学管理提供理论依据。
1 材料和方法
1.1 样品的采集和预处理
挺水植物(海寿花Pontederia cordata、白菖蒲Acorus calamus、美人蕉 Canna indica、再力花 Thalia dealbata和风车草Cyperus alternifolius)为本实验室在人工湖中培育而成。2017年10月份在河南城建学院人工湖采集(仅地上部分),植物采集后,用纯水洗净,105℃杀青15 min,65℃烘干至恒质量。将植物茎叶均剪成1 cm的碎片,混匀后置于200目网袋中,-45℃保存备用。2018年3月在白龟湖湿地(33°46′05.85″N,113°09′45.07″E)采集水体和沉积物,水样过200目筛网,沉积物过100目筛网,去除其中的植物残体和杂物。
1.2 植物腐解试验系统
采用体积为12 L的聚乙烯水桶为容器(桶底直径21 cm,桶口直径26 cm,桶高27.5 cm),加入经过预处理的底泥(2 kg)和水样(10 L),静置72 h。将装有海寿花、菖蒲、美人蕉、再力花和风车草的网袋浸没于水桶内,生物量密度为2 g·L-1,同时设置对照组,每组3个重复。在室内进行试验(2018年3月—7月,为期60 d),分别在第0、2、6、12、18、24、30、36、42、48 d和60 d测定植物和水体相关理化指标。植物和水样采集方式:从桶内取出一只网袋(初始量为2 g植物),于65℃烘干至恒质量;使用水泵从水面下5 cm处抽取1 L水样。试验过程中,每周使用双蒸水补充因蒸发损失的水量。
1.3 样品测定和数据分析
植物:经H2SO4-H2O2消煮后,采用半微量凯氏法测定总氮(TN)[7];采用钼锑抗比色法测定总磷(TP)[7];腐解速率(k)参照文献[9]方法分析:
Mt/M0=e-kt
式中:Mt表示植物在时间t的质量,kg;M0为初始质量,kg;k为腐解速率常数,d-1;t为腐解时间,d。
水体:采用雷磁PHS-3E和JPSJ-605S分别测定pH和溶解氧(DO);总磷(TP)、氨氮(NH+4-N)、硝酸盐氮(NO-3-N)和亚硝酸盐氮(NO-2-N)的测定参照文献[7]。使用Excel进行图表绘制,SPSS 18.0进行线性相关性和单因素方差分析。
2 结果与分析
2.1 植物质量损失率(ω)和腐解速率(k)的变化
为期60 d的腐解过程中,5种挺水植物的质量损失率在试验初期快速上升(0~6 d),随后缓慢上升(图1A)。第6 d时,海寿花、菖蒲、美人蕉、再力花和风车草质量损失率分别为15.57%、35.85%、44.24%、22.63%和18.29%。试验结束时,5种植物质量损失率大小依次为菖蒲(69.40%)>美人蕉(68.42%)>海寿花(46.72%)>风车草(34.33%)>再力花(33.73%),其中菖蒲和美人蕉无显著差异(P>0.05)(表1),再力花和风车草无显著差异(P>0.05)。如图1B所示,5种挺水植物的腐解速率变化趋势一致,最高值均出现在第2 d,并于第6 d后快速下降,随后缓慢下降。
2.2 植物TN和TP变化趋势
如图2A所示,整个试验周期内,5种挺水植物TN含量均呈现窄幅波动,但变化趋势并不相同。试验结束时,植物TN含量与初始值相比,海寿花和菖蒲略有上升,其余3种略有下降,依次为菖蒲>海寿花>风车草>再力花>美人蕉,其中海寿花和菖蒲无显著差异(P>0.05),美人蕉、再力花和风车草之间无显著差异(P>0.05)(表1)。
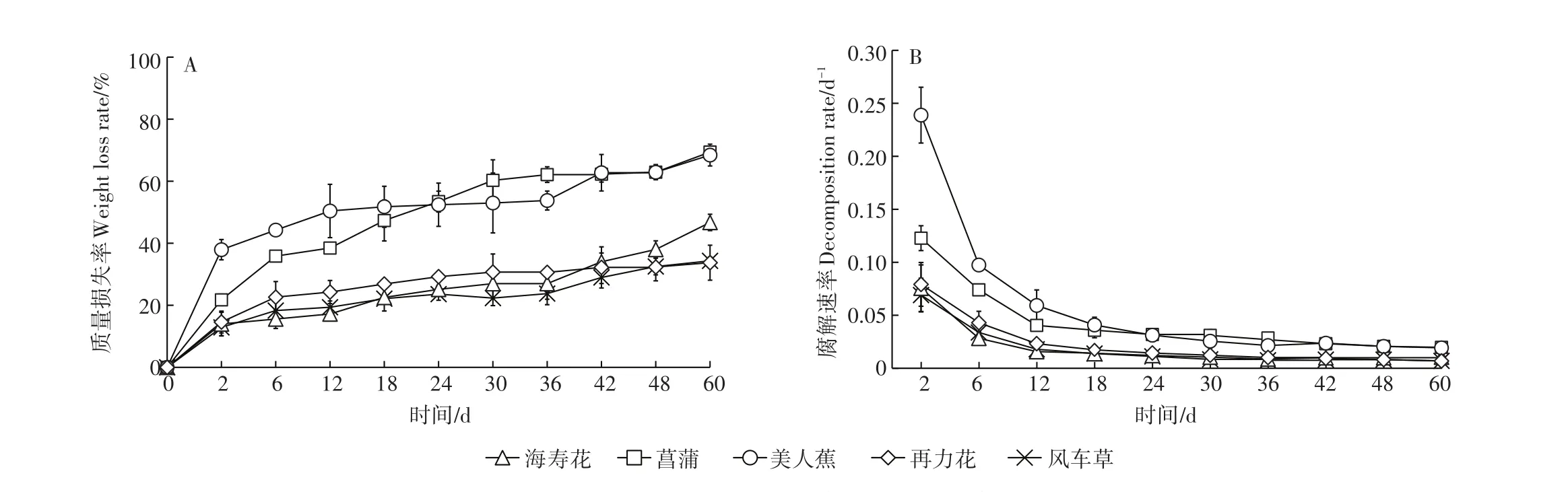
图1 植物质量损失率和腐解速率变化趋势Figure 1 Dynamics of weight loss rate and decomposition rate
如图2B所示,5种挺水植物TP变化趋势一致,试验初期(0~6 d)快速下降,第6 d时,海寿花、菖蒲、美人蕉、再力花和风车草TP较初始值分别下降了32.17%、30.67%、49.44%、53.02% 和 38.47%,第 6 d后,植物TP含量变化波动范围变小。试验结束时(表1),仅菖蒲和美人蕉之间不存在显著差异(P>0.05)。

图2 植物TN和TP变化趋势Figure 2 Dynamics of TN and TP
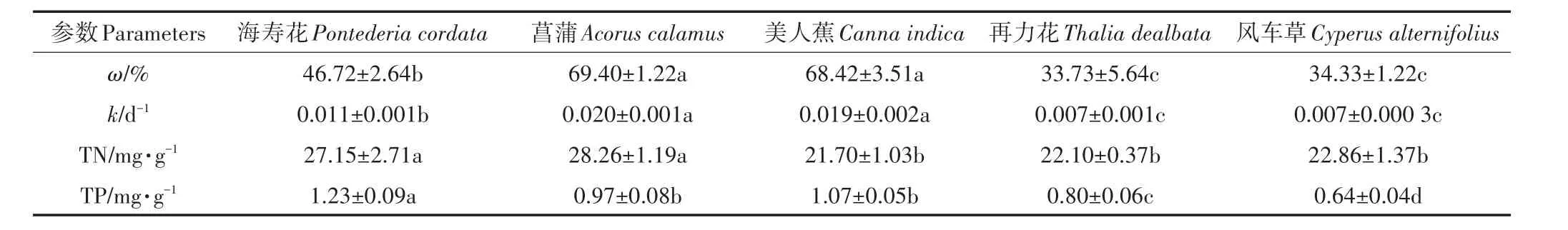
表1 植物理化参数单因素方差分析(第60 d)Table 1 One-way ANOVA of plants physiochemical parameters(The 60th day)
2.3 水体pH、DO和TP变化趋势
为期60 d的试验周期内,各处理组水体pH变化趋势相似(图3A),初期快速下降,均在第2 d出现最低值,然后快速上升,海寿花、美人蕉、再力花和风车草组水体pH在第18 d均上升到8.0以上,菖蒲组水体pH于第30 d上升到8.07。对照组变化趋势与处理组略显不同,在试验初期下降幅度不大,于第6 d达到最低值8.08,随后趋于平缓。试验结束时,初始值与风车草无显著差异(P>0.05),但与其余各处理组均存在显著差异(P<0.05)(表2)。
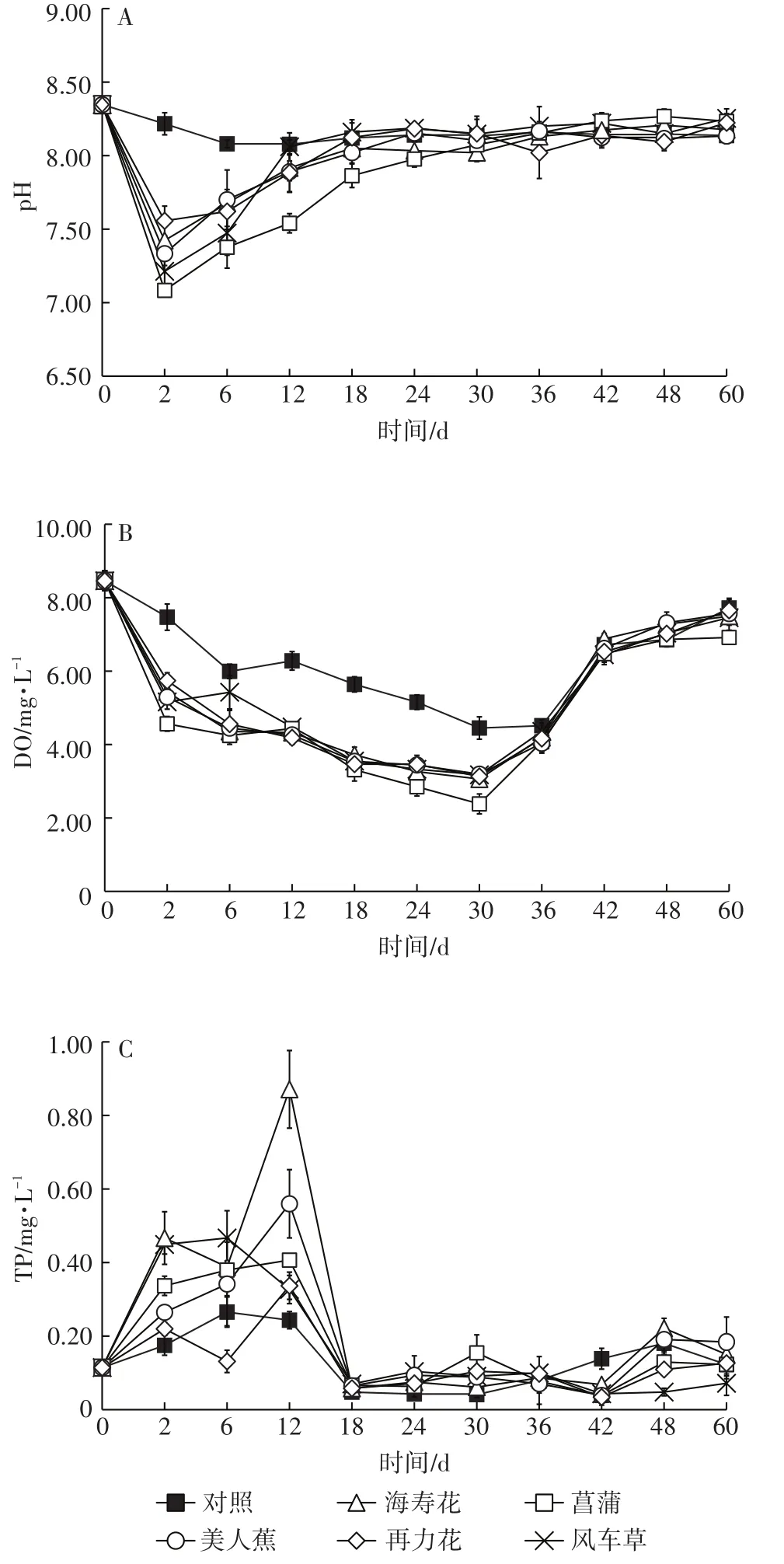
图3 水体pH、DO和TP变化趋势Figure 3 Dynamics of pH,DO and TP in water
对照组水体DO变化趋势与处理组相似(图3B),在30 d内,各组均呈现整体下降趋势,并于第30 d出现最低值,其中以菖蒲组(2.38 mg·L-1)最低。第30 d后,水体DO快速上升。实验结束时,各组DO浓度均显著低于初始值(P<0.05),菖蒲组均显著低于其余各组(P<0.05)(表2)。
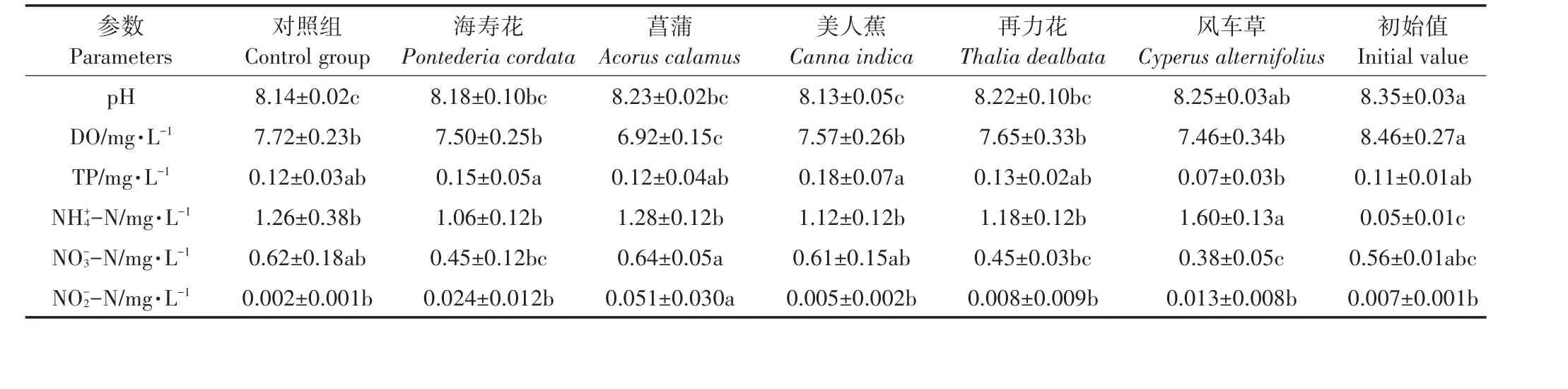
表2 水体理化参数单因素方差分析(第60 d)Table 2 One-way ANOVA of physiochemical parameters in water(The 60th day)
对照组与各处理组水体TP变化趋势相似(图3C),可分为两个阶段,第一阶段(0~18 d),TP浓度均先上升,然后下降,其中对照组和风车草最大值出现在第6 d,分别为0.27 mg·L-1和0.47 mg·L-1,海寿花、菖蒲、美人蕉和再力花最大值出现在第12 d,分别为0.87、0.41、0.56 mg·L-1和0.34 mg·L-1;第二阶段(18~60 d)TP浓度窄幅波动。试验结束时(表2),各组TP浓度依次为美人蕉>海寿花>再力花>对照>菖蒲>风车草,其中风车草与初始值无显著差异(P>0.05)。
2.4 水体NH+4-N、NO-3-N和NO-2-N的变化
如图4A所示,各组水体NH+4-N第2 d均呈现快速上升,但随后出现差异。第2~12 d时,菖蒲和风车草持续下降,随后上升再下降,最高点分别出现在第36 d(1.93 mg·L-1)和第 30 d(2.46 mg·L-1);海寿花和美人蕉则变化较为平缓,第12 d后快速上升,随后下降并窄幅波动;再力花则在0~18 d内持续上升,在第18 d出现最大值(2.46 mg·L-1),随后下降并趋于平缓。试验结束时(表2),各组均显著高于初始值(P<0.05)。与对照组相比,风车草与对照组存在显著差异(P<0.05)。
各组水体NO-3-N变化趋势也存在差异(图4B),其中菖蒲和美人蕉先上升,随后下降,最终趋于平缓;海寿花、再力花和风车草则先略微下降,随后上升再下降,最终趋于平缓;对照组在试验周期内,变化幅度均不大。试验结束时,各组与初始值均不存在显著差异(P>0.05)。
各组水体NO2-N变化趋势差异较为明显(图4C),对照组最高值出现在第2 d,达到0.135 mg·L-1。各处理组则在0~12 d内变化趋势一致,随后出现分化,均呈现出不同变化趋势。试验结束时,仅菖蒲组显著高于初始值(P<0.05),同时显著高于其余各组(P<0.05)。
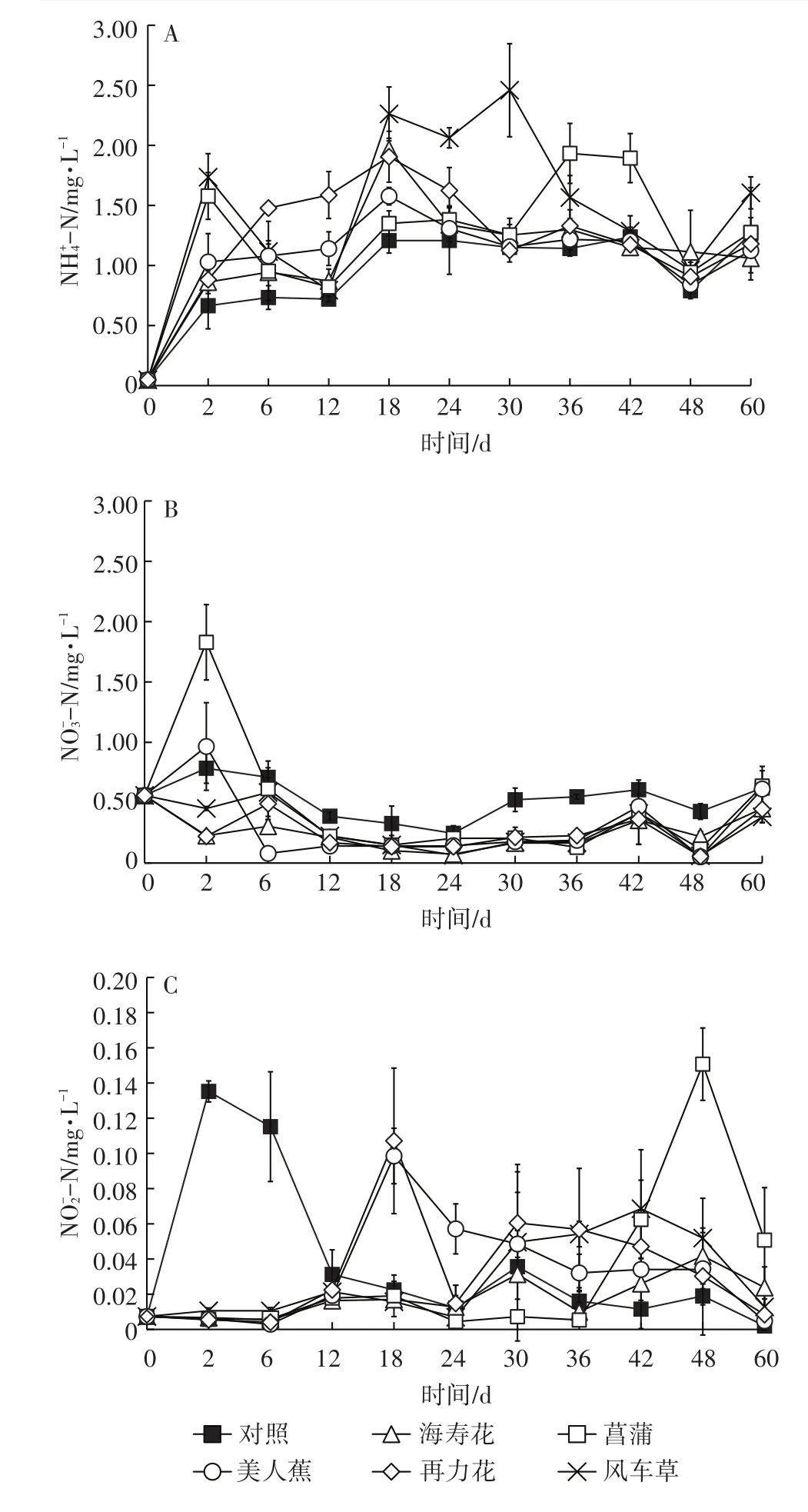
图4 水体NH+4-N、NO-3-N和NO-2-N浓度随时间变化Figure 4 Dynamics of NH+4-N,NO-3-N and NO-2-N in water
3 讨论
3.1 植物腐解的影响因素
影响植物腐解速率的因素较多,如水体环境[10-11]、生物量密度[7-8,12]、植物成分组成[8,13-14]、沉积物性质[15]以及微生物群落结构组成[16]等,但一般而言,植物腐解过程可分为两个阶段:快速溶解阶段和缓慢分解阶段[17]。本研究中,在试验初期(0~12 d)植物体内的有机颗粒和无机盐类等成分通过淋溶作用快速释放到水体环境,引起水质大幅波动;试验后期(12~60 d),植物体内难溶性物质在微生物作用下缓慢分解,水体和植物理化参数呈现波动变化状态。
与此同时,植物类型和种类与腐解速率也存在着密切联系[8,18-19],一般而言,浮水植物的腐解速率最大,沉水植物次之,而挺水植物最低。究其原因,是植物本身理化性质的不同,导致腐解速率存在差异。有研究表明[13,20],植物腐解速率与体内初始有机氮含量成正比,曹培培等[18]和曹勋等[21]的研究也发现,腐解速率分别与植物残体的TN和TP均存在显著正相关性,但本研究未得出类似结论,皮尔逊线性相关性分析表明,5种植物腐解速率与植物残体TN并不存在显著的线性相关性(P>0.05)。此外,仅海寿花、菖蒲和风车草的腐解速率与其残体TP含量呈显著的线性正相关(P<0.05)。在整个试验周期内,菖蒲和美人蕉的腐解速率均显著高于海寿花、再力花和风车草,这可能与其木质素含量较低有关。对温带阔叶林4种植物叶片凋落物腐解速率的研究表明[22],木质素对元素的释放有抑制作用,木质素的含量比N含量更能影响植物的腐解速率[18,20,23]。本研究中,菖蒲和美人蕉茎叶比较低,木质素含量要小于海寿花、再力花和风车草。
有研究认为[18],植物腐解过程TN含量变化趋势与其初始值相关,并且N含量越低的枯落物其固N的趋势越强[24]。本研究中,5种挺水植物在腐解过程中,TN变化趋势各异,但整体呈现窄幅波动,并未发现类似规律。在植物体内,N素主要以有机氮的形式存在,相较于其他化合物,其分解速率相对较慢[25],另一方面微生物附着在植物残体表面,存在一定的固N作用[24],二者共同作用下使植物TN的变化呈现上下波动。
各处理组植物残体TP的变化趋势相似,均在试验初期快速下降,该现象与之前报道类似[8,21]。这是因为P元素在植物组织内主要以磷酸根离子或化合物的形态存在,该形态下的P元素极易在淋溶作用下损失[26]。第6 d后,植物残体TP变化平缓,交替上下波动,这可能与P相关微生物活动有关。
3.2 植物腐解对水质的影响
本研究中,5种挺水植物腐解过程对水质的影响过程较为相似,在试验初期,均出现较大的水质波动,但水质理化参数的变化幅度因植物种类不同而有所差异。水体pH变化趋势与之前的研究相似[7-8],呈现先下降后上升。在试验初期,植物快速腐解,向水体环境释放有机酸,导致水体pH快速下降,在第2 d各处理组均出现最低值。另一方面,植物腐解过程会产生CO2,从而导致水体pH下降,系统内硝化反应对碱度的消耗也是导致水体pH下降的原因之一。随着腐解速率的降低,单位时间进入水体的有机物减少,同时体系中存在的反硝化反应会产生一定碱度,综合作用下促使水体pH逐渐上升,并恢复到初始水平。皮尔逊线性相关性分析表明(表3),各处理组水体pH与植物腐解速率呈负相关且极显著(P<0.01),说明植物腐解过程对水体pH的变化具有较大影响。
如表3所示,各组水体TP的变化与水体pH呈负相关,其中菖蒲和风车草呈极显著相关(P<0.01)。研究表明[19],植物中的P主要以无机磷酸盐的形式进入水体,而磷酸盐在中性或弱碱性环境下会以沉淀的形式进入沉积物。试验初期,水体环境pH较低,同时植物腐解速率较快,水体TP快速上升,随着pH的逐渐回升和腐解速率的快速下降以及水体中DO浓度的恢复,水体磷酸盐以沉淀形式快速向沉积物迁移,最终恢复到初始水平,该结论与之前的研究结果一致[8,18,21]。此外,皮尔逊线性相关性分析表明,在整个试验周期内,各处理组植物腐解速率与水体TP呈正相关趋势,但仅菖蒲组(P<0.05)和风车草组(P<0.01)具有显著性,说明植物腐解过程对水体TP的影响趋势一致,但影响程度因植物不同而各异。仅菖蒲组植物残体TP含量与水体TP含量的线性相关性显著(负相关,P<0.05)。
水体DO在初期持续下降,这是由于植物腐解过程向水体释放了大量溶解性有机物,有机物在微生物的作用下分解导致DO的消耗,随着腐解速率的减缓,复氧速率大于耗氧速率,水体DO浓度逐渐恢复。植物腐解对水体DO的影响是间接产生的,对试验初期(0~12 d)数据进行皮尔逊线性相关性分析(表4),各组水体DO的变化与水体TP均呈负相关,其中对照组(P<0.01)和菖蒲组(P<0.05)具有显著相关性;各组水体DO的变化与植物TP呈正相关,且除菖蒲组外均呈现出显著相关性(P<0.01或P<0.05)。同时,水体TP和植物残体TP变化趋势呈负相关趋势,但仅菖蒲组具有显著的相关性(P<0.05)。此外,试验初期(0~12 d)水体DO的变化与水体NH+4-N均呈负相关,且与海寿花组(P<0.05)、美人蕉组(P<0.05)和再力花组(P<0.01)呈显著相关性,但与植物TN并无显著相关性。
在湿地生态环境中,N素的存在形式有:有机氮、NH+4-N、NO-3-N和NO-2-N,并且主要贮存在沉积物中。有机氮主要来源于植物腐解过程的释放,并主要集中在沉积物表层。有研究表明[4],有机氮在湿地沉积物中的含量占总N含量的97%以上。无机氮(NH+4-N、NO-3-N和NO-2-N)主要是通过微生物的氨化、硝化、反硝化以及厌氧氨氧化作用在水体、沉积物和植物之间迁移转化。植物生长过程,不同植物对无机氮的需求存在差异[27],其根系分泌物对微生物也有一定影响。植物腐解过程也是如此,不同种类植物的成分存在差异,释放到水体环境的成分和总量不同,对水质的影响程度必然存在差异。本研究中,水体NH+4-N来自两部分:一部分来自植物腐解过程产生的大量有机氮,在微生物作用下分解生成氨氮;另一部分来自沉积物氨氮的释放以及有机氮的分解。大量有机氮的分解,造成试验初期水体NH+4-N快速上升。随着植物腐解速率降低,水体氨氮的变化也趋于平缓,最终与对照组差异较小,仅风车草显著高于对照组(P<0.05)。皮尔逊线性相关性分析表明,海寿花组植物残体TN与水体NH+4-N呈显著负相关(P<0.05),风车草组植物残体TN与水体NH+4-N呈显著正相关(P<0.05),而其余各处理组未展现出显著相关性。这可能是因为植物体内N并不是整体降解,其降解过程是从边缘开始,逐渐延伸到中心,并且植物体内N浓度的变化并不均匀,因此不能简单地将植物残体TN的变化与水体无机氮的变化看作是线性相关的。
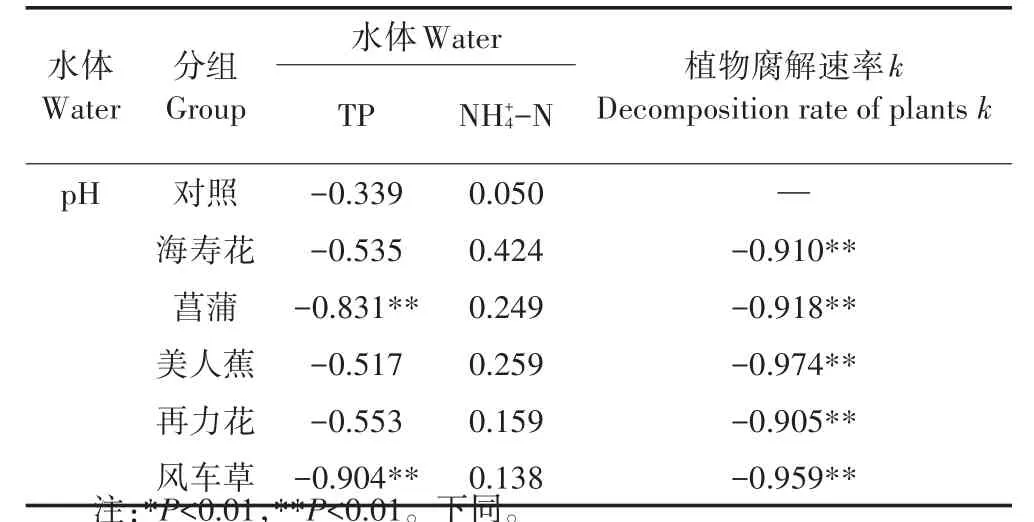
表3 皮尔逊线性相关性分析(0~60 d)Table 3 Pearson linear correlation analysis(0~60 d)
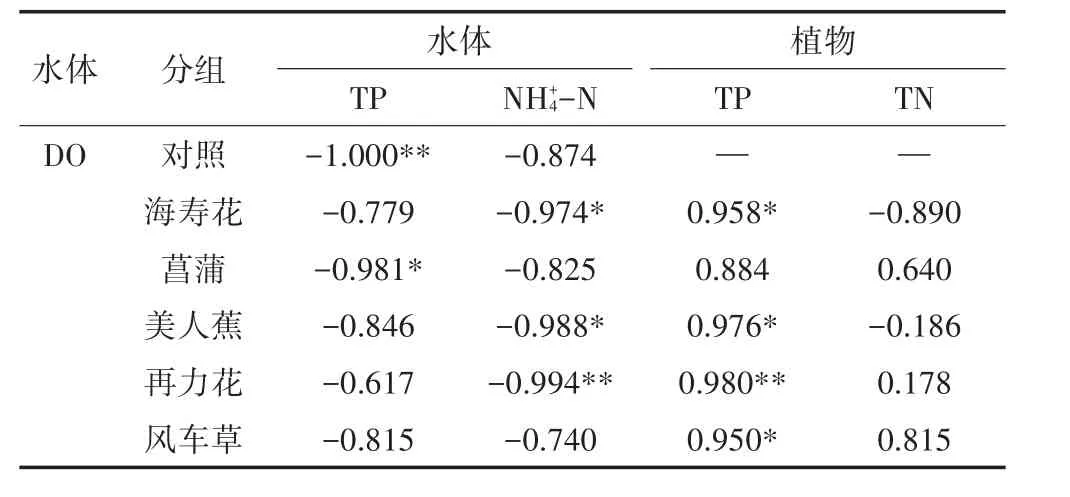
表4 皮尔逊线性相关性分析(0~12 d)Table 4 Pearson linear correlation analysis(0~12 d)
水体NO-3-N的变化与反硝化反应相关,在试验初期随着DO的消耗,反硝化细菌活性增强,导致水体NO-3-N短暂升高后快速下降。皮尔逊线性相关性分析表明,植物腐解速率与菖蒲组和美人蕉组NO-3-N呈显著正相关(P<0.05)。水体NO-2-N作为硝化和反硝化的中间产物,稳定性较差,变化幅度较大。植物腐解过程释放出的N素可通过硝化、反硝化和厌氧氨氧化等微生物作用生成N2和N2O等气体逸出,亦可在氮素的不同存在形式之间相互转化,总之氮的迁移转化每一步都离不开微生物的作用。在湿地生态环境中,虽然有植物吸收作用参与N的循环,但微生物的作用依然是最主要的。
4 结论
(1)不同种类植物其腐解速率存在差异,菖蒲和美人蕉最快,海寿花次之,风车草和再力花最慢。试验初期,各处理组质量损失率快速上升,第6 d时,海寿花、菖蒲、美人蕉、再力花和风车草质量损失率分别为15.57%、35.85%、44.24%、22.63%和18.29%,随后进入缓慢分解阶段,在第60 d时,植物质量损失率分别达到46.72%、69.40%、68.42%、33.73%和34.33%。
(2)试验周期内,5种挺水植物TN呈窄幅波动,未发现植物残体TN含量与腐解速率的显著相关性。植物TP在试验初期快速下降,随后趋于平缓,海寿花、菖蒲和风车草的腐解速率与其残体TP含量呈显著的线性正相关(P<0.05)。
(3)5种挺水植物腐解过程对水质的影响存在差异,但均在试验初期引起水质较大的波动,且整体变化趋势相似。试验初期,水体pH和DO快速下降,TP快速上升,试验结束时,恢复到初始水平。水体NH+4-N、NO-3-N和NO-2-N变化因植物种类不同存在差异,微生物在水体N素转化过程中发挥着重要作用,沉积物作为潜在污染源对水体N素变化也具有一定影响。挺水植物腐解对湿地水质的影响具有时效性,为避免水质剧烈波动,应在植物衰亡初期进行有计划地收割。
