新疆苜蓿新病毒(BLRV)的鉴定
2019-10-22李克梅阿孜古丽木汉买提葛瑞云刘学学李宝义热甫卡提雪合拉提
李克梅,阿孜古丽·木汉买提,葛瑞云,刘学学,李宝义,热甫卡提·雪合拉提
(新疆农业大学农学院,新疆 乌鲁木齐 830052)
苜蓿(Medicagospp.)素有“牧草之王”美誉,具有适应性强,产草量高,富含蛋白质等特性,作为牧草在世界范围被广泛种植[1],也可作为绿肥,改土肥田、保持水土、改善生态环境等[2]。目前全世界的苜蓿种植面积为3 300万hm2,其中美国[3]约1 000万hm2,我国[4]苜蓿约470万hm2。我国苜蓿主产区为东北、华北和西北地区[5]。
随着苜蓿种植面积的逐步增加,苜蓿病毒病的发生状况呈加重趋势,越来越多的病毒种类被发现,病毒复合侵染的现象普遍存在,引起的症状类型越来越多样化,严重影响苜蓿生产及产业发展[6]。苜蓿病毒病常表现为花叶、矮化或畸形等症状,使之产量降低,难以越冬[7]。国内外研究报道,有多种病毒可以侵染苜蓿[8],在阿根廷紫花苜蓿田中发现有菜豆卷叶病毒(bean leafroll virus, BLRV)的侵染[9];在澳大利亚苜蓿田中发现有苜蓿矮化病毒(alfalfa dwarf virus, ADV)和苜蓿卷叶病毒(alfalfa leafroll virus, ALRV)的侵染[10];在沙特阿拉伯紫花苜蓿、杂草和栽培植物中检测到苜蓿花叶病毒(alfalfa mosaic virus, AMV)以及菜豆卷叶病毒[11];在伊朗苜蓿田中检测到有苜蓿花叶病毒、菜豆卷叶病毒、花生矮化病毒(peanut stunt virus, PSV)和菜豆黄花叶病毒(bean yellow mosaic virus, BYMV) 4种病毒可以侵染苜蓿,检出率分别为23.3%、12%、0.7%和0.28%[12];在甘肃张掖地区番茄花叶病毒(tomato mosaic virus, ToMV)和苜蓿花叶病毒复合侵染苜蓿[13];在新疆有菜豆黄花叶病毒和苜蓿花叶病毒侵染苜蓿的报道[14-15]。新疆是我国苜蓿种植的主要产区之一[16],近年来,牧草病害课题组成员在新疆苜蓿田间发现大量矮化、丛枝、卷叶等症状的植株,发病率为20%~100%,该病害不仅引起牧草大幅度减产,而且极大地缩短苜蓿草地使用年限。2017-2018年,借助Si-RNA高通量测序分析,认为在此类症状病株中可能携带有菜豆卷叶病毒。因此,本研究对栽培苜蓿疑似卷叶、矮化等症状的病害种类的病原开展BLRV分子检测,以明确新疆苜蓿卷叶的症状是否由BLRV侵染引起,从而正确认识该病害的病原种类以及分类地位,以便对该病害的防治提供理论依据[17]。
1 材料与方法
1.1 材料
待测苜蓿样品的采集:2017年5月至2018年9月,分别在新疆北疆昌吉州的呼图壁县,乌鲁木齐市的乌拉泊、板房沟、南山以及阿勒泰地区的布尔津、北屯、富蕴县采集表现为有卷叶、皱缩、矮化等症状的苜蓿病株样品,同时将采集到的健康苜蓿植株作为阴性对照,每种症状的病叶样品采集两份,一份放入4 ℃短期保存,另一份样品保存于-80 ℃冰箱,用于RNA提取等后续试验。
菌株和质粒:Transl-T1感受态细胞,pEASYT1克隆载体均采购于北京全式金生物技术有限公司,由新疆农业大学病理研究室保存。
生化试剂:10×PCR Buffer (Mg2+)、dNTPs(2.5 mmol·L-1)、Taq DNA 聚合酶(5 U·μL-1)、2 k bp DNA Marker、普通琼脂糖凝胶DNA回收试剂盒(EasyPure Quick Gel Extraction Kit)、cDNA第一链合成试剂盒、TRNzol Universal总RNA提取试剂、氨苄青霉素(Amp+)、X-gal、IPTG等生化试剂皆购于北京全式金生化生物科技有限公司;其他常规化学试剂均为国产分析纯。
1.2 苜蓿菜豆卷叶病毒的分子检测
1.2.1 苜蓿总RNA的提取
分别称取0.1~0.2 g的苜蓿病样和健康植株样品的嫩叶,用TRNZOL universal (全式金)试剂法提取苜蓿叶片的总RNA (提取方法参见产品操作说明书),并将提取的RNA置-80 ℃保存备用。
1.2.2 菜豆卷叶病毒的RPCR扩增及电泳检测
将Trucco等[9]设计的BLRV的外壳蛋白基因特异性引物序列BLRV-F/BLRV-R提交至上海生工生物工程股份有限公司合成。引物序列如下:BLRV-F:5’-TAGGTTCCTTCGATTACAAG-3’,BLRV-R:5’-CTTCAATATTCGTCCAGTTC-3’。用全式金cDNA第一链合成试剂盒合成cDNA第一链,步骤按说明书进行,将反转录好的cDNA放置-20 ℃冰箱保存备用。以合成的cDNA第一链为模板,BLRV-F/BLRV-R为引物进行常规RT-PCR扩增。在25 µL的RT-PCR反应体系中,cDNA模板1 µL;Taq DNA聚合酶 0.5 µL;10×PCR Buffer 2.5 µL (2.5 mmol·L-1MgCl2); dNT Ps 1 µL (10 mmol·L-1);上下游引物(10 µmol·L-1)各1 µL;ddH2O 19 µL。反应程序:94 ℃4 min,94 ℃ 45 s,51 ℃ 45 s,72 ℃延伸1 min,循环35次;最后72 ℃延伸10 min;4 ℃保存。用2%琼脂糖凝胶电泳检测RT-PCR产物,使用凝胶成像系统拍摄并记录。
1.3 序列测定及分析
经琼脂糖凝胶电泳检测PCR扩增产物,切取特异性目的条带,采用快速凝胶回收纯化试剂盒(EasyPure Quick Gel Extraction Kit)回收、纯化后,再与载体Trans1-T1(TRANS)在常温下连接25 min,继而进行转化、涂板、蓝白斑筛选,将筛选到的含正确插入片段的质粒送往上海生工生物工程股份有限公司进行序列测定。运用DNAMAN8.0软件将测序获得的序列与GenBank中已提交的菜豆卷叶病毒代表性序列进行核苷酸序列同源性对比分析,使用MEGA7.0中的邻接法构建系统进化树,最终将获得的序列提交至Bankit获得序列登录号(MK263743.1)。
2 结果与分析
2.1 病株症状
栽培苜蓿通常第1年不表现症状,第2年春季返青后即可表现症状,相对于健康苜蓿植株,疑似病毒病的苜蓿植株矮小,枝条细弱,叶片边缘呈皱缩或有波纹的卷曲状,常伴有花叶或黄化斑驳,发病严重的甚至无法开花(图1)。

图1 苜蓿卷叶病毒病田间症状Figure 1 Symptoms of alfalfa leafroll virus disease in the field
2.2 RT-PCR检测
对苜蓿病株样品进行RT-PCR扩增检测,用引物BLRV-F/BLRV-R可以扩增出大小约为1 000 bp的特异性条带(图2)。

图2 BLRV RT-PCR扩增产物电泳图Figure 2 RT-PCR amplification of bean leafroll virus(BLRV)
2.3 BLRV外壳基因片段序列测定及分析
提取采集的疑似卷叶病毒病的苜蓿样品总RNA,反转录合成cDNA第一链,进行PCR扩增,PCR产物回收纯化、克隆和序列测定。测序结果表明:从新疆苜蓿疑似感染BLRV的样品中得到长955 bp的特异性片段,G+C含量为49.7%。经序列比对,所得核苷酸序列与已报道的豆科植物上菜豆卷叶病毒(BLRV)分离物核苷酸序列同源性介于85.1%~96.5%。其中与阿根廷苜蓿BLRV分离物(KR261610.1)、美国豌豆BLRV分离物(HM439776.1)和(GQ404380.1)、澳大利亚苜蓿BLRV分离物(MF075256.1)序列同源性分别为96.5%、93.0%、92.7.%和89.2% (表1)。
2.4 系统进化树的构建和分析
运用MEGA7.0软件中邻接法将新疆苜蓿菜豆卷叶病毒(BLRV)外壳蛋白基因序列与GenBank中已报道的相同基因部分序列以及苜蓿花叶病毒[18](MF075254.1)、苜蓿矮化病毒[10](FJ15933.1)、苜蓿卷叶病毒[22](KX574859)外壳蛋白基因序列进行系统进化树的构建。经序列比较分析,从构建的系统进化树可见(图3),新疆侵染苜蓿的菜豆卷叶病毒BLRV-XJ分离物(MK263743)与希腊菜豆卷叶病毒(KT382814.1、HE601635.1、KT382812.1)分离物进化树关系最近,在同一进化分支上,故将其鉴定为菜豆卷叶病毒(bean leafroll virus),同属于黄症病毒科(Luteoviridae)黄症病毒属(Luteovirus)。
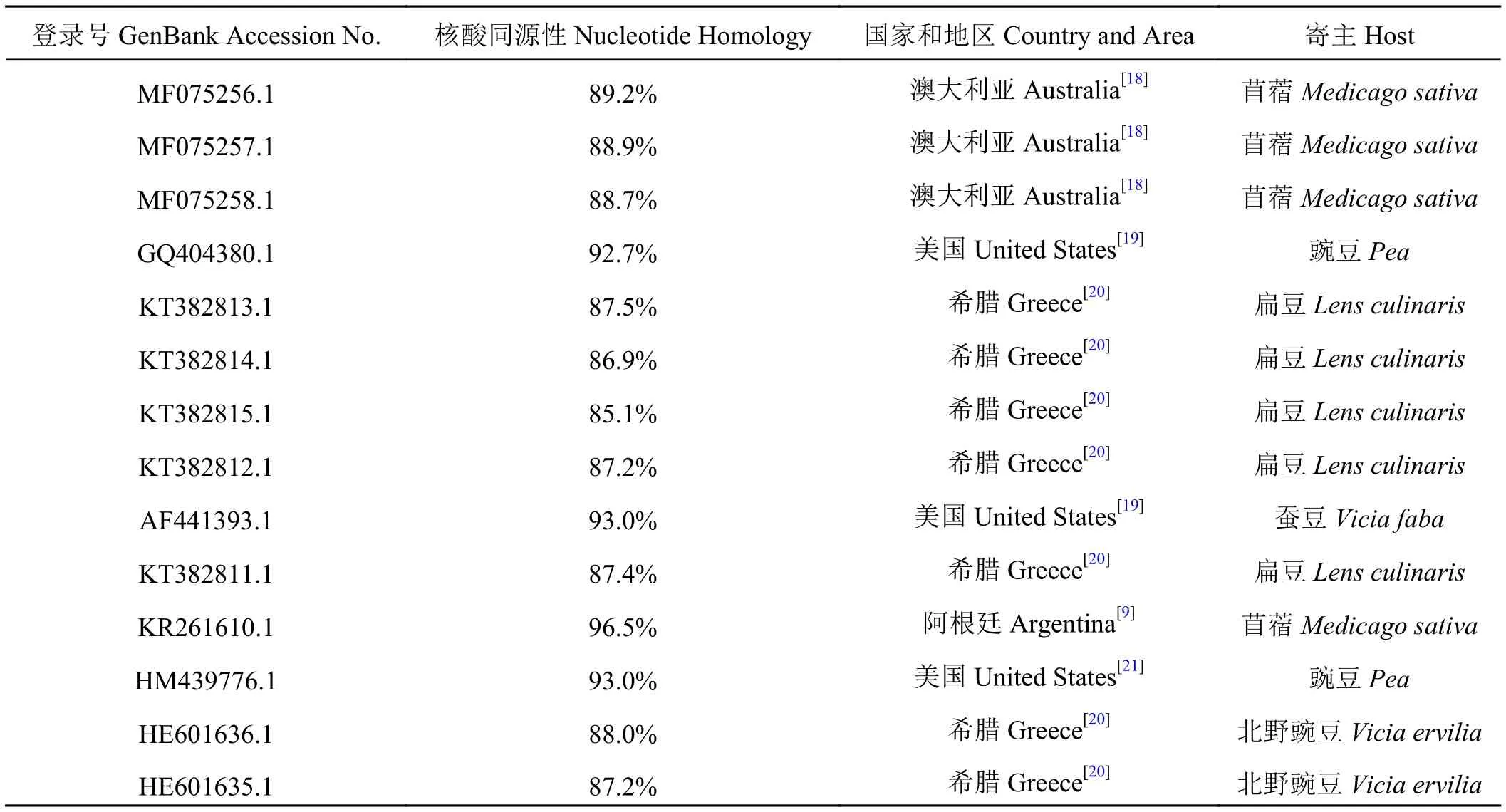
表1 新疆BLRV分离物外壳蛋白基因核苷酸序列与已报道BLRV分离物同源性比较Table 1 Comparison of the homology between the nucleotide sequence of the coat protein gene of bean leafroll virus (BLRV) isolates in Xinjiang and the reported BLRV isolates
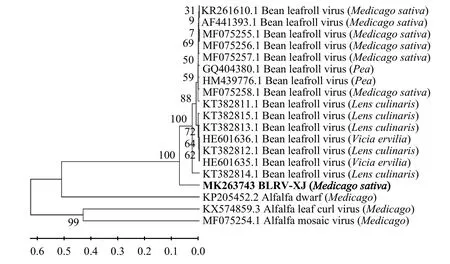
图3 用邻接法构建的新疆菜豆卷叶病毒紫花苜蓿分离物外壳蛋白基因系统进化树Figure 3 Neighbor-joining phylogenetic tree based on the coat protein gene of the bean leafroll virus (BLRV)isolates on alfalfa in Xinjiang
3 讨论与结论
截至2015年,我国苜蓿种植面积达到470.8万hm2[23]。新疆是我国苜蓿种植的主要产地之一,近几年苜蓿病毒病的发生越发严重,但病原报道不多。本研究利用菜豆卷叶病毒(BLRV)特异性引物对新疆苜蓿疑似病毒病植株进行PCR检测,扩增出长955 bp特异条带,测序序列比对结果与菜豆卷叶病毒(BLRV)同源性较高,与Trucco等[9]报道的阿根廷侵染苜蓿的BLRV(KR261610.)同源性最高。从构建的系统进化树可知,新疆侵染苜蓿的菜豆卷叶病毒BLRV(MK263743)与已知豆科植物中的菜豆卷叶病毒聚为一类。该结果证明了新疆栽培苜蓿疑似卷叶病毒病的病原为菜豆卷叶病毒(BLRV)。阿根廷、伊朗、澳大利亚曾报道菜豆卷叶病毒侵染苜蓿[9,12,18],本研究结果首次证实该病毒在中国侵染苜蓿,丰富了苜蓿菜豆卷叶病毒(BLRV)在中国新疆地区基因组序列信息,对今后的检测提供了理论依据和技术支持。
目前,国内苜蓿种子供应量还有所不足,苜蓿干草也是我国进口草产品中的主打产品[24]。苜蓿种子和干草常常是病原的直接传播来源,我国苜蓿种子进口国家有美国、澳大利亚、西班牙和加拿大等[25]。文朝慧等[26]利用双抗体夹心酶联免疫吸附分析结合RT-PCR方法从52份紫花苜蓿种子样品中检测到45份携带有苜蓿花叶病毒(AMV)、3份携带菜豆黄花叶病毒(BYMV)。苜蓿菜豆卷叶病毒(BLRV)很可能随着进口苜蓿种子和苜蓿干草的引进传入我国并引起危害,相关部门应引起足够重视。
病毒是一类传染性很强的植物病原生物,通过对病毒病的检测,可及早发现感病植物体内病毒的存在,对病害的防治以及深入研究病毒的病理特点具有重要的意义。目前我国对苜蓿病毒病的研究较少,在今后的工作中还需要进一步开展检测和防治技术研究。苜蓿病毒病对我国苜蓿产业发展存在较大的威胁,确认不同病毒之间的联系以及病毒复合侵染问题还需要进一步研究,为苜蓿病毒病害检测及其防治奠定基础。
