胆管腔内联合瘤体内植入125I粒子治疗不可切除胰头癌
2019-10-22胡小四刘会春满忠然
胡小四,庞 青,刘会春,周 磊,金 浩,王 勇,满忠然
(蚌埠医学院第一附属医院肝胆外科,安徽 蚌埠 233004)
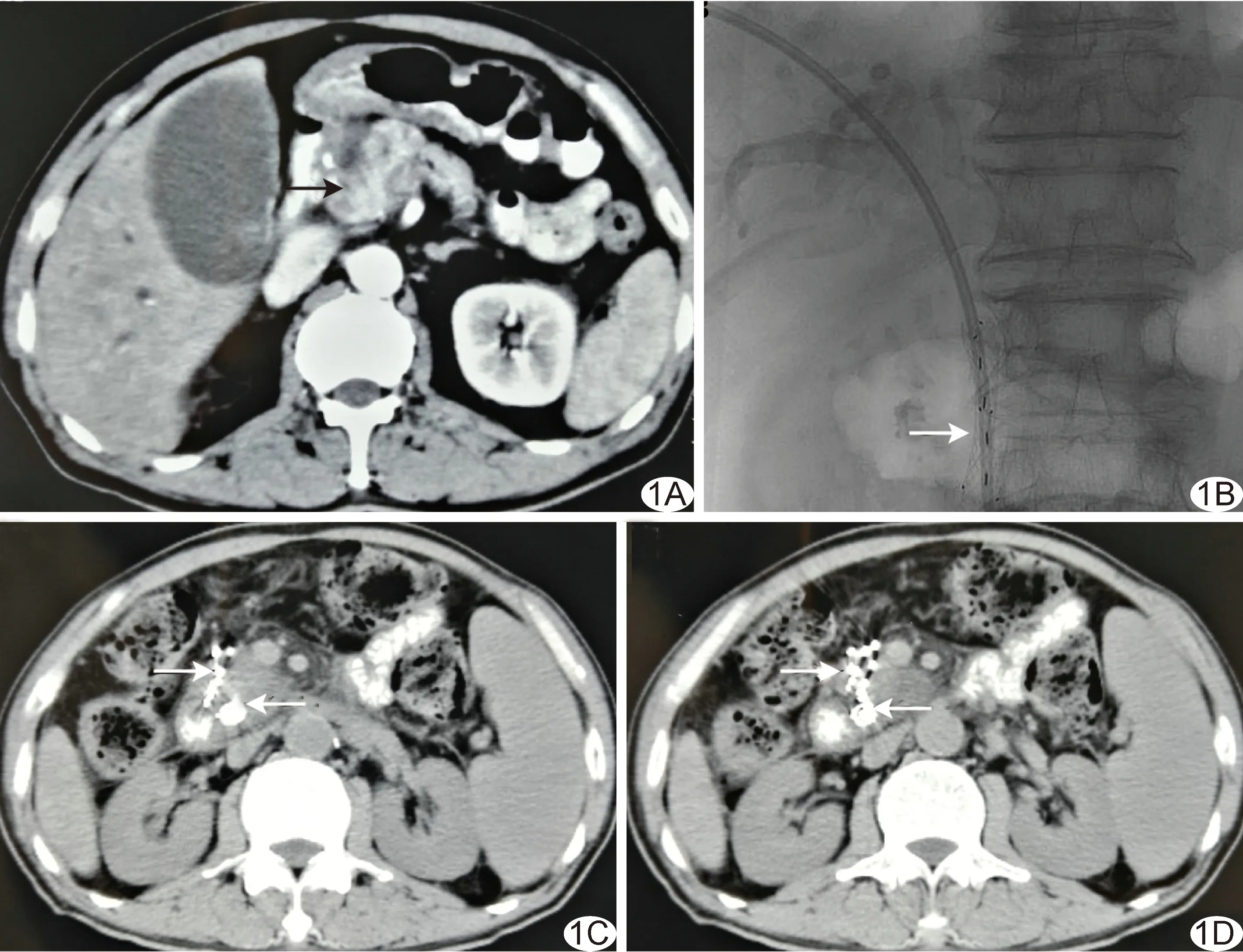
图1 患者男,62岁,125I组 A.术前CT示肿瘤上部包绕肝总动脉(箭),无法进行根治性切除; B.于DSA引导下行胆管腔内置入SEMS+125I粒子胆管腔内植入术; C.瘤体内植入125I粒子后第2天复查CT,见125I粒子分布在瘤体内; D.术后3个月复查CT,粒子间瘤体组织明显萎缩 (箭示SEMS及粒子所在)
胰腺癌是高度恶性肿瘤,发病率呈上升趋势[1],且起病隐匿,多数患者就诊时已失去根治性手术机会[2];胰头癌(pancreatic head carcinoma, PHC)易侵犯邻近血管及脏器,切除更为困难,未经有效治疗的PHC患者平均生存时间仅约3~4个月[3]。腹腔镜姑息性手术(palliative surgery, PS)是治疗部分不可切除PHC的主要方法,但术后易出现胆瘘、吻合口出血等并发症。125I粒子胆管腔内照射能抑制甚至阻止肿瘤在腔内生长,延长胆管支架通畅时间[4],但125I粒子有效半径较小,单纯胆管腔内照射不能取得最佳治疗效果。本研究探讨胆管腔内联合瘤体内植入125I粒子治疗不可切除PHC的效果。
1 资料与方法
1.1 一般资料 回顾性分析2015年1月—2018年6月我院收治的72例PHC患者。纳入标准:①术前接受穿刺活检病理证实PHC(导管腺癌),且无法接受根治性手术切除;②未接受其他相关治疗;③预计存活时间>3个月。排除标准:①存在如凝血功能障碍、大量腹腔积液等治疗禁忌证;②术后失访或随访资料不完整。根据治疗方法分为PS组和125I组。PS组35例,男16例,女19例,年龄37~76岁,平均(62.6±9.0)岁,TNM分期为ⅡA期6例、ⅡB期8例、Ⅲ期21例,肿瘤最大径(33.89±6.23)mm,糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)为(719.37±390.95)ng/ml;125I组37例,男20例,女17例,年龄43~89岁,平均(70.7±9.6)岁,TNM分期为ⅡA期7例、ⅡB期5例、Ⅲ期25例,肿瘤最大径(36.11±6.44)mm,CA19-9为(460.28±62.86)ng/ml。
1.2 仪器与方法 采用GM Innova 3100型DSA机、ALKOA-1700 DV彩色超声诊断仪(3.5~5.0 MHz变频探头)为引导设备。125I粒子(北京原子高科股份有限公司)初始剂量11.1~37.0 MBq,半衰期59.43天,施源导管为P型管。
对125I组患者进行胆管腔内联合瘤体内植入125I粒子治疗(图1),具体方法参照文献[5]。术前1周于超声引导下施行胆管引流,之后在DSA引导下将自膨式金属支架(self-expanding metallic stent, SEMS)置入胆管,同期或分期放入P型管及125I粒子;P型管外端固定于皮肤,主管封闭,侧管外接引流袋并于术后3天封闭。125I粒子植入后2~3天,先进行超声扫查明确进针途径,规划粒子的布局及数量;之后于超声引导下进行穿刺,待穿刺针进入瘤体内、拔出针芯回抽无血后,将1颗125I粒子植入外套管内,并通过针芯推送至瘤体内,每次退针约1 cm,依次释放,每个针道植入粒子2~3颗,针道间距约1.5 cm。完成植入后复查超声,核查粒子分布情况。术后2 h及12 h复查血清淀粉酶,次日晨复查血常规、生化常规,并辅以预防感染、止血、抑酸等处理。术后第2天复查腹部CT,观察是否有出血及积液,并视情况给予对症处理。因125I粒子半衰期约为59.43天,故植入粒子6个月后视为失效,更换P型管及粒子,将废管及失效粒子送核医学科处理。
表1 2组患者术前及术后肝功能指标比较(±s)

表1 2组患者术前及术后肝功能指标比较(±s)
组别ALT(U/L)AST(U/L)TBIL(μmmol/L)ALB(g/L)PS组(n=35) 术前159.49±67.17180.00±71.44254.84±81.2932.08±2.83 术后1个月49.00±16.2058.06±20.7334.46±14.5335.95±2.93 术后3个月51.51±18.5562.54±19.0429.38±9.7336.81±2.11 术后6个月69.57±23.5984.03±30.3040.40±11.1534.26±2.33 F值67.24366.83241.29623.082 P值<0.001<0.001<0.001<0.001125I组(n=37) 术前195.22±112.88184.62±94.16233.98±74.3132.93±4.09 术后1个月50.38±28.2454.00±23.4837.08±21.4638.10±2.90∗ 术后3个月28.76±21.52∗29.86±12.55∗15.65±21.87∗40.77±2.73∗ 术后6个月32.32±18.46∗33.97±16.70∗15.75±10.57∗40.03±3.32∗ F值80.98965.379253.2942.484 P值<0.001<0.001<0.001<0.001
注:*:与PS组同时间点比较,P<0.05
对PS组患者施行腹腔镜双引流术,手术体位及Trocar布局同腹腔镜胰十二指肠切除术[6],探查腹腔并切除胆囊,于距肝门部约1.5 cm处离断肝总管,远端缝闭;之后进行胃空肠吻合、胆管空肠吻合及空肠输入输出袢侧侧吻合,放置引流管。术后处理同125I组。
1.3 观察指标 术前及术后1、3、6个月检测肝功能指标总胆红素(total bilirubin, TBIL)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、白蛋白(albumin, ALB)。统计术后1个月内2组并发症发生率。根据语言评价量表(verbal rating scale, VRS)将疼痛程度分为4级[7],将2级及以上疼痛定义为明显疼痛,统计2组患者术后1个月内明显疼痛发生率。随访至2018年12月31日或死亡,统计2组患者中位生存时间及截止随访终点时的死亡情况。
1.4 统计学分析 采用SPSS 22.0统计分析软件。符合正态分布的计量资料以±s表示。采用独立样本t检验比较2组患者年龄、肿瘤最大径及CA19-9。各时间点肝功能指标比较采用单因素方差分析,两两比较采用LSD-t检验。2组间性别、肿瘤临床分期比较采用χ2检验。采用Kaplan-Meier(KM)生存曲线及Log-rank检验对比两组预后差异。采用COX回归方程分析影响PTH患者预后的因素。P<0.05为差异有统计学意义。
2 结果
2组患者性别(χ2=0.500,P=0.479)、肿瘤临床分期(χ2=0.446,P=0.504)及最大径(t=1.487,P=0.141)、CA19-9(t=2.359,P=0.024)差异均无统计学意义,125I组患者平均年龄大于PS组(t=3.706,P<0.05)。2组术前TBIL、ALT、AST及ALB差异均无统计学意义(P均>0.05)。与术前比较,2组术后1、3及6个月时血清ALT、AST及TBIL水平均降低,ALB水平均升高,且术后3、6个月时125I组变化更显著(P均<0.05)。见表1。
PS组术后1个月内并发症发生率为28.57%(10/35),包括胆瘘6例、消化道出血2例、胃排空障碍2例;125I组为21.62%(8/37),其中胰腺炎或血清淀粉酶升高4例、胆道感染2例、十二指肠梗阻2例;组间差异无统计学意义(2=0.463,P=0.496)。PS组术后1个月内明显疼痛发生率为60.00%(21/35),125I组为5.41%(2/37),组间差异有统计学意义(2=24.659,P<0.001)。
术后随访时间4~17个月,PS组患者中位生存时间为9个月(8~10个月),125I组为11个月(9~12个月),组间差异有统计学意义(χ2=4.157,P=0.041)。截止随访终点,PS组死亡20例,死因包括肝脏和/或其他远处转移13例、继发感染3例、恶液质2例、多脏器功能障碍综合征(multiple organ dysfunction syndrome, MODS)2例;125I组死亡24例,死因包括肝脏和/或其他远处转移15例、继发感染4例、恶液质2例、MODS 3例,未发生明确肠管放射性损伤等并发症及相关死亡;组间差异无统计学意义(2=0.834,P=0.361)。COX回归分析结果显示,CA19-9[风险比(hazard ratio,HR)=8.326,95%CI(1.132,61.261),P=0.037]、ALB[HR=2.289,95%CI(1.028,5.097),P=0.043]是影响PTH患者预后的危险因素。
3 讨论
目前根治性手术是治疗PHC的最佳方式,但仅约10%~20%患者可获得手术机会,且伴随较高的并发症发生率[8]。对于不可切除PHC,治疗关键是解除梗阻、提高患者生活质量并延长其生命[9],但伴随肿瘤进展,常会出现胆管梗阻和十二指肠梗阻症状,解除梗阻及恢复经口进食成为治疗重点,而PS是解决上述问题的常用外科手段[10]。以腹腔镜进行手术可减轻患者创伤,提高生活质量且不增加并发症[11],但PS创伤较大,术后易出现胆肠吻合口狭窄、胆瘘、吻合口出血等并发症,且不能显著改善疼痛等症状,总体疗效欠佳。
胆管腔内植入125I粒子可抑制甚至阻止肿瘤在腔内生长,延长胆管支架通畅时间[4];但125I粒子有效半径较小,单纯腔内照射不能达到最佳治疗效果。研究[4]证实,胆管内置入SEMS后,腔内植入125I粒子可使晚期胆管癌患者获益,与PS相比,治疗PHC同样有效[12]。瘤体内植入125I粒子治疗胰腺癌的效果已获得肯定[13]。本研究对125I组患者于胆管内置入SEMS后植入125I粒子,并联合瘤体内植入125I粒子治疗PHC,对PS组患者则给予常规腹腔镜双引流术进行治疗,结果显示术后2组患者肝功能均获改善,提示两种方法均能有效解除胆管梗阻。
PHC患者常因肿瘤压迫或腹腔神经丛侵犯而出现剧烈腰背部或腹部疼痛,导致其精神压抑及生活质量降低[14]。125I粒子可使瘤体缩小而减轻压迫,并可阻断腹腔神经传导进而止痛[15]。本研究中,125I组患者较PS组术后1个月内明显疼痛发生率显著降低,证实了其缓解疼痛的有效性。对于贴近胆管壁且被血管包围的肿瘤,利用胆管与胰头的解剖关系,联合粒子腔内途径照射,可减少植入瘤体的粒子数,以最大限度地保障治疗效果及其安全性,且可根据肿瘤进展情况及时行再次粒子补充植入或更新,使治疗的时效性更优。术后随访结果显示,本研究125I组患者的中位生存时间大于PS组,2组死亡率差异无统计学意义,且125I组未发生明确的肠管放射性损伤等并发症及相关死亡,提示胆管腔内联合瘤体内植入125I粒子对于改善患者预后的效果优于PS。COX分析提示,术前CA19-9及ALB是影响PHC患者预后的主要危险因素。术前较高的CA19-9及较低的ALB往往提示患者身体状况较差,导致其无法耐受手术治疗。对于高龄或身体状况较差者,125I粒子治疗无疑是更佳选择。
本研究的局限性:①为单中心回顾性研究,样本量较小;②受条件限制,未能开展125I粒子治疗PHC的剂量-时间学研究。
综上所述,胆管腔内联合瘤体内植入125I粒子可有效缓解不可切除PHC患者胆管梗阻症状,且具有更佳的缓解疼痛及延长生存期效果,为治疗晚期PHC患者提供了新的选择。
