二甲基亚砜对TOV-112D细胞整合素β4表达的影响
2019-10-22高夏欢王晓娜陈腾祥
崔 唱,高夏欢,王晓娜,章 克,陈腾祥*
(1.新乡医学院三全学院,河南 新乡 453003;2.贵州医科大学基础医学院,贵州 贵阳 550025)
整合素β4的主要功能是维持上皮细胞的完整性,调节半桥粒的的形成;半桥粒是基底细胞表面的粘附结构[1-4]。有研究发现,整合素β4在上皮性卵巢癌细胞中的表达也有增高,随着恶性程度的增高,其表达也增高。整合素β4在多种肿瘤中均有较高的表达,与肿瘤细胞的恶性程度相关,可以作为肿瘤的早期靶点候选标志物[5]。在本研究中,将相同病理类型的上皮性卵巢癌细胞,进行培养后提取蛋白进行蛋白电泳检测随着上皮性卵巢癌细胞整合素β4表达程度,探讨DMSO对肿瘤细胞的恶性质及黏附性有什么影响。
1 实验方法
1.1 TOV-112D细胞的常规培养
人卵巢癌细胞系TOV-112D细胞为贴壁生长的细胞,用1640培养基+10%胎牛血清(FBS),置于37℃,5%CO²培养箱中培养,待细胞密度达到70%左右,即可进行后续实验的处理。
1.2 细胞蛋白的提取
吸尽 PBS,每皿(6 cm 皿)加入80 uL预冷的细胞裂解液(RIPA),摇晃培养皿使其充分覆盖细胞,于冰上匀速摇晃裂解约10 min。RIPA中加入蛋白酶抑制剂(PMSF)(RIPA:PMSF=100:1)。
将细胞碎片和裂解液移至1.5 mL离心管中。在高速冷冻离心机中4℃,12000 r/min,离心20 min;离心,上清转移到0.5 mL的离心管中,放于-80℃保存。
1.3 蛋白含量的测定(BCA 蛋白浓度测定试剂盒)
按50倍体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混匀。BCA工作液室温24 h 内稳定(A:3750 μL,B:75 μL)。完全溶解蛋白标准品,取10 μL稀释至100 μL,终浓度为0.5 mg/mL。
用RIPA裂解液90 μL+10 μL标准品,将标准品按0,1,2,4,8,12,16,20 μL加到96孔板的标准品孔中,加用于稀释标准品的溶液(RIPA 强)补足到20 μL。加适当体积样品到96孔板的样品孔中,加用于稀释标准品的溶液至20 μL(1 μL样品+19 μL RIPA强)。各孔加入200 μL BCA工作液,用恒温培养振荡器37℃,80r放置30 min。
1.4 SDS-PAGE 电泳和蛋白质印迹(Western blot)分析
1.4.1 SDS-PAGE 电泳
待到积层胶凝固后,组装电泳设备并处理样品:将蛋白样品定量后,用上样缓冲液按照上样量稀释样品(蛋白量:30~60 µg),将制好的样品100℃加热变性5 min,瞬时离心,备用。用20 µL加样枪贴壁按预定的顺序加样,制样量为20 μL/孔。未上样的上样孔加入等量的1×样品缓冲液对照。积层胶电泳电压为80 V,分离胶电泳电压为120 V。电泳总时间2 h左右当指示剂溴酚蓝电泳至底部时,终止电泳。
1.4.2 蛋白质印迹曝光
选择PVDF膜亲水性好的一面贴胶。通电转膜,电流要求恒流300 mA,转膜时间为1 h左右。轻轻用眼科镊取出PVDF膜,将膜放在TBST中,在室温下摇床上匀速清洗3次,每次5 min。
在室温下孵育2~3 h或者于4℃冰箱中过夜孵育一抗后,在摇床上用TBST将PVDF膜清洗3次,5 min/次;将同一张PVDF膜于室温下孵育二抗,孵育1 h(当二抗与一抗接合后可以根据二抗所携带的标记而显示出一抗的位置);摇床上用TBST将膜清洗3 次,5 min/次。通过曝光仪,将PVDF膜上的蛋白进行扫描显影后获取其图像并统计分析。
2 结 果
经Western blot检测(图1),各泳道在205 kDa处各有一条条带,即整合素β4。随着细胞培养密度的增加,整合素β4的条带灰度值明显降低。与1泳道相比,整合素β4在2泳道的灰度值降低,有显著性差异,差异有统计学意义(P<0.05),表明DMSO可使细胞整合素β4的表达降低,抑制细胞的黏附,增加细胞迁移的可能性。
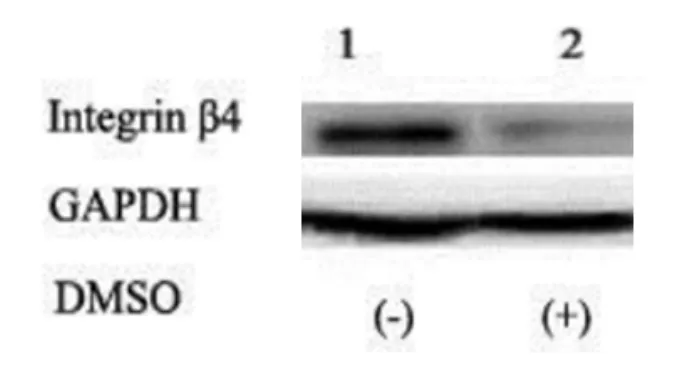
3 结 论
有研究表明DMSO 具有细胞毒性。本实验通过DMSO对卵巢癌细胞的研究,进一步证明了DMSO可以通过诱导整合素β4下调,进而抑制肿瘤细胞的迁移扩增,增加肿瘤的恶病质。
