多囊卵巢综合征肥胖与性激素及糖脂代谢紊乱的相关性
2019-10-21曾春
曾春
【摘 要】目的:探讨多囊卵巢综合征(PCOS)患者肥胖与性激素及糖脂代谢紊乱的相关性。方法:记录76例PCOS患者(其中肥胖者37例,非肥胖者39例)和75例对照组身高和体重,计算体重指数(BMI),采用化学发光免疫分析法检测AMH、LH、FSH、PRL、Prog、E2和Testo;采用全自动生化分析仪检测FPG、TC和TG。比较两组间BMI、血糖、血脂指标的差异并分析各项指标间相关性。结果:PCOS组AMH、LH、PRL、Prog、E2、Testo、FPG、TC和TG等均显著高于对照组(P均<0.05);PCOS组中肥胖者BMI、FPG显著高于非肥胖者(P均<0.05);BMI分别与AMH和FPG呈显著负相关和正相关(P均<0.05)。结论:PCOS患者存在肥胖且与激素分泌异常和糖脂代谢紊乱密切相关。
【关键词】多囊卵巢综合征(PCOS);体重指数(BMI);抗苗勒管激素(AMH);糖脂代谢
【中图分类号】R711 【文献标识码】A 【文章编号】1672-3783(2019)12-0040-02
多囊卵巢综合征(Polycystic ovary syndrome,PCOS)是臨床妇科十分常见的青春期及生育期女性的内分泌代谢紊乱疾病,主要以卵巢多囊样改变、稀发排卵、高雄激素血症为特征[1]。PCOS发病原因不明,临床表现多样,呈多系统广泛迁延,对机体造成严重的潜在危害,尤其与激素、血脂和血糖代谢紊乱密切相关[1]。肥胖对PCOS患者的病理生理影响重大[2]。本文现以在我院治疗的76例PCOS患者为研究组,探讨PCOS患者激素和生化指标的变化并进行各项指标的相关性分析,着重分析了肥胖对PCOS患者的影响,现报告如下。
1 资料与方法
1.1 研究对象
收集2018.01~2019.06期间就诊于伍佑中心卫生院妇产科的PCOS患者共76例,年龄16~37(25.03±4.72)岁。PCOS的诊断按照2012年中国卫生行业诊断标准:即把月经不规律、稀发排卵、排卵障碍作为诊断的必须条件。另外,再符合下列两项中的一项:①具有高雄激素表现和/或高雄激素血症;②盆腔超声检查提示一侧或双侧卵巢有直径2~9mm的卵泡≥12个和/或卵巢体积≥10cm3。同时需要排除排卵障碍的疾病及其他可能引起高雄激素的疾病[3]。收集同期在我院正常体检或因输卵管因素、男性因素不孕的就诊患者作为对照组共75例,年龄19~36(26.16±2.52)岁,纳入标准:①月经周期25~35d;②每侧卵巢基础窦卵泡数为5~12枚。所有研究对象均排除:①合并其他内分泌疾病,如甲状腺功能异常和高泌乳素血症;②合并严重高血压、糖尿病或重要器官功能不全者;③合并神经精神类疾病;④近3个月使用影响糖脂代谢、性激素水平的药物。两组一般资料比较差异无统计学意义(P>0.05)。本研究经本院伦理委员会批准,所有患者均在知情同意的情况下参与本研究并签署知情同意书。
1.2 观察指标和检测方法
所有纳入研究的对象均记录身高和体重,计算体重指数(BMI);并在自然周期或相当于自然周期的第2~3日空腹抽取静脉血5ml,静置0.5h,3200g/min离心,分离血清,当日进行血清激素和生化指标的检测。血清抗苗勒管激素(AMH)、黄体生成素(LH)、促卵泡生成素(FSH)、泌乳素(PRL)、孕酮(Prog)、雌二醇(E2)和睾酮(Testo)的测定采用贝克曼DXI-800全自动化学发光免疫分析仪及配套试剂检测。空腹葡萄糖(FPG)、总胆固醇(TC)、甘油三酯(TG)采用贝克曼AU5800全自动生化分析仪及配套试剂检测。每日进行血清学质量控制的检测,质控合格后方发放当日结果报告,以保证检验结果的准确性。
1.3 统计学方法
采用SPSS20.0统计学软件进行数据分析,计量资料采用均数±标准差( )表示,组间均数比较采用独立样本t检验;相关性分析采用Pearson线性相关分析,以双侧显著性检验P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较
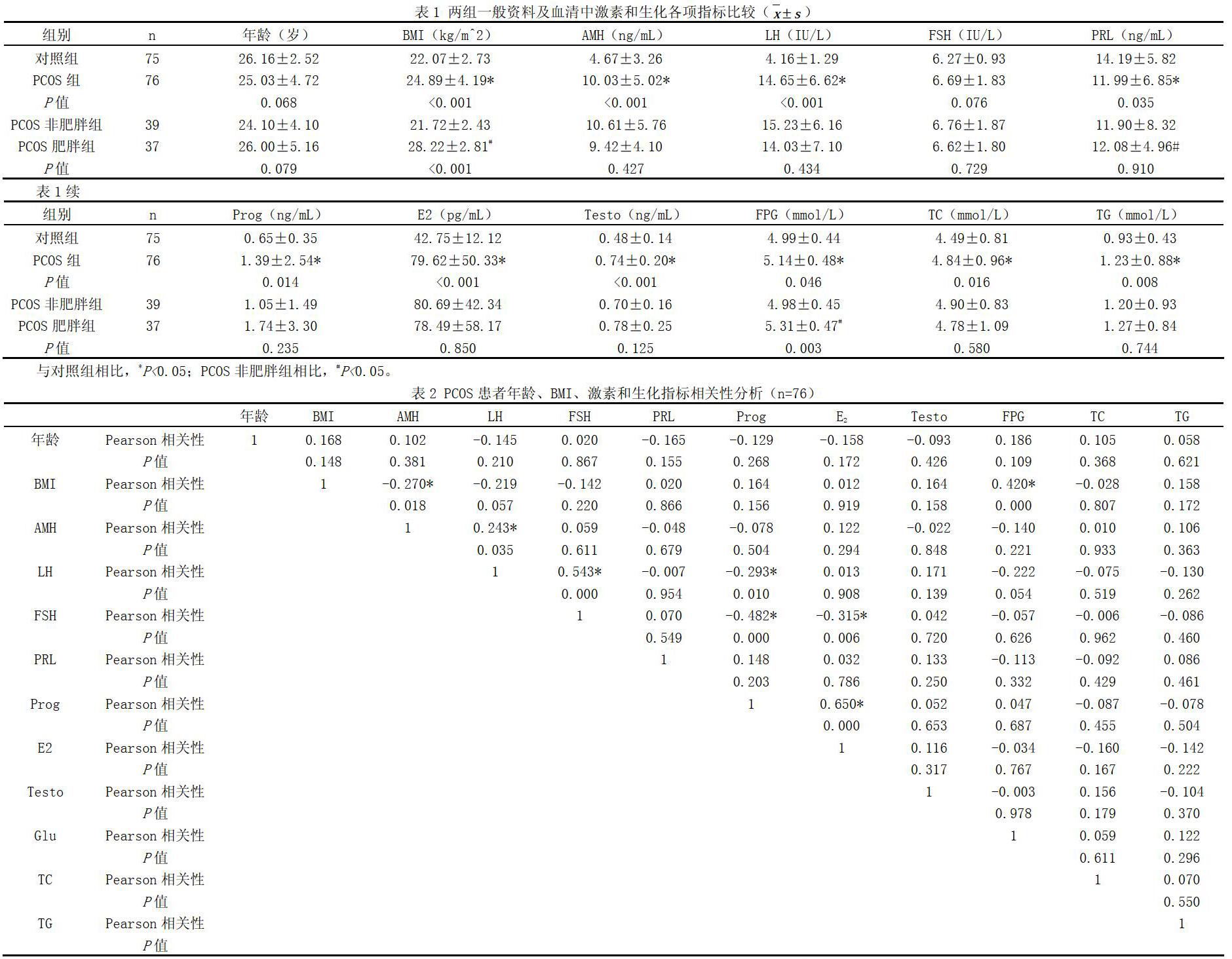
共收集76名PCOS患者和75名对照组,其中PCOS患者中有37名肥胖和39名非肥胖患者,两组间年龄无统计学差异(P>0.05),PCOS组BMI显著高于对照组(P<0.05)。见表1。
2.2 两组血清中激素和生化各项指标比较
PCOS组AMH、LH、PRL、Prog、E2、Testo、FPG、TC和TG等均显著高于对照组(P均<0.05),PCOS组和对照组间FSH无显著性差异(P>0.05)。PCOS组中肥胖者BMI、FPG显著高于非肥胖者(P均<0.05)。PCOS患者内肥胖与非肥胖者间AMH、LH、PRL、Prog、E2、Testo、TC和TG等均无明显差异(P均>0.05)见表1。
2.3 PCOS患者年龄、BMI、激素和生化指标相关性分析
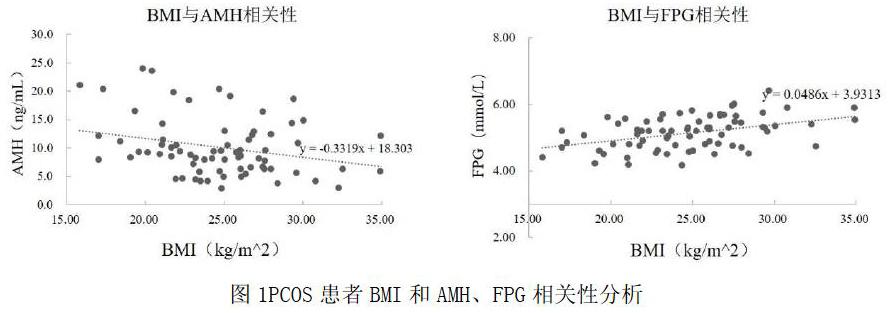
分析PCOS患者年龄、BMI、激素和生化指标之间的相关性,发现BMI和FPG、AMH和LH、LH和FSH、Prog和E2呈显著正相关(P均<0.05);BMI和AMH、LH和Prog、FSH和Prog、FSH和E2呈显著负相关(P均<0.05)。见表2。进一步重点关注BMI与其他指标间的相关性,可见BMI分别与AMH和FPG呈显著负相关和正相关(P均<0.05)。见图1。
3 讨论
PCOS是内分泌系统的常见病、多发病,其发病率为6%~15%,发病年龄也呈低龄化趋势,目前已成为内分泌疾病分类中的重要分枝[4]。由于PCOS疾病具有临床表现异质性、不可治愈性和进展性发展三大特征,在特定的早期阶段PCOS患者极易漏诊或误诊,以致延误最佳治疗时机[5]。为了尽早发现、尽快治疗以及改善预后,通过实验室检测相关指标来进行健康筛查并指导成为必要的方式。
PCOS患者最重要的临床特征之一是雄激素水平升高[2]。本研究结果亦发现,PCOS组LH、PRL、Prog、E2和Testo等均明显高于对照组,差异具有统计学差异(P均<0.05),与相关研究报道一致[6, 7]。分析原因可能是卵泡内高雄激素环境抑制雄激素向雌激素转化,并且PCOS患者的胰岛素抵抗状态可刺激卵巢和肾上腺分泌雄激素,从而加重PCOS患者的高雄激素血症[8]。
本研究结果发现,PCOS组血脂、血糖明显高于对照组,此与诸多国内外报道一致[7, 9-11]。郑思远等[12]亦发现PCOS患者存在血脂紊乱,主要为TG、TC、LDL-C 升高及HDL-C下降。随年龄增加,血脂紊乱的PCOS患者心血管疾病危险明显升高,患T2DM风险也较正常人增加5~10倍[13],可见PCOS持续性激素紊乱可造成靶组织和靶器官损害,尤其与血糖、血脂异常密切相关。
值得注意的是,本研究结果显示PCOS患者BMI显著高于对照组,证实了肥胖是PCOS的重要临床表现之一[2]。进一步比较PCOS患者内肥胖者与非肥胖者之间上述激素和生化指标的差异时发现肥胖的PCOS患者FPG显著增加,此是由于肥胖导致胰岛素分泌水平下降,血糖清除率下降,从而导致血糖升高甚至糖尿病。但其它指标在PCOS患者内肥胖者与非肥胖者之间并无显著性差异,此与阴红等研究结果不同[9]。分析原因一方面可能是PCOS患者多年轻,机体代偿功能相对较好,肥胖对PCOS患者机体的影响可能最先出现的是血糖异常,而激素和血脂代谢紊乱可能随后才发生;另一方面可能是由于PCOS患者肥胖程度不同对激素、糖脂水平的影响不同[14]。除此之外,亦有可能与入选对象和样本量有关,相关结果需要进一步深入研究证实。
AMH主要由颗粒细胞分泌,属于转化生长因子β超家族成员,可准确反映卵巢窦卵泡数目和原始卵泡库存情况[6]。本研究结果显示,与对照组相比,PCOS患者AMH水平显著升高,与相关文献报道一致[15, 16]。提示PCOS患者AMH异常增加导致窦卵泡和优势卵泡生长发育异常和排卵障碍[15, 16]。进一步分析发现PCOS患者中BMI与AMH呈显著负相关,说明肥胖加剧了PCOS患者的卵泡发育异常和排卵障碍;另外BMI和FPG呈显著正相关,尽管这些PCOS患者的FPG水平仍在正常范围,但肥胖显著提高了血糖水平,从而增加了罹患糖尿病的风险,这是由于肥胖者易存在胰岛素抵抗。从BMI影响AMH和FPG的角度来看,体重是引起PCOS患者体内激素、血脂变化的重要因素,因此改善生活方式,降低体重可对PCOS患者机体代谢起到全方位的调整。
总之,PCOS与体重、激素、血糖及血脂等诸多因素相关,密切监测相关指标对指导PCOS疾病的防治有极其重要的临床意义。另外,在PCOS患者中,随着体重指数的增长,血清AMH水平下降而血糖水平增加,说明体重在PCOS患者中起着举足轻重的作用。因此, 定期监测激素水平、血糖和血脂状况,使用合理的措施降低体重对PCOS患者进行干预和治疗,对延缓PCOS的进展可起到一定积极的作用。
参考文献
[1] Wang A, Mo T, Li Q, et al. The effectiveness of metformin, oral contraceptives, and lifestyle modification in improving the metabolism of overweight women with polycystic ovary syndrome: a network meta-analysis[J]. Endocrine, 2019,64(2):220-232.
[2] Glueck C J, Goldenberg N. Characteristics of obesity in polycystic ovary syndrome: Etiology, treatment, and genetics[J]. Metabolism, 2019,92:108-120.
[3] 多囊卵巢综合征诊断中华人民共和国卫生行业标准[J]. 中华妇产科杂志, 2012,47(1):74-75.
[4] Yildiz B O, Bozdag G, Yapici Z, et al. Prevalence, phenotype and cardiometabolic risk of polycystic ovary syndrome under different diagnostic criteria[J]. Hum Reprod, 2012,27(10): 3067-3073.
[5] Yildiz B O, Bozdag G, Yapici Z, et al. Prevalence, phenotype and cardiometabolic risk of polycystic ovary syndrome under different diagnostic criteria[J]. Hum Reprod, 2012,27(10): 3067-3073.
[6] 杨毅. 多囊卵巢综合征患者血清抗苗勒氏管激素水平与胰岛素抵抗及雄激素的相关性研究[J]. 解放军医药杂志, 2018,30(04):72-74.
[7] 赵晓苗, 李琳, 陈晓莉, 等. 伴有高雄激素血症的多囊卵巢综合征患者患有Ⅱ型糖尿病和肥胖的风险升高[J]. 中华生殖与避孕杂志, 2017,37(12):969-974.
[8] 张欣, 邓琳琳. 雄激素抑制剂对PCOS患者血清AMH等指标的影响初探[J]. 现代妇产科进展, 2012,21(06):482-483.
[9] 阴红, 吴桂芳. PCOS患者血清FABP4水平与糖脂代谢紊乱的相关性[J]. 山东医药, 2014,54(30):17-19.
[10] 党菲. 控制胰岛素抵抗改善多囊卵巢综合征患者性激素与血脂代谢的效果[J]. 中国妇幼保健, 2018,33(19):4388-4392.
[11] Wild R A. Dyslipidemia in PCOS[J]. Steroids, 2012,77(4):295-299.
[12] 郑思远, 张莹, 龙涛, 等. 不同胰岛素抵抗及肥胖水平对多囊卵巢综合征患者高雄激素血症特征的影响[J]. 广东医学, 2017,38(3):406-409, 413.
[13] 劉佳, 俞楚仪, 马红霞, 等. 多囊卵巢综合征远期并发症及防治的研究进展[J]. 国际生殖健康/计划生育杂志, 2018,37(02):172-176.
[14] Yang S, Wang Q, Huang W, et al. Are serum chemerin levels different between obese and non-obese polycystic ovary syndrome women?[J]. Gynecol Endocrinol, 2016,32(1):38-41.
[15] 武雁, 宋晖, 田国华, 等. 抗苗勒氏管激素与多囊卵巢综合症治疗效果的相关性[J]. 四川生理科学杂志, 2016,38(02):72-74.
[16] 娄英, 王烈宏, 董艳, 等. 高原地区多囊卵巢综合征患者抗苗勒氏管激素与临床检测指标的相关性分析[J]. 中国妇幼保健, 2017,32(21):5378-5381.