轻松应对电化学知识的小秘诀
2019-10-21孙竹先
孙竹先
(云南省宣威市第一中学,云南 宣威 655400)
电化学知识是高考的必考知识点,无论解答何种复杂的题目,都必须牢记基本概念,而且要记清,不能混淆。下面我将跟大家分享我自己的解题方法和思路。
一、原电池(放电装置):化学能转化为电能的装置为原电池,从理论上说,任何一个自发的氧化还原反应均可设计成原电池。
(一)电极的判断方法:
①还原剂(化合价升高,失去电子,发生氧化反应)为负极,氧化剂(化合价降低,得到电子,发生还原反应)为正极。
②在原电池电解质溶液中:e-由负极流向正极,且电解质溶液中没有e-的移动。电解质溶液中阳离子移向正极,阴离子移向负极,简而言之在原电池中带何种电荷就移向何极。
(二)电极反应式的书写:
①已知总反应方程式:哪个极好写就先写哪个极,再用总的减去已经写好的电极,即可得到另一个电极,值得注意的是正负极得失电子数一定要相等。
②如果没有总反应方程式:那么先分析题目,判断元素化合价的升降,写出反应物和生产物,再根据电荷守恒和原子个数守恒写出电极反应式。
具体例子如下:

例1:Al-AgO 电池广泛应用于鱼雷电池,其原理如右图所示。下列有关说法正确的是( ).
A.A g/AgO为电池正极,放电时发生氧化反应
B.Al 电极反应为Al+4OH--3e-=AlO2-+2H2O
C.放电时OHˉ通过隔膜向正极移动
D.当消耗2.7gAl 时,有10.8gAg 生成
解析:原电池中负极发生氧化反应,正极发生还原反应,A 错误;Al化合价升高为负极,电极反应为Al+4OH--3e-=AlO2-+2H2O,B 正确;在原电池电解质溶液中,阳离子移向正极,阴离子移向负极,C 错误;依据正负极得失电子数一定要相等可以求出:
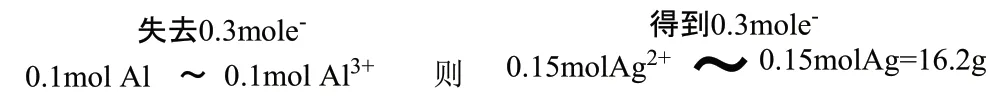
答案:B
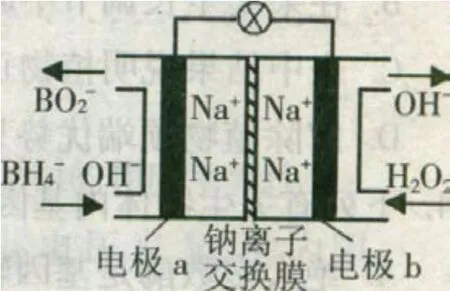
例2:某新型电池,以NaBH4(B 的化合价为+3 价)和H2O2 作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示。下列说法正确的是:()
A.电池工作时Na+从b 极区移向a 极区
B.每消耗3molH202,转移3mole-
C.b 极上的电极反应式为:H202+2e-+2H+=2H20
D.a 极上的电极反应式为:BH4-+80H--8e-=B02-+6H20
解析:我们看图可以知道电极b 发生H2O2,其中O 元素的化合价降低,发生了还原反应,应作正极,电极反应式为H202+2e-=2OH-,B C错误;b为正极,a 就为负极,在原电池电解质溶液中,阳离子移向正极,Na+从a极区移向b极区,A错误;排除法选D,a极上的电极反应式的确为:BH4-+80H--8e-=B02-+6H20。(写此反应遵循原子守恒和电荷守恒)
答案:D
例3.锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH 溶液,反应为2Zn+O2+4OH-+2H2O=2Zn(OH)2-4。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:Zn+4OH--2e-= Zn(OH)2-4
D.放电时,电路中通过2mol 电子,消耗氧气22.4L(标准状况)
解析:此题已知总反应方程式,通过化合价判断Zn为负极,O2为正极,电解质溶液是碱。
负极反应式是:Zn+4OH--2e-= Zn(OH)2-4,正极反应式是:O2+4e-+2H2O=4OH-
所以秒杀此题答案为C.
二、电解池(充电装置):电能转化为化学能的装置为电解池,它是一个非自发的氧化还原反应。
(一)电极的判断方法:
①与电源负极相连的电极为阴极,与电源正极相连的电极为阳极。
阳极放电: 1)惰性电极:则溶液中阴离子放电。
2)非惰性电极:电极材料首先失电子。
放电顺序为:金属 > S2->I->Br->Cl->OH-(水) >含氧酸根>F-
阴极放电:电极材料受保护,溶液中阳离子放电。
放电顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+> Mg2+>Na+>Ca2+> K+
②化合价升高,发生氧化反应的是阳极;化合价降低,发生还原反应的是阴极。
③在电解池溶液中,阳离子移向阴极,阴离子移向阳极,且电解质溶液中没有电子的移动。
(二)电极反应式的书写与原电池的思路一样。
具体例子如下:
例4:如图所示的装置C、D、E、F、X、Y 都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F 附近显红色,则以下说法正确的是:

A.电源B 是正极
B.甲、乙装置的C、D、E、F 电极均有单质生成,其物质的量之比为1:2:2:2
C.欲用丙装置给铜镀银,H 应该是Ag,电镀液是AgNO3 溶液
D.装置丁中Y 极附近红褐色变深,说明氢氧化铁胶粒带负电荷
解析:由题目信息可知F 附近显红色,则F 极有OH-,那么就有H20电离产生的H+放电,所以F 极为阴极,电极反应式为依据串联电路,可知E为阳极、D为阴极、C为阳极,电源A为正极、电源B为负极、Y为阴极、X为阳极、H为阴极、G为阳极,由此可知A 错误;Y为阴极,阳离子移向此极,Y 极附近红褐色变深,说明氢氧化铁胶粒带正电荷,所以D 错误;用丙装置给铜镀银,牺牲Ag,被氧化,Ag 作为阳极,应该在G极;C 阳极反应式为:D 阴极反应式为Cu2++2e-=Cu:E 阳极反应式为:根据串联电路电路中得失电子相等可知O2:Cu:Cl2:H2=0.5:1:1:1=1:2:2:2,所以B 正确。
答案:B
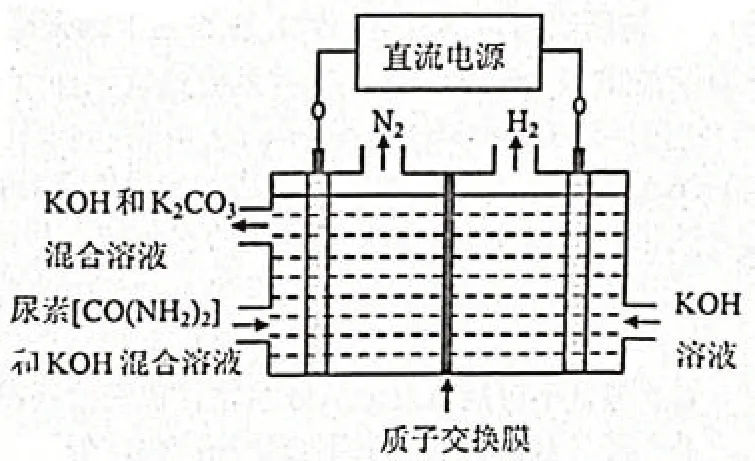
例5:如右图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 _____________________,阴极的电极反应式为_____________________;若两极共收集到气体22.4L(标准状况),则消耗的尿素为 g(忽略气体的溶解)。
例6:N2O5是一种新型硝化剂,其性质和制备受到人们的关注。现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。

写出石墨I 电极上发生反应的电极反应式:
在电解池中生成N2O5 的电极反应式为:
解析:看图我们知道左边是燃料电池,总反应方程式为:2H2+O2=2H2O,氧气为正极,考虑到电解质是熔融盐Na2CO3,电极反应式为:O2+2CO2+4e-=2CO32-;石墨Ⅰ为负极,用总的方程式减去正极即可得到,电极反应式为:H2+CO32--2e-=CO2+H2O。
看图我们知道右边是电解池,石墨Ⅱ为正极,与之相连的Pt为阳极,该极发生氧化反应,又是在无水体系条件下,所以电极反应式为:(写此反应遵循原子守恒和电荷守恒)。
