城市景观水体中固氮微生物多样性及固氮活性检测
2019-10-18卢韩杨潘文静马晓洁
卢韩杨 潘文静 马晓洁 李 勤 刘 洋
(河南师范大学生命科学学院, 新乡 453007)
随着中国城镇化进程的加速, 城市基础建设不断完善, 城市景观水体不仅兼顾了蓄水防洪等生态功能, 更是市民休闲娱乐的场所。人为影响导致了其水质变化较大, 富营养状况不容乐观。牧野湖是位于河南省新乡市的一个人工湖, (N35°18′13.71″,E113°55′15.05″), 与贯穿新乡市区的卫河相连, 总面积约2.23×105m2, 平均水深约1.5 m; 人民公园水域相对独立, 面积约1.9×104m2。两水体水流较为缓慢, 水体的水质较差, 已有研究对牧野湖的浮游植物分布[1]进行了报道, 长期的监测发现两水体在夏季均会出现蓝藻水华, 主要以单细胞和丝状蓝藻为主[2]。
生物固氮是地球氮素循环中重要的环节, 目前已知的固氮生物主要限于原核生物, 而固氮蓝藻便是其中一个类群[3,4]。富营养水体中的固氮类群种类多样, 且不同水体具有地域差异, 虽然固氮过程对于固氮微生物而言是一个主动耗能的过程[5], 但在富营养水体仍具有微弱的固氮效率[6], 在这其中固氮微生物与固氮蓝藻的贡献如何, 目前报道较少,本研究选取了两个城市小型景观水体, 借助高通量测序手段来研究其内部固氮微生物类群组成及多样性情况, 并对水体进行了原位固氮率的检测, 来综合评估固氮微生物的固氮作用及固氮蓝藻可能的贡献。
1 材料与方法
1.1 水样采集和理化指标测定
在新乡市牧野湖和人民公园水体各设置3个采样点(图 1), 采样时间为2016年8月, 用2 L采水器对水体采样, 将水样带回实验室进行微孔滤膜(Millipore, 0.2 μm)过滤, 过滤200 mL用于DNA提取。水体的理化指标: 总氮(TN)、总磷(TP)、氨氮(-N)、化学需氧量(COD), 使用紫外可见多参数水质测定仪(连华科技, 北京)进行测定, 水温、pH和透明度均为现场测定。
1.2 16S rDNA和nifH基因高通量测序
滤膜总DNA的提取采用CTAB法[7], 提取的DNA保存于-20℃, 用于PCR及高通量测序实验。为确定两个水体中原核生物群落的多样性, 采用16S通用引物341F(5′-CCTAYGGGRBGCASCAG-3′)和806R (5′-GGACTACNNGGGTATCTAAT-3′)[8], 固氮微生物多样性检测选用通用引物nifH1(5′-TGYGAYCCNAARGCNGA-3′), nifH2 (5′-ADNGCCATCATYTCNCC-3′)[9], 借助Illumina HiSeq测序平台, 测序量不低于总量(50000)的98%,得到的具有某些干扰数据的原始数据, 对原始数据进行一定的过滤, 就可以整理出有效数据, 这样结果更准确无误。将相似度>97%的有效序列, 可以划分为一类, 作为1个分类操作单元(Operational Taxonomic Units, OTU)。根据OTU对物种的种类进行说明, 得到物种种名信息, 对物种进行分类。从不同层次(门、纲、目、科、属、种)对物种进行多样性及所占比例进行计算[10,11]。运用Origin9.1软件进行作图, 不同水平层次的物种的相对丰度柱状图。采用Qiime17.0进行Shannon指数、Chao1指数、ACE指数、Coverage指数的计算, 根据指数值的大小可以反映出采样点的水体群落内生物多样性。
1.3 水体固氮作用检测
本实验采用乙炔还原法对水体微生物固氮作用进行检测[12]。将一定量的样品放入300 mL培养瓶中, 使气液比为1:5, 塞上胶塞, 抽出2 mL空气后,立即注入相同体积的纯乙炔气体, 放入培养室, 模拟当地温度和光照, 培养2h后, 用微量注射器抽取100 μL进样检测。通过气相色谱仪确定标准曲线,并以实验室培养的固氮蓝藻鱼腥藻PCC 7120作为对照。使用气相色谱仪为Thermo TRACE 1300, 填充柱(GDX-502, 中科凯迪化工), 检测器为FID检测器, 对样品进行检测分析。
2 结果
2.1 水体理化指标
水体中氮磷含量是表征水体富营养化的重要指标, 从表 1可以看出牧野湖和人民公园的总氮、总磷含量均处于水体富营养化状态(总氮含量0.3 mg/L、总磷含量0.05 mg/L)[13], 牧野湖和人民公园水体温度相差不大, 水体pH均呈碱性。人民公园水体化学需氧量明显比牧野湖的高, 其水体透明度则相对较低, 表明人民公园水体受有机物质的污染更严重,这可能与牧野湖水体具有流动性, 而人民公园水体相对封闭有关。牧野湖和人民公园所表现出严重的富营养化状态以及碱性的水环境可能是水华暴发的主要因素[14]。
2.2 测序结果分析

图 1 牧野湖和人民公园采样点分布Fig. 1 Sampling sites of Muye Lake and People’s Park

表 1 各采样点理化指标结果Tab. 1 Physical and chemical index of each sampling site
16S rDNA高通量测序结果 通过高通量测序技术对水体细菌的16S rDNA的V3-V4可变区进行测序。为了提高后期测序信息分析的结果的准确性, 对原始数据进行过滤处理之后, 最终得到148507条有效序列。牧野湖和人民公园测序得到的有效序列分别是73879条 (表 2)、74628条。对所有样品具有97%的相似性的序列聚类成一个OTU,两个水体的有效序列共划分出1982个OTU, 其中牧野湖划分出983个OTU, 人民公园划分出999个OTU。牧野湖的OTU数略低于人民公园。
对两个水体从门到属依次进行分类(表 2), 牧野湖的细菌有32个门、60个纲、107个目、186个科、275个属。人民公园的细菌有31个门、55个纲、101个目、171个科、238个属。
nifH基因高通量测序结果 高通量测序得到180899条有效序列。牧野湖和人民公园测序得到的有效序列分别是92537条、88362条。两个水体的有效序列共划分出1408个OTU, 其中牧野湖划分出1208个OTU, 人民公园划分出200个OTU。牧野湖的OTU数量远远高于人民公园。对两个水体从门到属依次进行分类(表 3), 牧野湖的固氮微生物有9个门、15个纲、32个目、43个科、66个属。人民公园的固氮微生物有4个门、9个纲、9个目、10个科、13个属。
2.3 水体细菌群落结构
牧野湖、人民公园水体中相对丰度最高的菌群是变形菌门分别占59%和43%, 牧野湖中相对丰度较高的依次有拟杆菌门和蓝藻门, 分别占17%和13%; 人民公园水体中相对丰度较高的依次有拟杆菌门、放线菌门和蓝藻门, 分别占15%、15%和10%, 在牧野湖水体中的放线菌门所占比例仅为4%。变形菌门在2个水体中都占据了绝对优势, 牧野湖蓝藻所占比例较人民公园相对高一些。其中厚壁菌门和绿弯菌门也均存在于2个水体中(图 2A)。
在纲水平上对丰度前10的细菌进行分类。图 2B表明: 牧野湖和人民公园水体中最有优势的细菌是α-变形菌纲(Alphaproteobacteria), 分别占24.9%和15.4%, 其次是β-变形菌纲(Betaproteobacteria), 分别占20.3%和12.9%。其中α-变形菌纲和β-变形菌纲在牧野湖中所占比例相对较高。
2.4 水体固氮微生物群落结构
如图 3A所示, 牧野湖中固氮微生物种类相对较丰富, 有变形菌门、蓝藻门和厚壁菌门等; 而人民公园固氮微生物种类较少, 主要有蓝藻门、变形菌门和未分类的一些微生物。其中牧野湖水样中固氮蓝藻占3%, 人民公园水样中固氮蓝藻占9.3%,2个水体中固氮蓝藻所占总体比例不高。
图 3B结果表明: 在目水平上, 牧野湖和人民公园的颤藻目分别占0.1%和0.06%, 念珠藻目分别占0.09%和0.001%。牧野湖中的色球藻目占0.01%, 真枝藻目占0.009%。牧野湖中固氮蓝藻物种多样性高于人民公园。
2.5 水体细菌群落和固氮微生物群落组成差异
细菌群落组成差异 通过多样性指数可以反映出样本的丰富度和均匀程度。从表 4可以看出: 2个水体的覆盖率指数均在99%以上, 说明此次测序比较接近样本真实情况。通过Chao1、ACE、Shannon、Simpson指数可知, 人民公园的细菌群落相对较丰富, 细菌群落多样性相对较高, 和OTU结果一致。结果表明水体细菌多样性和丰富度应该和水体水质有一定关系。

表 2 细菌16S rDNA序列分析Tab. 2 Sequence analysis of bacterial 16S rDNA
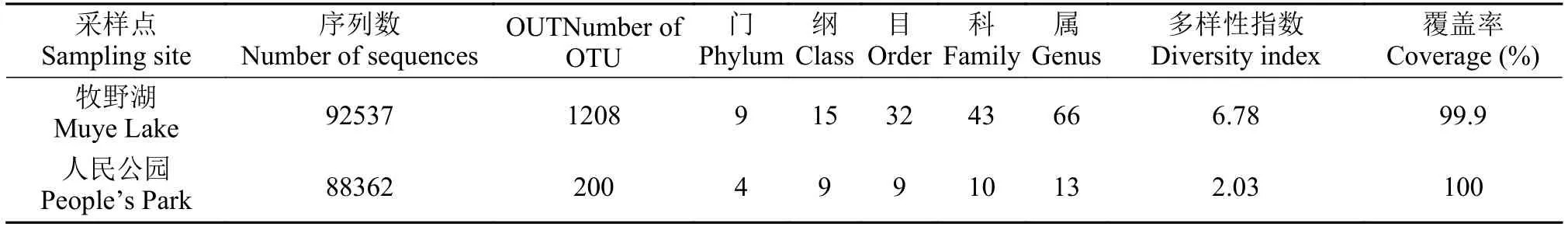
表 3 各采样点固氮微生物序列分析Tab. 3 Sequence analysis of nitrogen-fixing microorganisms in different sampling sites

图 2 各采样点门水平(A)优势细菌分布与纲水平(B)优势细菌分布Fig. 2 The dominant bacteria in each samling site at phylum level (A) and class level (B)

图 3 门水平(A)与目水平(B)固氮微生物丰度Fig. 3 Richness of nitrogen-fixing microbial at phylum level and order level

表 4 细菌群落Alpha多样性指数Tab. 4 Alpha diversity indexes of bacterial community
图 4A结果表明: 人民公园的Rank Abundance曲线相对比牧野湖的曲线宽, 说明人民公园的物种组成较丰富, 此结果与Chao1、ACE指数相一致。牧野湖和人民公园的Rank Abundance曲线相对较平缓, 两者物种组成比较均匀, 物种分布均匀程度相差不大。
根据所有样品之间共有、特有的OTU进行韦恩图(Venn Graph)的绘制, 图 4B可知: 牧野湖和人民公园共有698个OTU, 牧野湖特有的232个OTU,人民公园特有301个OTU。这说明2个水体中物种组成相似度比较高。

图 4 Rank Abundance曲线(A)与基于OTU的venn图(B)Fig. 4 Rank Abundance Curve (A) and OTU-based venn Graph(B)
固氮微生物群落组成差异 从表 5可以看出: 2个水体的覆盖率指数均在99.5%以上, 说明此次测序比较接近样本真实情况。通过Chao1、ACE、Shannon、Simpson指数可知, 牧野湖的固氮微生物群落丰度和多样性均较高, 和OTU结果一致。
图 5A Rank Abundance曲线表明: 牧野湖的曲线相对比人民公园的曲线宽, 说明牧野湖的物种组成比较丰富, 此结果与ACE、Chao1指数相一致。牧野湖Rank Abundance曲线平缓, 说明固氮微生物群落组成比较均匀, 固氮微生物群落种类相对较丰富。人民公园Rank Abundance曲线陡然下降, 说明物种多样性低, 但其中优势固氮微生物所占比例并不高。
图 5B可知: 牧野湖和人民公园共有OTU 103个, 牧野湖特有1099个OTU, 人民公园特有97个OTU。牧野湖和人民公园共有OTU比较少, 说明2个水体物种组成差异性较大。牧野湖的特有OTU比较多, 说明牧野湖水体物种组成多样性更高。
2.6 水体固氮酶活检测
对野外采集的水样进行了原位培养, 并对其进行气体采集, 运用乙炔还原法进行测定。对照组为固氮鱼腥藻PCC7120, 培养条件相同。牧野湖和人民公园两个自然水体, 实验结果显示: 对照组鱼腥藻PCC7120能够将部分乙炔转化为乙烯(图 6A), 具有可检测的固氮酶活性, 2个样品组在相同的条件下均未出现乙烯峰, 未表现出固氮活性(图 6B、6 C)。推测在选取的样点中固氮活性较为微弱, 或固氮微生物并未表现出固氮能力。
3 讨论
目前, 水体富营养化形式依然较为严峻, 蓝藻水华在众多水体中存在, 长期的富营养化不仅对景观造成影响, 也对水体中的微生物等类群的演替产生影响[15,16]。固氮类微生物参与了地球上重要的氮素循环, 当环境中的氮源能够供给微生物生长,固氮作用可能会降低, 相反, 当环境中缺乏氮源, 或者环境中的氮源无法满足微生物生长的时候, 固氮类生物便会通过自身固氮系统进行[17—19]。然而目前发现的固氮微生物主要是原核类的, 其中蓝藻就是其中的一类, 蓝藻中的固氮蓝藻能够利用大气中的氮合成自身生长所需的氮素, 这一过程是一个主动耗能的过程, 固定一分子的氮需要8个电子和消耗16个分子ATP[3,20], 因此, 对于大部分具有固氮能力的蓝藻, 在氮(铵态氮和硝态氮)满足的条件下, 基本不发生固氮行为[21]。有研究发现, 固氮蓝藻能够降低湿地的除氮能力, 其所固定的氮能够满足部分非固氮蓝藻的生长[22], 说明固氮蓝藻的固氮能力较强。在大型水体中, 也发现固氮效率的时空特点及其环境影响因素。富营养化水体中的氮含量一般较高, 太湖氮年均含量为1.79—3.63 mg/L[23], 在高氮的情况下, 固氮微生物, 尤其是固氮蓝藻的固氮效率及其固氮贡献如何, 还不是很清楚。本研究所选取的两个水体, 均处于富营养化状态, 我们发现,固氮微生物类群(属)仍然占据一定比例(5%和24%),不同水体具有一定的差异, 同时, 我们还发现在这些固氮的类群中, 固氮蓝藻的比例为(3%和9.3%),推测固氮蓝藻在富营养水体中对水体的氮的贡献较小。虽然由于理化条件的不同, 两个水体的总的原核生物构成不相同, 固氮微生物的种类和数量也不同, 但固氮微生物在原核生物中的比例有共同趋势, 相对含量较低。对水体的原位固氮率检测发现,在本研究的2个小型水体中, 未检测出固氮酶活性,可能是水体的固氮活性较低, 仪器未检测出。张波等[6]研究发现固氮活性受温度影响较大, 但本研究中水样的检测主要在夏季, 因此, 水温可能不是影响固氮活性的因素, 这可能与景观水体受人为影响较大有关, 但通过本研究, 我们得出在富营养水体中, 固氮蓝藻对水体的氮贡献率较低。

表 5 固氮微生物群落Alpha多样性指数Tab. 5 Alpha diversity indexes of nitrogen-fixing microbial community

图 5 Rank Abundance曲线(A)与基于OTU的venn图(B)Fig. 5 Rank Abundance Curve (A) and OTU-based venn Graph(B)

图 6 乙炔还原法测定固氮酶活性Fig. 6 Determination of nitrogenase activity by acetylene reduction
