ERK-VEGF/MMP-9信号通路与胃癌细胞增殖、转移和侵袭的关联机制
2019-10-17刘健生洪楚原梁翩翩
刘健生,洪楚原,梁翩翩
胃癌是一类较常见的消化系统恶性肿瘤[1-2]。同时胃癌也是一种预后较差的恶性肿瘤之一,在全世界每年大概有20余万人死于胃癌,其中在我国,胃癌每年死亡人数高达15万,占全世界胃癌死亡人数75%。目前传统治疗对胃癌的治疗效果不佳,在发展中国家,大概有85%以上的胃癌病人在确诊后的两年内死亡[3-5]。迄今为止治疗早期胃癌等实体肿瘤最常用的手段之一仍然是进行外科手术切除[5]。虽然关于手术技术及器械都已经取得了很大的进步,但采用手术切除肿瘤引发肿瘤产生扩散这种不良后果依然没有得到改善。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)属于丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPKs)家族中的一员[7]。ERK介导的胞内信号转导在生长发育、细胞分化、神经元可塑性以及多类的生理病理过程中有十分关键的作用[8-10]。VEGF属于一种能够对血管功能以及肿瘤扩增进行维持的关键因子。在肿瘤组织中,VEGF的表达水平以及血清中VEGF的含量与恶性程度、肿瘤微血管密度以及肿瘤的转移情况呈现出高度的正相关关系[11]。基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)被广泛认为属于一种与肿瘤的转移以及侵袭性关系最为相关的金属蛋白酶,MMP-9可以对基底膜的完整性产生破坏,并对基底膜进行降解。在恶性肿瘤的侵袭以及转移过程中有十分关键的作用[12]。本研究通过特异性ERK-VEGF/MMP-9信号通路抑制剂GDC-0994及ERK1质粒转染干预ERK-VEGF/MMP-9信号通路,探究ERK-VEGF/MMP-9信号通路对胃癌细胞生长的分子机制。
1 材料与方法
1.1 实验材料
人胃癌细胞MGC-803,于美国典型培养物保存中心获取。纯丙泊酷购于Sigma公司,美国;佛波醇12-豆蔻酸13-乙酸酯[PMA] 购于SantaCruz生物技术公司,美国;ERK1/2 购于Cell Signaling 公司,美国;MMP-9 和 VEGF 购于Cell Signaling 公司,美国;PD98059购于Cayman化学公司,美国;山羊抗兔抗体购于Invitrogen公司,美国;山羊抗鼠抗体购于Invitrogen公司,美国;D98059购于Cayman化学公司,美国;二甲苯购于SIGMA,美国;胎牛血清购于FBS: Hyclone,Logan, UT,美国;苏木精购于SIGMA,美国;青霉素购于Invitrogen公司,美国;链霉素购于Invitrogen公司,美国;D-HankS缓冲液购于美国Gibeo公司;0.25%细胞消化胰蛋白酶溶液购于Giboo公司牛血清白蛋白(BSA)购于Sigma公司;低糖DMEM培养液购于美国Gibeo公司;ERK1质粒由深圳市默赛尔生物医学科技发展有限公司构建。
1.2 实验方法
1.2.1 细胞培养
MGC-803细胞在含有10%小牛血清以及1%青链霉素的RPMI-1640 培养液中进行贴壁生长,在37 ℃、5%CO2以及饱和湿度的培养箱内进行培养。在 3~4 d时进行一次传代,取对数生长期的细胞用于后续实验。
72个培养皿的细胞分为三组:对照组(n=24);阻断组(n=24);转染组(n=24)。对照组细胞不做任何干预;阻断组细胞应用特异性ERK-VEGF/MMP-9信号通路抑制剂GDC-0994对胃癌MGC-803细胞的ERK-VEGF/MMP-9信号通路进行抑制;转染组细胞转染ERK1质粒。
1.2.2 WST检测GDC-0994处理后细胞增殖力
当细胞生长到80%融合时,调整细胞浓度大概为5×104个/mL,在96孔板中进行接种,每孔200 μL (大概 104个细胞)。各孔内添加GDC-0994母液使细胞的终浓度为100 nmoL/L;阳性对照采取DMSO替代GDC-0994。每孔设计三个复孔。当细胞分别培养12、24、36、48以及72 h后,在各孔内添加5 mg/mL MTT液20 μL,放到37 ℃、5%CO2以及饱和湿度的培养箱内培养4 h,吸去孔内培养液,每孔添加200 μL DMSO。采取酶连免疫检测仪在550 nm处进行吸光值的测定。每孔取三个复孔平均值进行极端。计算各组细胞增殖抑制率:抑制率=(1-各处理组OD值/阳性对照组OD值)×100%。
1.2.3 细胞周期分布
MGC-803细胞以1.0×105个细胞/孔的密度于96 孔微量滴定板(Bio - Rad)中进行接种,并分别采用GDC-0994(100 nmoL/L,GDC-0994组)以及对照组分别培养24 h。培养后的细胞,然后采取500 μL 70% 的冷乙醇进行固定2 h。将MGC-803细胞中添加100 μL RNA 酶并在37 ℃的条件下进行温育30 min。然后,添加400 μL碘化丙啶(PI),并将细胞在4 ℃ 的条件下,进行避光反应30 min。将处理好的样品立刻进行流式细胞仪(FACScan,BD Biosciences)检测。采用CELL Quest 3.0 软件对凋亡细胞的百分比以及细胞周期进行分析。
1.2.4 Western blot 检测相关蛋白的表达
提取MGC-803细胞的总蛋白,加入RIPA 蛋白裂解液对总蛋白进行抽提,采用Bradford法对蛋白浓度进行分析,定量抽取30 μg 蛋白进行10%SDS-PAGE,将电泳分离后的蛋白转移至硝酸纤维素膜(PVDF)上,在室温的条件下,在5%脱脂牛奶中进行反应1 h,然后进行洗涤,分别加入一抗小鼠抗人ERK1/2单克隆抗体(1∶1 000);兔抗鼠MMP-9多克隆抗体(1∶1 000) 以及兔抗人VEGF单克隆抗体(1∶1 000) 后,在4 ℃条件下反应过夜.进行洗涤后加入二抗辣根过氧化物酶(HRP) 标记的山羊抗兔IgG(1∶10 000) 或者辣根过氧化物酶(HRP) 标记的山羊抗小鼠IgG(1∶10 000),在室温的条件下反应30 min,进行洗涤后,采取ECL 化学发光液进行反应1 min,采取全自动数码凝胶图像分析系统进行拍照观察。
1.3 统计学分析

2 结果
2.1 阻断ERK-VEGF/MMP-9信号通路对细胞生长的影响
阻断ERK-VEGF/MMP-9信号通路,发现MGC-803细胞增殖低于对照组和转染组,转染质粒ERK1则可提高MGC-803细胞增殖率,差异有统计学差异(P<0.05),三组分别两两比较均具有统计学意义(P<0.05),见表1。
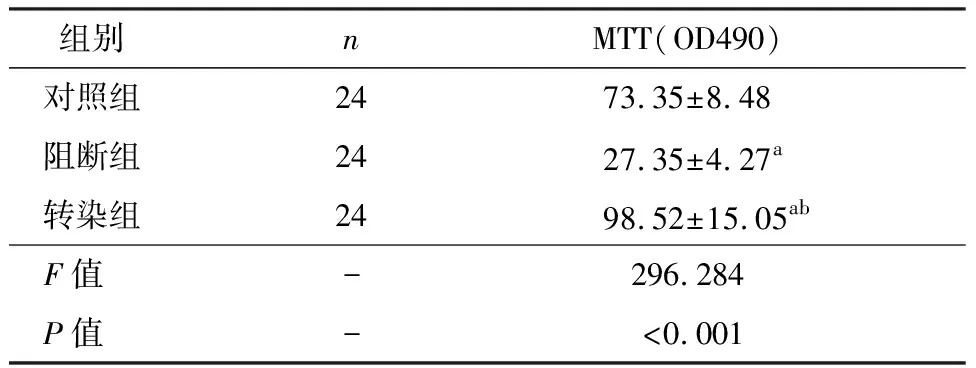
表1 三组MGC-803细胞增殖的比较
注:与对照组比较,aP<0.05;与阻断组比较,bP<0.05。
2.2 阻断ERK-VEGF/MMP-9信号通路对细胞周期的比较
阻断ERK-VEGF/MMP-9信号通路细胞培养72 h 后,其凋亡数量高于对照组,差异有统计学差异(P<0.05)。在G0 /G1 期,阻断ERK-VEGF/MMP-9信号通路后细胞凋亡数量与对照组比较,并无显著差异(P>0.05),而在S 期和G2 / M 期,阻断ERK-VEGF/MMP-9信号通路后细胞凋亡比率高于对照组,差异有统计学差异(P<0.05)。转染质粒ERK1后,其凋亡数量低于对照组,差异有统计学差异(P<0.05)。在G0 /G1 期,阻断ERK-VEGF/MMP-9信号通路后细胞凋亡数量与对照组比较,无显著差异(P>0.05);而在S 期和G2 / M 期,阻断ERK-VEGF/MMP-9信号通路后细胞凋亡率低于对照组,差异有统计学差异(P<0.05),三组分别两两比较均具有统计学意义(P<0.05),见表2。

表2 三组MGC-803细胞细胞周期和凋亡率的比较
注:与对照组比较,aP<0.05;与阻断组比较,bP<0.05。
2.3 细胞体外迁移力的影响
与对照组比较,阻断ERK-VEGF/MMP-9信号通路后MGC-803细胞迁移数量降低,转染质粒ERK1后MGC-803细胞迁移数量增多,差异有统计学差异(P<0.05),三组分别两两比较均具有统计学意义(P<0.05),见表3。

表3 三组MGC-803细胞迁移力的比较
注:与对照组比较,aP<0.05;与阻断组比较,bP<0.05。
2.4 细胞体外侵袭力的影响
与对照组比较,阻断ERK-VEGF/MMP-9信号通路中MGC-803细胞侵袭降低,转染质粒ERK1后MGC-803细胞侵袭能力增强,差异有统计学差异(P<0.05),三组分别两两比较均具有统计学意义(P<0.05),见表4。

表4 两组MGC-803细胞侵袭力的比较
注:与对照组比较,aP<0.05;与阻断组比较,bP<0.05。
2.5 阻断PI3K/AKT 通路两组细胞中ERK、VEGF、MMP-9 蛋白的比较
阻断PI3K/AKT 通路处理48 h后,MGC-803细胞中信号通路的关键效应蛋白 ERK、VEGF、MMP-9蛋白表达水平较对照组下调;转染质粒ERK1后ERK、VEGF、MMP-9 mRNA蛋白表达水平较对照组上调,见图1。

图1 蛋白质印迹法检测ERK、VEGF、MMP-9蛋白表达水平
3 讨论
胃癌是胃肠道最有侵袭性的肿瘤之一,胃癌具有远处转移和淋巴结转移的特征,导致其整体存活率较其它实质性肿瘤比较仍然有很低的存活率[13-14],不过胃癌发生发展的原因与其他类型的实质性肿瘤较为一致,均是过量表达转移基因异常产物如MMPs和VEGF的所致[15]。
ERK 是一种丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK),活化的ERKs磷酸化会对下游目标如90kD的核糖体S6蛋白激酶家族 (RSKs) 进行激活,使 pERKl/pERK2以及RSK1/2并转位入核到细胞核中,从而激活早期即刻基因(immediate early Genes, lEGs)迅速转录,其中的转录因子可以控制细胞周期以及细胞存活,进而起到将胞外信号通过细胞膜传递到胞核的信使效果[16-17]。Ras/Raf/丝裂原-活化蛋白-细胞外信号调节激酶(ERK)激酶(MEK) /ERK信号鼠疫是一种包含许多基本过程,如细胞增生、存活、运动以及迁移的关键环节。除此之外,实验研究结果发现Ras-ERK途径在癌症的启动以及发生发展中有十分关键的意义,研究结果已经证实Ras、Raf和MEK的突变激活能够诱导很多细胞类型的恶性转变[18-19]。研究已经发现,采用基因以及药理干预Ras-ERKp的途径是很多肿瘤起源细胞为保持其表现型而必须经过的途径。动物模型的研究结果已经证实了Ras-ERKp信号通路在体内肿瘤发生发展过程中的关键作用[20]。
本研究结果发现,阻断组对MGC-803细胞细胞增殖低于对照组和转染组,转染质粒ERK1则可提高MGC-803细胞增殖率。阻断组凋亡数量高于对照组。在S 期和G2 / M 期,阻断组细胞凋亡比率高于对照组。转染质粒ERK1后,其凋亡数量低于对照组。在S 期和G2 / M 期,阻断组细胞凋亡比率低于对照组,与对照组比较,阻断组MGC-803细胞迁移数量降低,转染质粒ERK1后MGC-803细胞迁移数量增多。与对照组比较,阻断组MGC-803细胞侵袭降低,转染质粒ERK1后MGC-803细胞侵袭能力增强。阻断组,MGC-803细胞中信号通路的关键效应蛋白 ERK、VEGF、MMP-9蛋白表达水平较对照组下调;转染质粒ERK1后ERK、VEGF、MMP-9 mRNA蛋白表达水平较对照组上调。该结果说明特异性ERK-VEGF/MMP-9信号通路抑制剂GDC-0994能够抑制胃癌Ecal09的生长,诱导细胞调亡影响细胞周期,即ERK-VEGF/MMP-9在细胞生长中起着重要作用。笔者分析其机理,ERK1/2是可调节蛋白或催化新陈代谢反应的关键酶, 是介导细胞反应的重要信号系统, 涉及调节细胞的许多生物学行为,其由Ras蛋白激活以磷酸化和去磷酸化的方式对外来刺激信号作出应答。MMPs是一组锌离子依赖性内切酶,可以降解细胞外基质中的各种蛋白成分,是唯一已知的能够降解纤维胶原的酶类。MMPs在细胞外基质成分降解和调节肿瘤血管生成的过程中都发挥了重要作用。本研究证实ERK1/2信号通路的激活下调RECK基因的表达,使得其对MMP-9表达的调控失衡, 引起恶性肿瘤侵袭和转移,同时证明ERK1/2抑制剂应该是非常有效的抗胃癌药物。因此,我们认为,ERK-VEGF/MMP-9信号通路可以成为癌症靶向治疗的理想位点之一,因此要重点关注这种信号级联反应,研究发现药物可作用的靶点,随后生产出针对这些信号介质的化合物。
综上所述,ERK-VEGF/MMP-9信号通路若受到拮抗,则可抑制胃癌肿瘤细胞的增殖并诱导细胞产生凋亡,并下调胃癌细胞迁移和侵袭能力。
