芦丁、槲皮素和桑色素抗氧化性的比较分析
2019-10-16回瑞华侯冬岩李铁纯刁全平
回瑞华,侯冬岩,李铁纯,刁全平
(鞍山师范学院 化学与生命科学学院,辽宁 鞍山 114007)
芦丁、槲皮素和桑色素广泛存在于植物的根、茎、皮、叶、花、果实中,均属黄酮类化合物.黄酮类化合物具有多种多样的生物活性,芦丁、槲皮素和桑色素是具代表性的黄酮类化合物,通常在应用和分析黄酮类化合物时以它们作为对照品.本文采用邻二氮菲-Cu+-H2O2-碳酸盐缓冲液流动注射化学发光法对芦丁、槲皮素和桑色素清除·OH能力即抗氧化性进行测定.原理如下列反应式[1]:
H2O2+ Cu+→ ·OH +Cu2++ OH-
当加入芦丁等具有抗氧化性能的化合物后,可清除部分·OH,使发光强度变弱,以此测定化合物抗氧化性能力的强弱.
1 仪器与试剂
西安瑞迈电子科技有限公司生产的IFFM-D型流动注射化学发光仪;昆山市超声仪器有限公司生产的KQ-250B型超声清洗器.
芦丁、槲皮素、桑色素 (购于中国药品生物制品检定所).邻二氮菲配成浓度为1×10-2mol/ L;氯化亚铜配成浓度为5×10-2mol/ L;过氧化氢需用时配至所需浓度;碳酸盐缓冲溶液配成pH10.57(试剂均为分析纯).
2 分析方法
2.1 样品前处理
芦丁、槲皮素、桑色素样品配制成浓度为0.5 mg/mL的溶液.
2.2 测定方法
启动IFFM-D型流动注射化学发光仪[2-5],以邻二氮菲-Cu+-H2O2-碳酸盐缓冲液流动注射化学发光体系为空白,测定抗氧化物抑制后发光强度,测定其抑制率.
抑制率=(I0-I)/I0×100%,
式中:I0为邻二氮菲-Cu+-H2O2化学发光体系的发光强度;I为抗氧化物抑制后的发光强度.
抑制率为50%时溶液的浓度,通常用IC50表示.
2.3 实验条件的优化及样品的测定
2.3.1 pH值与抑制率的关系 邻二氮菲-Cu+-H2O2体系应在碱性条件下产生化学发光现象,通常pH值不同发光强度则不同.当邻二氮菲-Cu+-H2O2体系中H2O2浓度为0.27 mol/L、Cu+浓度为1.0×10-4mol/L、邻二氮菲浓度为4.0×10-4mol/L、芦丁浓度为3 μg/mL时,考察缓冲溶液的pH值与抑制率的关系如图1所示.
2.3.2 H2O2浓度与抑制率的关系 在邻二氮菲-Cu+-H2O2体系中当pH值为10.57、Cu+离子浓度为1.0×10-4mol/L、邻二氮菲浓度为4.0×10-4mol/L、芦丁浓度为3 μg/mL时,H2O2浓度与抑制率的关系如图2所示.
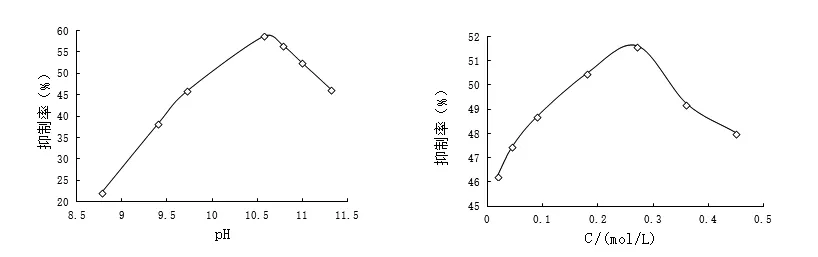
图1 pH值与抑制率的关系 图2 H2O2浓度与抑制率的关系
2.3.3 Cu+浓度与抑制率的关系 在邻二氮菲-Cu+-H2O2体系中,当pH值为10.57、H2O2浓度为0.27 mol/L、邻二氮菲浓度为4.0×10-4mol/L、芦丁浓度为3 μg/mL时,考察Cu+浓度与抑制率的关系如图3所示.
2.3.4 邻二氮菲浓度与抑制率的关系 在邻二氮菲-Cu+-H2O2-碳酸盐缓冲液体系产生化学发光时,考察邻二氮菲浓度与抑制率的关系如图4所示.

图3 Cu+浓度与抑制率的关系 图4 邻二氮菲浓度与抑制率的关系
2.3.5 溶液流速与抑制率的关系 从发光体系各溶液的配制、混合至逐渐产生最大发光强度,随后发光强度逐渐衰弱.此过程中流速太慢最大发光强度信号出现在流通池前,流速太快则会使最大发光强度信号出现在流通池后,影响测定的准确性.考察溶液流速与抑制率的关系如图5所示.
2.3.6 样品测定 用2.3.1-2.3.5各实验条件与抑制率的关系优化结果得到测定样品抗氧化性的最佳条件,按2.2测定方法测定样品的抗氧化性,结果如图6~8所示.

图5 溶液流速与抑制率的关系 图6 芦丁抗氧化性的测定

图7 槲皮素抗氧化性的测定 图8 桑色素抗氧化性的测定
由图6~8可知,随着芦丁、槲皮素和桑色素浓度的增加,3体系都具有较强的抗氧化性,抗氧化性随着各自浓度的增大而逐渐增大.

图9 芦丁、槲皮素和桑色素抗氧化性大小比较示意图
3 结果讨论
从图6~8可知,芦丁、槲皮素和桑色素的IC50(抑制率为50%时溶液的浓度)分别为2.22,2.24,76 μg/mL,如图9.
用IC50比较芦丁、槲皮素和桑色素的抗氧化性强弱,由图9可知:芦丁的抗氧化性最强,桑色素的抗氧化性最弱.芦丁、槲皮素和桑色素的抗氧化性强弱是由分子结构决定的,其分子结构如图10~12所示.
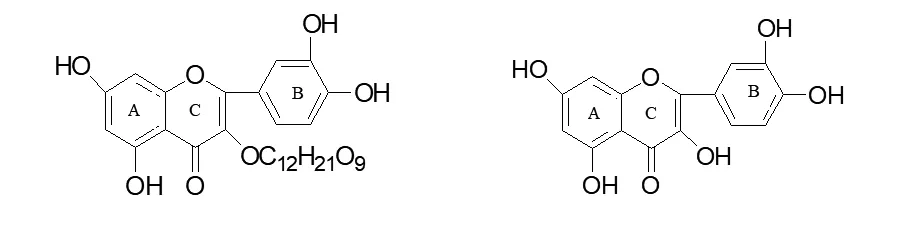
图10 芦丁的分子结构示意图 图11 槲皮素的分子结构示意图
由图10,11可见芦丁和槲皮素B环上的两个羟基都处于邻位结构,而图12桑色素B环上的两个羟基则处于间位结构.由于该类化合物清除自由基的作用通常是通过自身供氢氧化作用实现,羟基处于邻位可使一个羟基供氢氧化形成羰基,另一羟基更易于形成分子内氢键,从而使氧化后的化合物稳定,并可进一步共振形成邻苯醌,使自由基更加稳定[6-8].由此可知该类化合物结构B环上的二个羟基位置是具有清除自由基生物活性的关键结构.

图12 桑色素的分子结构示意图
本文采用邻二氮菲-Cu+-H2O2-碳酸盐缓冲液流动注射化学发光法对芦丁、槲皮素和桑色素清除·OH能力即抗氧化性进行测定,并对它们的抗氧化性进行比较分析.实验结果表明,芦丁、槲皮素和桑色素均具有抗氧化性,芦丁的抗氧化性最强,槲皮素次之,桑色素的抗氧化性最弱.实验结果对应用和分析黄酮类化合物或测定抗氧化性工作中选择对照品具有参考意义.
