氯化锂联合淫羊藿苷对成骨细胞增殖分化的影响
2019-10-16付殷孙贵才欧阳玉龙温浙旭
付殷 孙贵才 欧阳玉龙 温浙旭
1.黑龙江中医药大学中药学博士后流动工作站,黑龙江 哈尔滨 150000 2.南昌大学第四附属医院骨科,江西 南昌 330003
淫羊藿苷(ICA)是中药淫羊藿的有效成分。淫羊藿为小檗科多年生草本植物,归肝、肾经,性温,味辛、甘。《本草纲目》记录了淫羊藿其有“益精气、坚筋骨、实腰膝心力”的效果。淫羊藿苷是从淫羊藿属植物中分离得到的黄酮醇苷类化合物[1]。对治疗骨质疏松症类疾病效果显著且不良反应小。淫羊藿及淫羊藿提取物通过对骨髓间充质干细胞诱导作用来激活成骨细胞的增殖分化及抑制破骨细胞的作用来促进骨的形成、抑制骨吸收,构建骨的平衡,进而有效地防治骨质疏松的发生发展[2]。淫羊藿苷的分子机制已经证明其抗骨质疏松和成骨分化作用[3-4]以及其参与雌激素生物合成。
临床应用锂于治疗造血系统疾病和双极性疾病已经有数十年[5]。越来越多的证据表明,锂能够刺激干细胞增殖,认为其是细胞治疗机制之一[6]。研究人员已经提出,锂可以直接刺激骨髓间充质干细胞的增殖[7]。本研究意义在于尝试联合应用氯化锂与淫羊藿苷能否提高成骨细胞增殖及分化作用。
1 材料和方法
1.1 实验动物
出生72 h的SD乳鼠,由黑龙江中医药大学动物实验中心提供。动物合格证编号为SCXK黑2015004。
1.2 材料
淫羊藿苷(meilunbio,中国),LiCl(Sigma, 美国),胎牛血清、DMEM培养基、青霉素-链霉素混合液和胰酶(Hyclone, 美国),CCK8(同仁,日本),GSK3β、p-GSK3β、β- catenin、GAPDH抗体购于Abcam公司,维生素C、β-甘油磷酸钠、地塞米松(Sigma,美国)。茜素红染液(索莱宝,中国),PNPP(大连美伦,中国)。
1.3 成骨细胞分离与培养
无菌条件下取出出生72 h的SD乳鼠头骨,置入4°C的PBS溶液中,然后应用眼科镊与手术刀剔除表面的结缔组织,用4°C的PBS溶液反复吹打清洗组织并将其剪成小于1 mm3的组织块,将剪好的组织块转移到1.5 mL离心管中,加3倍体积的胰酶,将离心管置入37 ℃的恒温摇床中进行消化,振荡消化20 min后加入胎牛血清终止消化,放置于4 ℃冰箱中静置5 min,舍弃上清液,加入0.2% Collagenase I,置于37 ℃的恒温摇床中,消化并振荡60 min后用胎牛血清终止消化,多次吹打后通过200目滤网过滤去除碎片[3],收集滤液,1 200 r/min 离心8 min,弃上清液,用DMEM完全培养基进行重新悬浮细胞,置于37 ℃,5% CO2培养箱中进行培养;2 d 后换液,之后间隔2~3 d 换1次培养液。并在倒置显微镜下观察细胞形态及生长情况,取培养的第三代成骨细胞进行后续实验。
1.4 ICA对成骨细胞增殖能力影响
称取一定量的ICA,用DMSO溶解,配制成为200 μmol/L的ICA贮备液,使用前用DMEM基础培养液稀释所需浓度,使DMSO的终浓度<0.1%。将成骨细密度调整为104/mL接种于96孔培养板中进行培养,每孔加入200 μL置于5% CO2的37 ℃培养箱中进行培养,待细胞长满瓶底80%以上每孔中加入ICA终浓度为0、10、20、40、80 nmol/L 进行继续培养24 h后,每孔中加入10 μL的CCK-8进行继续培养4 h后,用酶标仪读取波长为490 nm处的吸光度值。
1.5 LiCl对成骨细胞增殖影响
将成骨细胞密度调整为104/mL接种于96孔培养板中进行培养,每孔加入200 μL置于5% CO2的37 ℃培养箱中进行培养,待细胞长满瓶底80%以上每孔中加入LiCl终浓度为0、2、5 nmol/L进行继续培养24 h后,每孔中加入10 μL的CCK-8进行继续培养4 h后,用酶标仪读取波长为490 nm处的吸光度值。
1.6 LiCl与ICA联合应用对成骨细胞增殖能力影响
将成骨细胞细密度调整为104/mL接种于96孔培养板中进行培养,每孔加入200 μL置于5% CO2的37 ℃培养箱中进行培养,待细胞长满瓶底80%以上时将相应的孔板分为4组即空白组、ICA组(80 nmol/L), LiCl(5 nmol/L),ICA(80 nmol/L)+LiCl(5 nmol /L)组,加入相应的药物,继续进行培养24 h,每孔中加入10 μL的CCK-8进行继续培养4 h后,用酶标仪读取波长为490 nm处的吸光度。
1.7 钙化结节染色与碱性磷酸酶活性测定
用第三代成骨细胞进行成骨性诱导,在矿化诱导培养基(100 nmol/L抗坏血酸、10 mmol/L β-甘油磷酸、7 mol/L地塞米松)下培养。各组分别加入相应浓度药物。接种于培养板中,分为空白组(矿化诱导培养基)、ICA组(80 nmol/L), LiCl组(5 nmol /L),ICA(80 nmol/L)+LiCl(5 nmol/L)组,空白组给予空白诱导培养液,进行诱导21 d后弃掉培养液,培养板用PBS溶液冲洗3次,室温下使用95%乙醇固定15 min,双蒸水冲洗3次,0.1%茜素红[茜素红-Tris-Hcl(pH 8.3)]染色,放置培养箱中1 h,使用双蒸水冲洗3次。PNPP 法测定成骨细胞ALP 活性,成骨细胞培养21 d后弃培养液,应用PBS溶液冲洗2 遍,使用1% Triton X-100 反复冻融3 次,成骨细胞裂解物孵育在磷酸盐底物中30 min,温度为37 ℃,进而加入1 mol/L 的NaOH 终止反应,酶标仪在405 nm 下测定其吸光度值。根据蛋白质标准化的Sigma 校正曲线,计算各组成骨细胞酶活性[8]。
1.8 WB检测成骨细胞中GSK3β、p-GSK3β、β- catenin蛋白含量
使用对数期的成骨细胞,并以2×104个/孔接种于6孔培养板,每孔均匀2 000 μL,待细胞贴壁后换液,按照实验分组给予相应的干预, 每孔2 000 μL。药物干预2 d 后,提取各组成骨细胞总蛋白,并进行蛋白定量,经12.5% SDS-PAGE电泳分离,转移至PVDF膜上,将含有5%脱脂奶粉的Tris-HCl缓冲液室温孵育1 h后,加入一抗稀释液((1∶100稀释),于4 ℃过夜,应用含Tween-20的TBS缓冲液洗膜3次,间隔10 min/次,加入二抗工作液(1∶200稀释),在室温下孵育1 h, TBST洗膜3次,间隔10 min/次,加入HRP标记的二抗工作液,室温孵育1 h, TBST洗膜3次,间隔10 min/次,最后采用ECL法显色。采用凝胶成像系统摄片并分析,结果以目的条带与内参条带(GAPDH)光密度的比值表示[9]。
1.9 统计学处理

2 结果
2.1 细胞形态
将成骨细胞在倒置显微镜下观察,接种24 h左右细胞贴壁,继续培养72 h延伸出较多的突起,在培养到7~10 d后细胞融合为单层细胞,细胞多为单核、多边形及梭形等,如图1所示。

图1 成骨细胞Fig.1 Osteoblasts (×100)
2.1 ICA对成骨细胞的增殖作用
如表1所示,CCK-8法检测结果显示不同浓度的ICA都能对成骨细胞增殖产生不同程度作用,但是低浓度差异不显著。成骨细胞生长率随着淫羊藿的浓度升高而增加。
表1不同浓度淫羊藿对成骨细胞增殖作用影响
Table1Effects of different concentrations of epimedium on the proliferation of osteoblasts
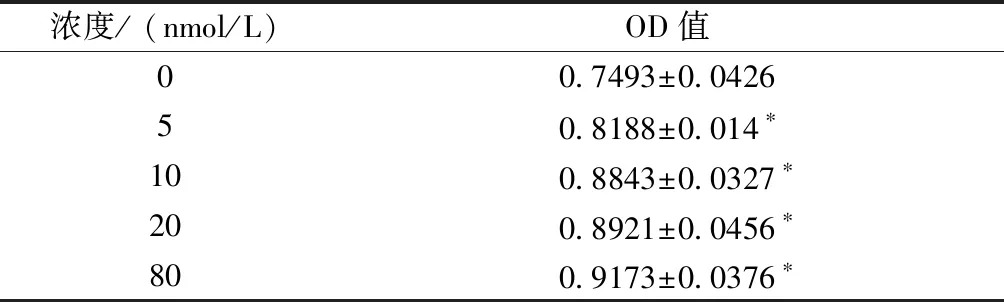
浓度/ (nmol/L)OD值0 0.7493±0.042650.8188±0.014∗100.8843±0.0327∗200.8921±0.0456∗800.9173±0.0376∗
注:与0 nmol/L比较,*P<0.05。
2.2 LiCl对成骨细胞的增殖作用
如表2所示,CCK-8法检测结果显示一定浓度下氯化锂都能对成骨细胞增殖产生不同程度的促进作用,并且各不同浓度组的OD值比较,差异具有统计学意义。
表2LiCl对成骨细胞增殖作用影响
Table2Effect of lithium chloride on the proliferation of osteoblasts

浓度/ (nmol/L)OD值00.6906±0.020820.7571±0.0123∗50.8837±0.0764∗
注:与0 nmol/L比较,*P<0.05。
2.3 LiCl与ICA联合应用对成骨细胞增殖的影响
如表3所示,CCK-8法检测结果显示与空白组比较, ICA组、LiCl组和LiCl与ICA联合组对成骨细胞的增殖具均有促进作用,与淫羊藿苷组和氯化锂组比较,淫羊藿苷联合氯化锂组对成骨细胞的增殖更具有明显促进作用。
表3淫羊藿苷联合氯化锂对成骨细胞增殖影响
Table3Effect of icariin combined with lithium chloride on the proliferation of osteoblasts
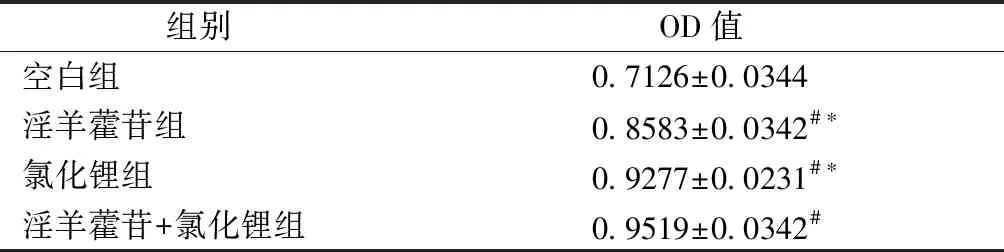
组别OD值空白组0.7126±0.0344淫羊藿苷组0.8583±0.0342#∗氯化锂组0.9277±0.0231#∗淫羊藿苷+氯化锂组0.9519±0.0342#
注:与空白组比较,#P<0.05;与淫羊藿苷+氯化锂组比较,*P<0.05。
2.4 茜素红染色与ALP 活性
茜素红染色结果如图2所示,结果表明淫羊藿苷、氯化锂、淫羊藿苷联合氯化锂处理的成骨细胞的矿化能力明显增加,相对于空白组,ICA组、LiCl组和LiCl与ICA联合组的成骨细胞矿化能力明显增加,与空白组比较,差异具有统计学意义(P<0.05),且以LiCl与ICA联合组处理细胞钙化能力最强。图3所示ALP 活性定量结果表明LiCl组、ICA组以及LiCl与ICA联合组处理的成骨细胞的活性明显增加,相对于空白组,且以LiCl与ICA联合组成骨细胞ALP 活性最高,结果表明LiCl与ICA联合组对成骨细胞的矿化能力和活性影响明显强于单独使用的效果。
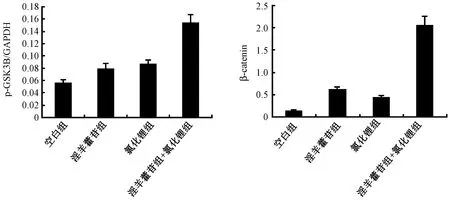
图5 成骨细胞中p-GSK3β,β- catenin表达的定量结果Fig.5 Expression of p-GSK3β and β-catenin in osteoblasts
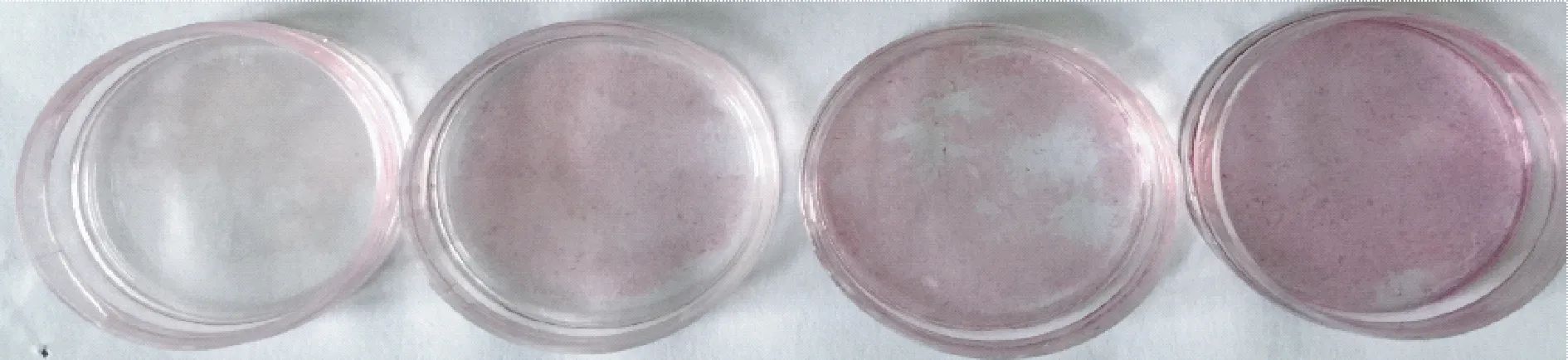
图2 成骨细胞钙化结节染色Fig.2 Staining of calcified nodules by osteoblasts
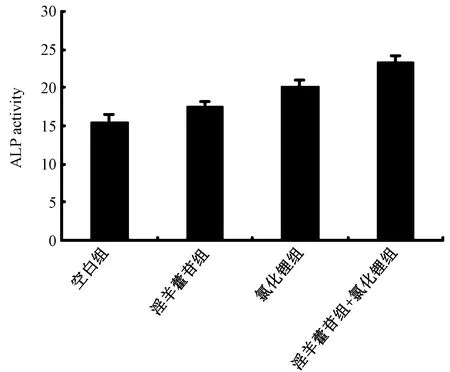
图3 ALP成骨细胞活性Fig.3 ALP activity of osteoblasts
2.5 各组对成骨细胞中p-GSK3β、β- catenin表达影响
经过ICA组、LiCl组以及LiCl与ICA联合组的处理,各组成骨细胞 p-GSK3β及 β- catenin蛋白表达的结果见图4~5所示,定量结果如图5所示,结果表明ICA组、LiCl组以及LiCl与ICA联合组处理的各组成骨细胞的p-GSK3β及 β- catenin蛋白表达明显增加,相对于对照组,且以LiCl与ICA联合组细胞 p-GSK3β及 β- catenin蛋白表达量最多,明显优于单独使用的效果。
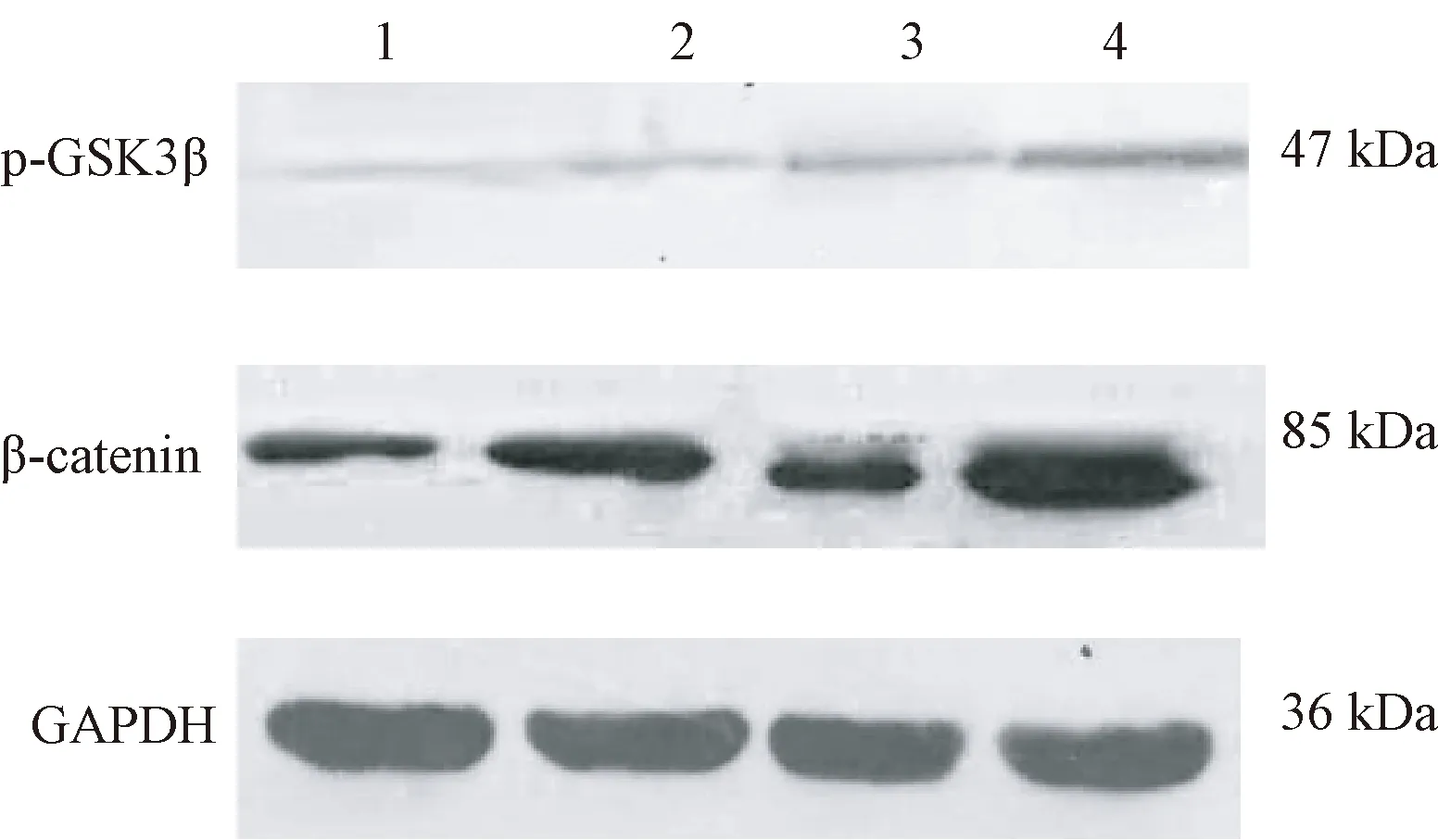
图4 各组中p-GSK3β、β- catenin及GAPDH表达注:1 对照组;2 ICA组;3 LiCl组;4 LiCl与ICA联合组Fig.4 Expression of p-GSK3β, β- catenin and GAPDH among groups
3 讨论
骨质疏松症是以骨的微观结构减弱为主要表现特征,骨强度下降和骨脆性增加为主要临床表现[10],多发生于老年人群,严重危害着患者的生活质量。骨质疏松由于成骨细胞与破骨细胞生理状态异常所致[11]。近年来的研究已经证明,淫羊藿苷可通过上调成骨细胞核心结合因子 α1 (Cbfα1)、BMP-2、BMP-4 mRNA 和 Runx2 的表达而促进成骨细胞骨形成[12]。进而提高骨密度,促进成骨细胞增殖和分化、增加松质骨骨量及抑制骨吸收的作用[13-14]。近年来,研究发现氯化锂既能促进成骨细胞增殖又能抑制破骨细胞吸收,在骨修复和骨重建中都能起到重要作用[15],表明氯化锂是可以用来治疗绝经后骨质疏松症。最近研究发现淫羊藿苷和氯化锂均是通过促进成骨细胞增殖和抑制破骨的骨吸收来治疗骨质疏松症,尝试研究淫羊藿苷与氯化锂联合应用是否具有有叠加促进骨质疏松症的潜力。鉴于此,本实验研究淫羊藿苷与氯化锂联合治疗骨质疏松症是否有优于单独治疗骨质疏松症的潜力,为此本研究分析淫羊藿苷与氯化锂联合作用成骨细胞,观察其对成骨细胞增殖和矿化能力的影响,并且探讨其对骨质疏松症治疗的可行性。
通过LiCl与ICA联合应用发现其可增强成骨细胞的矿化能力,实验同时检测ICA组、LiCl组及LiCl与ICA联合应用组间的茜素红染色,作为成骨细胞分化特异性检测标准。与单独用药组比较,LiCl与ICA联合应用组更能提高促进矿化结节能力,说明LiCl与ICA联合应用更能促进成骨分化。
经典Wnt /β-catenin 信号通路在成骨细胞的生成及骨形成过程中起到重要的作用,而淫羊藿苷+氯化锂组通过调节Wnt 信号通路GSK-3β的磷酸化从而抑制胞质内β-catenin的磷酸化和降解,进而增加胞质内β-catenin 聚集并转入细胞胞核。从而激活下游靶基因促进成骨细胞分化。
本研究从细胞水平与分子水平阐述了LiCl与ICA联合应用能更好地提高成骨细胞矿化能力,抑制GSK-3β的磷酸化及提高β-catenin 总蛋白的表达,进而促进成骨细胞的增殖和分化。
