卵巢癌脑转移2例临床分析
2019-10-15孙昊周洋章翊吴玉仙金志军
孙昊,周洋,章翊,吴玉仙,金志军
卵巢癌是女性生殖系统常见的肿瘤,且发现时多为Ⅲ期或Ⅳ期肿瘤,组织学分化程度中等或较差,预后也较差[1-2]。脑部是上皮性卵巢癌少见的转移部位,但随着以铂类为基础化疗药物的使用,患者生存期明显延长,卵巢癌脑转移的发病率有升高趋势,造成这种现象的原因可能是依赖于成像技术对脑损伤敏感性的提高,或者铂类等卵巢癌敏感药物的使用使患者生存期延长。由于临床数据的有限、病例散发性,卵巢癌脑转移患者预后的影响因素得不到大数据支持,卵巢癌脑转移后的治疗也难以形成共识。近年国内外文献均表明脑转移后以手术辅以放化疗的综合治疗模式可显著提高患者生存期[3],本文笔者就第二军医大学附属长征医院(我院)收治的2例患者的临床资料结合文献总结分析。
1 病例报告
1.1 一般资料收集我院2例卵巢癌脑转移患者。1例为2014年12月收治的患者,年龄58岁,临床分期:ⅢC期,病理类型:卵巢浸润性腺癌。1例为2005年11月收治的患者,年龄47岁,临床分期:ⅢC期,病理类型:子宫内膜样腺癌。
1.2 脑转移前治疗2例患者确诊为卵巢癌时CA125均>1 000 U/mL。第1例患者考虑无法完成较为满意的肿瘤细胞减灭术,行腹腔镜下活检术,术后予8个周期,每3周1次的紫杉醇+卡铂方案化疗,第3次化疗后肿瘤标志物CA125、CA153均降至正常(正常参考值分别为0~35 U/mL、0~25 U/mL)。第2例患者行满意的肿瘤细胞减灭术,术后行6个周期,每3周1次的紫杉醇+卡铂方案化疗,第1次化疗后肿瘤标志物均已降至正常。
1.3 脑转移瘤确诊的时间、症状和部位第1例患者发现脑转移瘤的时间为卵巢癌确立诊断后20个月,此时患者肿瘤标志物CA125为725 U/mL,头颅磁共振成像(MRI)提示两侧颞叶各有一单发小病灶,直径约2.5 cm,右顶骨较大病灶,直径约4.5 cm。第2例患者发现脑转移为卵巢癌确诊后13年,头颅MRI提示双侧额顶颞叶及双侧小脑半球见多发大小不等类圆形异常信号影,最大者直径约4.5 cm。2例患者首发症状均为一侧肢体瘫痪。
1.4 脑转移瘤治疗第1例患者2016年9月因右侧肢体瘫痪入院,MRI提示右侧颅内转移灶,开颅行右顶枕病灶切除术,术后病理提示:转移性腺癌;γ刀切除两小病灶。2017年3月MRI提示右侧病灶复发;2017年6月行放疗30 Gy/15 fx,全脑照射;2017年10月复查未见异常,CA125,CA153处于正常值;2017年11月复查CA125,CA153升高,MRI提示原来2个病灶周围复发,予两病灶X线立体定向放射治疗30 Gy/2 fx,27 Gy/3 fx,剂量曲线 62%~65%包绕,治疗后 MRI提示病灶缩小明显。2018年4月出现左侧肢体乏力,不能自理,予贝伐珠单抗200 mg静脉慢速滴注2次,地塞米松+甘露醇控制症状,后恢复扶走;2018年8月患者出现行走不稳,CA125持续升高;2018年11月CA125>200 U/mL,MRI提示右侧手术区周围肿瘤复发,予29.4 Gy/3 fx,25 Gy/2 fx,X线立体定向放射治疗,剂量曲线62%~65%包绕;2018年11月30日、2019年1月10日予贝伐珠单抗200 mg静脉慢速滴注2次;2019年 2月 CA125为 667.30 U/mL,CA153为 152.00 U/mL,予纳武利尤单抗200 mg静脉慢速滴注2次,随访中。
第2例患者在卵巢癌脑转移后行第3次化疗(力朴素+洛铂静脉慢速滴注)2个月后由于神经系统症状严重死亡。
1.5 综合治疗疗效第1例患者采取手术+全脑放疗+立体定向放疗+靶向药物综合治疗,自卵巢癌脑转移后已带瘤生存30个月余,且生活可以自理,一般情况尚好,复测CA125、CA153均正常。第2例患者脑转移后未予正规治疗,仅3次化疗2个月后死亡。
2 讨论
卵巢癌脑转移是一种非常少见的迟发性事件,其发生率根据不同的序列从0.29%~12%不等[4-6]。最近有报道称转移性中枢神经系统受累增加[7],影像学技术的进步及铂类药物使用导致患者的生存延长可能成为影响脑转移患者发病率的最主要因素,本文第2例患者脑转移确诊时生存期已达13年。McMeekin等[8]对104例卵巢癌脑转移患者进行回顾性分析显示,从卵巢癌早期诊断到脑转移的平均时间间隔约为19个月。本文第1例患者间隔时间为20个月,第2例患者为13年。卵巢癌确诊时患者的年龄可能是该差异的因素之一[9-10],第2例患者由于卵巢癌确诊时年龄<50岁,生存期较长,脑转移可能性提高。卵巢癌脑转移早期难以诊断,患者主诉及神经系统体征可能是脑转移较为早期的重要提示,国内文献近年报道案例以头痛为首发症状者占40%~50%,主要为颅内压增高所致,其他症状包括偏瘫、肢体乏力、失语、记忆力减退和共济失调等。
目前对卵巢癌脑转移的治疗没有形成共识,脑转移患者根据发现早晚多采用对症支持治疗、开颅手术、γ刀、射波刀和化疗等,多模式联合治疗使患者生存期明显延长。虽然大的临床试验中心尚未建立,Pakneshan等[9]通过对PubMed及基于医学检索的耶鲁网站中591例卵巢癌脑转移患者进行队列分析,所做出的数据统计提示一些有影响的预后因素已被确定有统计学意义,见表1,如诊断时患者较年轻,卡氏功能状态评分(KPS),没有颅外病变或单独的脑损伤等。第1例患者KPS较长时间维持在70分以上,耐受好,也是该患者卵巢癌脑转移后生存期较长的重要影响因素之一。第2例患者由于神经系统症状过重,KPS评分<30分,无法耐受,脑转移后不久便去世。然而,卵巢癌脑转移患者在全球范围内的预后仍然不佳,仅接受最佳支持治疗患者的总生存期(OS)中位数约为9.6个月,而接受多模式治疗患者的总生存期中位数为20.5个月。Corn等[11]分析32例卵巢癌脑转移患者的报告后认为,立体定向放射治疗(SRS)比传统放疗更有效,全脑放射治疗(WBRT)可以延长患者的生存时间,立体定向放射治疗尤其适用于全脑放射治疗难以治疗的小而深的病灶。本文第1例患者接受手术+WBRT+SRS后,已生存30个月;第2例行姑息治疗,在脑转移确诊后3个月死亡。
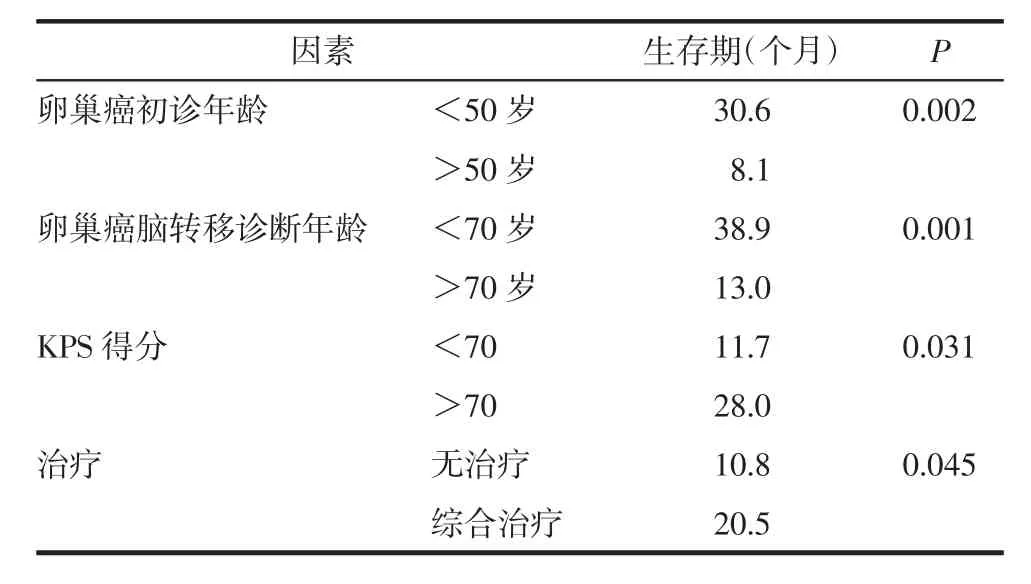
表1 卵巢癌脑转移患者预后影响因素
卵巢癌患者生存期由于得到更好的药物治疗而明显延长,脑转移的发生率可能会继续增加。因此,外科手术、放射治疗和新型分子靶向治疗的作用对患者预后的评估需要进一步分析,本文第1例患者采用多模式治疗后,生存期明显延长,提示患者在系统的治疗中获益。
激素受体状态在卵巢癌预后中已被广泛研究,但对卵巢癌脑转移患者的预后影响鲜有报道,近年有研究表明雄激素受体(AR)阴性上皮性卵巢癌(EOC)患者发生中枢神经系统(CNS)转移的倾向是AR阳性EOC患者的9.5倍,AR表达阳性的EOC原发肿瘤较不易发生脑扩散[12],AR受体表达有望成为卵巢癌脑转移有效的标志物。先前已有多个小型实验中心报道卵巢癌脑转移患者大部分存在乳腺癌易感基因(BRCA1/2)突变[13]。Ratner等[14]对 2011—2018年Flatiron健康数据库的回顾性研究中发现携带BRCA基因突变的卵巢癌患者有更高的脑转移风险,BRCA基因突变可能成为卵巢癌患者脑转移筛查的一个重要考虑因素。聚腺苷二磷酸核糖聚合酶(PARP)抑制剂应用于卵巢癌脑转移患者已有临床获益[15],大的研究中心亟待建立,PARP抑制剂可能成为一种卵巢癌脑转移性患者靶向治疗的潜在药物。此外,由于脑转移病例散发性导致缺乏较多较系统的临床数据,多中心合作研究有待开展。
