Cyberknife立体定向放射治疗对恶性肿瘤患者外周血MDSCs和Tregs影响
2019-10-14陈远贵徐本华蓝艺明张建平黄妙云林庆良
陈远贵,徐本华,蓝艺明,张建平,黄妙云,林庆良
近来研究表明,与既往普遍认为的放疗只具有免疫抑制作用的观点不同,局部大剂量放疗可促进机体抗肿瘤免疫反应[1-2],促进肿瘤抗原扩增、改变和表达,释放招募免疫细胞的炎症因子,促进肿瘤抗原交叉提呈,诱导肿瘤凋亡受体的表达,从而激活机体适应性免疫[3]。另一方面,肿瘤通过释放多种免疫抑制因子以及招募免疫抑制细胞,导致免疫抑制微环境阻碍放疗产生抗肿瘤免疫反应[4]。其中髓系抑制细胞(myeloid-derived suppressor cells,MDSCs)和调节性T细胞(regular T cells,Tregs)改变肿瘤微环境,抑制抗肿瘤免疫反应,造成肿瘤细胞免疫逃逸[5]。如何简便、有效的监测MDSCs和Tregs的变化,为免疫治疗和疗效评估提供依据,已成为肿瘤治疗的热点之一。本研究通过动态监测恶性肿瘤患者Cyberknife大剂量分割放射治疗后外周MDSCs和Tregs变化,为评价恶性肿瘤患者机体免疫抑制状态和最佳免疫干预时间点提供数据。
1 对象与方法
1.1对象
1.1.1临床资料 收集2017年9月—2018年1月笔者医院放疗科Cyberkinfe(射波刀)中心收治的恶性肿瘤患者25位,其中男性20例,女性5例,年龄(59.7±13.7)岁(21~79岁)。原发性肺癌6例;肺癌脑转移6例;直肠癌腹膜后淋巴结转移4例;原发肝癌3例;胰腺癌2例;结肠癌肝转移、直肠癌肝转移、肺癌肝转移和软组织肉瘤脑转移各1例。所有患者均经组织学或细胞学确诊为恶性肿瘤,具有可测量病灶(肿瘤病灶CT扫描长径≥10 mm)。预计生存期≥3月。剔除标准:严重的器官功能衰竭或全身疾病,无法耐受放射治疗的患者。患者接受化疗平均总剂量(32.0±7.6)Gy(20~45 Gy);放疗平均单次剂量(7.8±2.1)Gy(7.0~15 Gy);分割次数(4.3±1.1)次(2~5次);肿瘤体积(36.7±32.2)cc(0.5~109.3 cc);初始最大直径(39.2±19.2)mm(10~77 mm)。本研究经医院伦理委员会审批,患者均签署知情同意书。
1.1.2试剂 所有抗体均购自美国BD公司,包括标记MDSC细胞抗体:APC标记的鼠抗人CD33,PE标记的鼠抗人CD11b,FITC标记的鼠抗人HLA-DR;标记Treg细胞抗体:PerCP-Cy5标记的鼠抗人CD4,PE标记的鼠抗人CD25,APC标记的鼠抗人CD127;IgG同型对照;细胞裂解液。
1.1.3仪器 流式细胞仪(FACS VerseTM,美国BD公司);CT模拟定位系统(Lightspeed,美国GE公司);Cyberknife立体定向放射外科系统(G4,美国Accuray公司)。
1.2方法
1.2.1放射治疗方式 CT模拟定位:真空垫固定患者体位,行CT扫描,层厚1.25 mm;治疗计划设计和审核合格后,利用射波刀实时追踪影像系统(脊髓追踪,肺追踪,同步追踪,金标追踪)对肿瘤进行精确治疗。
1.2.2外周血标本采集 用肝素抗凝EDTA管收集清晨空腹外周血5 mL。采集时间点:放疗前(Before RT)、放疗结束(After RT)、放疗后1周(After 1W)和放疗后1月(After 1M)。储存温度为4 ℃,并在6 h内进行染色,染色后1 h内进行上机。
1.2.3流式细胞术检测MDSCs 取100 μL EDTA 抗凝外周血,加入 CD11b 单克隆抗体20 μL、CD33单克隆抗体5 μL、HLA-DR 单克隆抗体20 μL,4 ℃避光孵育30 min,加入红细胞裂解液2 mL,37 ℃温箱孵育10 min溶血,离心(3 000 r/min,5 min)弃上清液。继而加入PBS 2 mL洗涤,再次离心(3 000 r/min,5 min)弃上清液,后加入50 μL PBS重悬上流式细胞仪检测。数据分析使用FlowJo软件,最终所获CD11b+CD33+HLA-DR-/ lowMDSCs 计数为相对计数,即MDSCs在单核细胞中所占比率,并观察比率变化的百分比:
Δ%=TAfter%-TBefore%
1.2.4流式细胞术检测Tregs 取100 μL EDTA抗凝外周血,加入CD4 单克隆抗体20 μL、CD25单克隆抗体5 μL、CD127 单克隆抗体20 μL,余下步骤同MDSCs的检测流程。最终所获CD4+CD25+CD127-/lowTregs计数为相对计数,即占外周血CD4+细胞的百分比,并观察比率变化的百分比:
Δ%=TAfter%-TBefore%
1.2.5临床疗效评估 在CT/MR图像上测量放疗前和放疗1月后的肿瘤最大直径,并计算其变化值。以实体瘤治疗后评价标准(response evaluation criteriain solid tumors, RECIST)评估疗效:完全缓解(complete response, CR):所有目标病灶消失;部分缓解(partial response, PR):病灶长径总和缩小≥30%;稳定(stable disease, SD):病灶长径总和有缩小,但未达PR,或有增加但未达进展(progressive disease, PD);PD,病灶长径总和增加≥20%或出现新病灶。

2 结 果
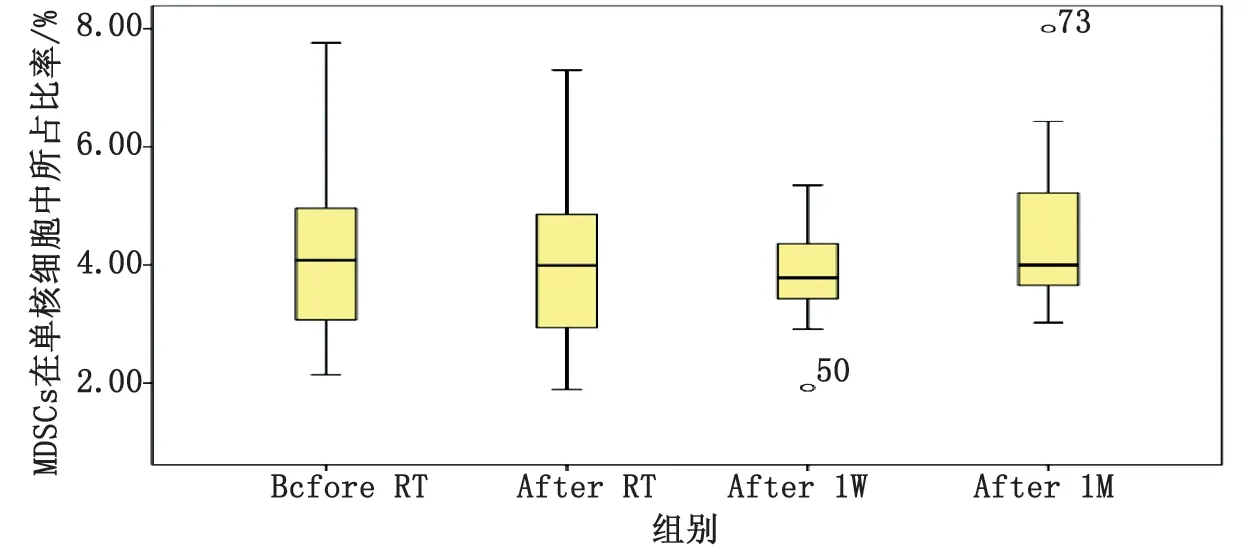
2.1外周血中MDSCs和Tregs的变化 MDSCs在单核细胞中所占比率为:Before RT(4.12±1.22)%,After RT(4.05±1.39)%,After 1W(3.82±0.79)%,After 1M(4.60±1.37)%(图1)。Tregs在CD4+淋巴细胞的百分比:Before RT(8.57±3.72)%,After RT(8.27±3.68)%,After 1W(7.97±3.67)%,After 1M(11.16±3.67)%(图2)。外周血中的MDSCs和Tregs在Cyberknife大分割放疗后所占比率减少,1周后最低,1月后急剧增加,高于放疗前(图3,4)。
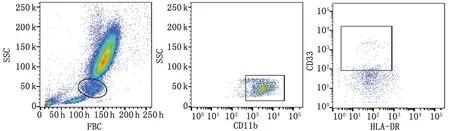
图1 流试细胞术检测Cyberknife治疗恶性肿瘤患者外周血CD11b+CD33+HLA-DR-/ low MDSCs在单核细胞中所占比率

图2 流试细胞术检测Cyberknife治疗恶性肿瘤患者外周血CD4+CD25+CD127-/low Tregs占CD4+细胞的百分比
MDSCs:髓系抑制细胞;Before RT:放疗前;After RT:放疗结束;After 1W:放疗后1周;After 1M:放疗后1月.

Tregs:调节性T细胞;Before RT:放疗前;After RT:放疗结束;After 1W:放疗后1周;After 1M:放疗后1月.
2.2MDSCs和Tregs各自组间配对样本t检验 Before RT组与After 1M组比较,差别有统计学意义(MDSCsP=0.046,TregsP=0.005);After 1W组与After 1M组比较,差别有统计学意义(MDSCsP=0.011,TregsP=0.024)(表2)。
2.3MDSCs和Tregs相关性 Before RT与After RT之间变化MDSCs和Tregs呈正相关(P=0.032),但MDSCs与Tregs在相对应的时间点未发现相关性。
2.4临床疗效 SD患者12例(48%),PR患者10例(40%),CR患者1例(4%),PD患者2例(8%)。Before RT组和Tregs 1M组肿瘤最大直径分别为(39.12±19.17)和(30.84±19.25)mm;Spearman相关性分析:两组肿瘤最大直径变化与After 1M组的MSDCs水平呈负相关(P=0.040),与其他检测时间点未发现相关性。
表2Cyberknife治疗恶性肿瘤患者外周血MDSCs和Tregs不同时间点的组间比较
Tab 2The comparison of MDSCs and Tregs between groups in peripheral blood monocytes of patients with malignant tumors by Cyberknife at different time points

项 目BeforeRTAfterRTAfter1WAfter1MMDSCsBeforeRTP=0.753(n=16)P=0.262(n=18)P=0.046(n=13)AfterRTP=0.753(n=16)P=0.132(n=17)P=0.111(n=13)After1WP=0.262(n=18)P=0.132(n=13)P=0.011(n=14)After1MP=0.046(n=13)P=0.111(n=13)P=0.011(n=14)TregsBeforeRTP=0.791(n=16)P=0.419(n=18)P=0.005(n=13)AfterRTP=0.791(n=16)P=0.990(n=17)P=0.059(n=13)After1WP=0.419(n=18)P=0.059(n=13)P=0.024(n=14)After1MP=0.005(n=13)P=0.059(n=13)P=0.024(n=14)
MDSCs:髓系抑制细胞;Tregs:调节性 T细胞;Before RT:放疗前;After RT:放疗结束;After 1W:放疗后1周;After 1M:放疗后1月.
3 讨 论
CyberKnife立体定向放射治疗是一种新型影像引导下肿瘤精确放射治疗技术,最适用于恶性肿瘤大剂量分割放疗。与传统的SBRT技术比较,该法具有实时影像引导及无框架定位等优势,临床治疗总精度可达亚毫米级别,被认为是目前世界上最为精确的SBRT技术之一[6-7]。本研究中,患者放疗后1月复查,疗效评估:SD患者12例(48%),PR患者10例(40%),CR患者1例(4%)。
研究发现,大剂量分割放疗所诱导的免疫反应与常规分割剂量照射引起的抗肿瘤免疫完全不同,大剂量分割放疗通过导致肿瘤细胞坏死,释放肿瘤细胞内大量抗原(免疫原性)[8-10];诱导死亡受体信号通路活化[11];增加肿瘤MHC-1的表达[12];诱导DCs成熟,活化 CD8+CTL细胞等机制产生抗肿瘤免疫[13]。另一方面,研究者相继发现了多种肿瘤相关的免疫抑制性细胞,如Treg细胞、MDSCs、调节性树突细胞和肿瘤相关巨噬细胞等,这些细胞与肿瘤的免疫逃逸、免疫耐受、免疫抑制等息息相关,引起机体对肿瘤免疫应答的抑制[14-15]。因此,研究免疫抑制性细胞(MDSCs和Tregs)大剂量分割模型治疗前后的动态变化对肿瘤治疗的免疫监测有重大意义。
MDSCs来源于骨髓祖细胞和未成熟的髓系细胞,包括未成熟的粒细胞、单核-巨噬细胞及树突状细胞。MDSCs 可通过产生精氨酸酶1、诱导型一氧化氮合酶、活性氧簇以及消耗胱氨酸和半胱氨酸等途径抑制T细胞激活和 T细胞介导的抗肿瘤免疫[16-17]。Xu等研究表明,前列腺癌15Gy/5f放疗后,外周血中MDSCs有所增多[18]。而Crittenden等报道胰腺癌和乳腺癌20Gy/3f放疗后,外周血中MDSCs明显减少[19];与之相似的直肠癌短疗程25Gy/5f研究表明:在长达60周监测中,发现放疗后第5周外周血中MDSCs数量最少[20]。本研究基于最新进的SBRT系统,确保肿瘤放疗剂量的精准。在长达5周的动态监测过程中,笔者发现:外周血中的MDSCs在Cyberknife大分割放疗后所占比率减少,1周后达到最低值,但1月后急剧增加,高于放疗前。组间配对样本t检验:Before RT组与After RT组差别无统计学意义;而Before RT组与After 1M组、After 1W组与After 1M组差别有统计学意义。此外,MDSCs作为微环境中重要的免疫抑制细胞,其与临床分期、远处转移和预后相关[21]。故笔者认为,After 1M的MDSCs在外周血中的数量与疗效呈负相关。
Tregs为具有免疫抑制效应的若干T细胞亚群,恶性肿瘤可通过诱导或招募Tregs以逃脱机体免疫系统对之的监视清除。许多研究都证明了在动物肿瘤模型与肿瘤患者外周血以及局部肿瘤组织中Tregs 细胞显著升高[22-23]。Sekar等发现,放化疗后凋亡的乳腺癌细胞能诱导DC分泌IL-27,诱导CD39+CD69+Treg生成,抑制了CTL的细胞毒性[24]。Tregs对放疗具有耐受性,尽管不知Tregs功能是否受到损害,但其数量在放疗后增加[25]。较高的放疗剂量有利于促进 T细胞的集簇以及肿瘤抗原的表达,但同时刺激免疫抑制细胞Tregs的增殖[26]。本研究选择以CD4+CD25+CD127-/low为检测免疫表型,检测无需破膜固定,利于功能研究。与以往研究不同,本研究动态监测了4个时间点Tregs细胞的变化:放疗后Tregs外周血中有所减少,但无统计学意义;1周后达到最低值,1月达到最高值,并高于放疗前。组间配对样本t检验:After 1M组分别与Before RT组(TregsP=0.005)和After 1W组(TregsP=0.024)比较,差别有统计学意义。
MDSCs能够通过细胞因子(IL-10和TGF-β)分泌诱导Tregs的生成和幼稚 T 细胞向 Treg 的转化,发挥Treg的免疫抑制作用[27-29]。本研究中,Before RT组与After RT组之间变化MDSCs和Tregs呈正相关(P=0.032),表明大分割剂量放疗前后MDSCs和Tregs变化趋势一致,两者存在相互联系。但MDSCs与Tregs相对应的时间点计数未发现相关性,可能与样本量较少有关,后续研究中,笔者将加大样本量进一步探索MDSCs与Tregs的相关性。
本研究中存在的不足:(1)临床应用时间较短,病种不统一,病例数较少。(2)由于临床标本为肿瘤患者外周血,监测的时间较长,部分患者依从性较差。笔者将在后续的研究中规范病种、增多病例数以弥补本研究的不足。
