温度对重铬酸铵热分解制备三氧化二铬的影响
2019-10-14叶雪梅冯海涛董亚萍
田 森 ,叶雪梅 ,冯海涛 ,董亚萍 ,李 武 ,张 波 ,李 波
(1.中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海西宁810008;2.青海省盐湖资源开发工程技术中心;3.中国科学院大学)
Cr2O3是一种重要的无机材料,具有广泛的应用范围,可用作催化剂、冶金原料、耐火材料、研磨剂、热喷涂材料,此外,在一些行业还有其他特殊用途,如高级着色剂,氢吸附材料,传感电极和太阳能吸收器。目前,普遍采用的制备工艺有两种:一是铬酐热分解[1],二是重铬酸钠与硫酸铵复分解制重铬酸铵热分解法[2]。前一种工艺成本高,制备的Cr2O3多为微米级,没有规则的表面形貌,难以实现高性能材料的要求。后一种工艺虽然原料易得、工艺简单且成本低,但形成的硫酸盐废水难以处理。另外,国内工业化的生产方法还有硫磺还原铬酸钠制氢氧化铬热分解法[3]。除了上述的工业方法外,已经公开发表的三氧化二铬的制备方法还有很多,如水热还原法[4],得到了碱金属离子含量很低的三氧化二铬产品;固相还原法[5],制备了颜料级氧化铬绿;氢气还原法[6],制备出低硫含量氧化铬绿。以上方法虽然制得了三氧化二铬,但是在实际生产中由于能耗效率的问题而难以实现工业化。
电化学合成法被称为绿色合成技术,它以“原子经济”为基本原则,具有清洁高效的优点[7],且反应条件温和(常温常压)[8],便于实现产业化。中国科学院青海盐湖研究所开发的铬盐清洁工艺,通过电化学氧化铬铁已成功制备了铬酸钠[9]、铬酸钾[10]和铬酸铵[11]。因此,本文以铬铁合金电氧化得到的铬酸铵溶液为原料,蒸发结晶制备重铬酸铵,通过热分解制备三氧化二铬,考察不同温度下得到的Cr2O3的结晶度、形貌、粒度和颜色,确定较佳的热分解温度。
1 实验材料和方法
1.1 试剂与仪器
(NH4)2CrO4, 分析纯试剂;NH3·H2O, 分析纯试剂;铬铁。电解槽,自制。
1.2 实验过程
将铬铁颗粒装入阳极框内,阴极板置于阳极两侧。 将一定物质的量比的(NH4)2CrO4和 NH3·H2O 溶液加入电解槽进行电解,通电6 h后停止电解。将电解得到的混合料浆经过过滤分离得到电解液,再经过蒸发、浓缩、冷却和结晶,重铬酸铵固体粉末即制备完毕。 最后, 将重铬酸铵在 450、550、650、750、850、950、1050、1150 ℃条件下热分解, 洗涤和干燥,制备出三氧化二铬。
1.3 分析测试方法
JSM6360LV/ICAA扫描电子显微镜;UV-3600 plus紫外可见近红外分光光度计;X′Pert Pro X射线衍射仪;SDT Q600热重分析仪;EPSILON3 X荧光分光光度计。
2 实验结果与讨论
2.1 重铬酸铵的制备
以铬铁和氨水为原料通过电化学氧化制备了铬酸铵溶液。在电氧化过程中,阳极Cr与Fe失去电子分别转化为 CrO42-和 Fe(OH)3,阴极 H2O 转化为 H2。相关的反应方程式如下:

电解后,料浆过滤后的溶液中主要是铬酸铵,铁则以沉淀形式存在,铬和铁实现了固液分离。铬酸铵溶液经过加热浓缩冷却后得到前驱体重铬酸铵,热分解后得到固体粉末样品Cr2O3[12-13]。将蒸发结晶得到的产品在X射线衍射仪上测定,结果见图1。其主要衍射峰(-110)、(-111)、(020)、(400)、(-221)、(-312)和(422)都与(NH4)2Cr2O7的特征峰(JCPDF卡片号No.25-0029)一致。由于铬酸铵受热易分解,因此转化成为更为稳定的重铬酸铵。
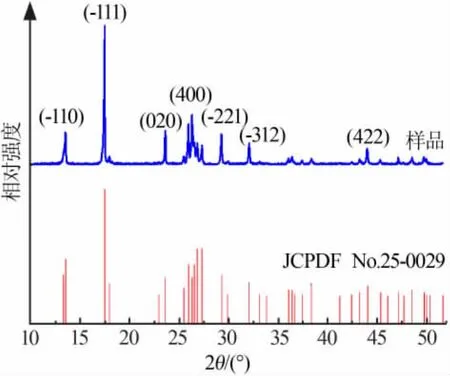
图1 蒸发结晶样品的XRD图
2.2 重铬酸铵的热分解过程
将重铬酸铵在热重分析仪上进行测定,结果见图2。从TG-DSC曲线结果发现,30~190℃时,质量损失缓慢增加,质量大致保持不变,未发生热分解反应;190~270℃和270~440℃时,质量损失急速增加,两者总质量损失率达到39%,DSC曲线出现两个放热峰,表明发生了两步分解反应,因为升温速率较快,TG曲线在190~440℃没有平台,发生两步热分解连续反应,可能放出 NH3和 N2[14];440~450 ℃时,质量损失缓慢增加,总质量损失率达到41%,DSC曲线同样出现了一个放热峰,发生了一步热分解反应,放出 O2[15],之后 TG 曲线为平滑的平台,DSC不再出现尖锐的峰,样品不再发生热分解,完全转变为氧化铬绿。因此,根据热重曲线确定450℃为最低热分解温度。相关的热分解反应方程式如(2)和(3)所示。由反应方程式可以看出,重铬酸铵制备铬绿过程是一个Cr6+→Cr4+→Cr3+的还原过程。

图2 前驱体材料热分解的TG-DSC曲线
2.3 三氧化二铬的结晶形貌
将不同温度热分解制得的三氧化二铬产品在X射线衍射仪上进行测定,结果见图3。从图3a看出,样品在(012)、(104)、(110)、(113)、(024)、(116)、(214)、(300)、(119)和(220)晶面出现强的衍射峰与α-Cr2O3标准卡片(JCPDF卡片号 No.76-0147)一致。很明显,低于850℃热分解的样品结晶度较差,较高温度下热分解保证了Cr2O3相的形成。由图3b可以看出,随着热分解温度的增加,峰的强度增加且宽度减小,这表明了样品的晶粒尺寸的增加及结晶度的提高。同时,由表1可以看出,三氧化二铬中铬的质量分数超过99%,且铬盐中常常存在的硅和钒没有被引入。
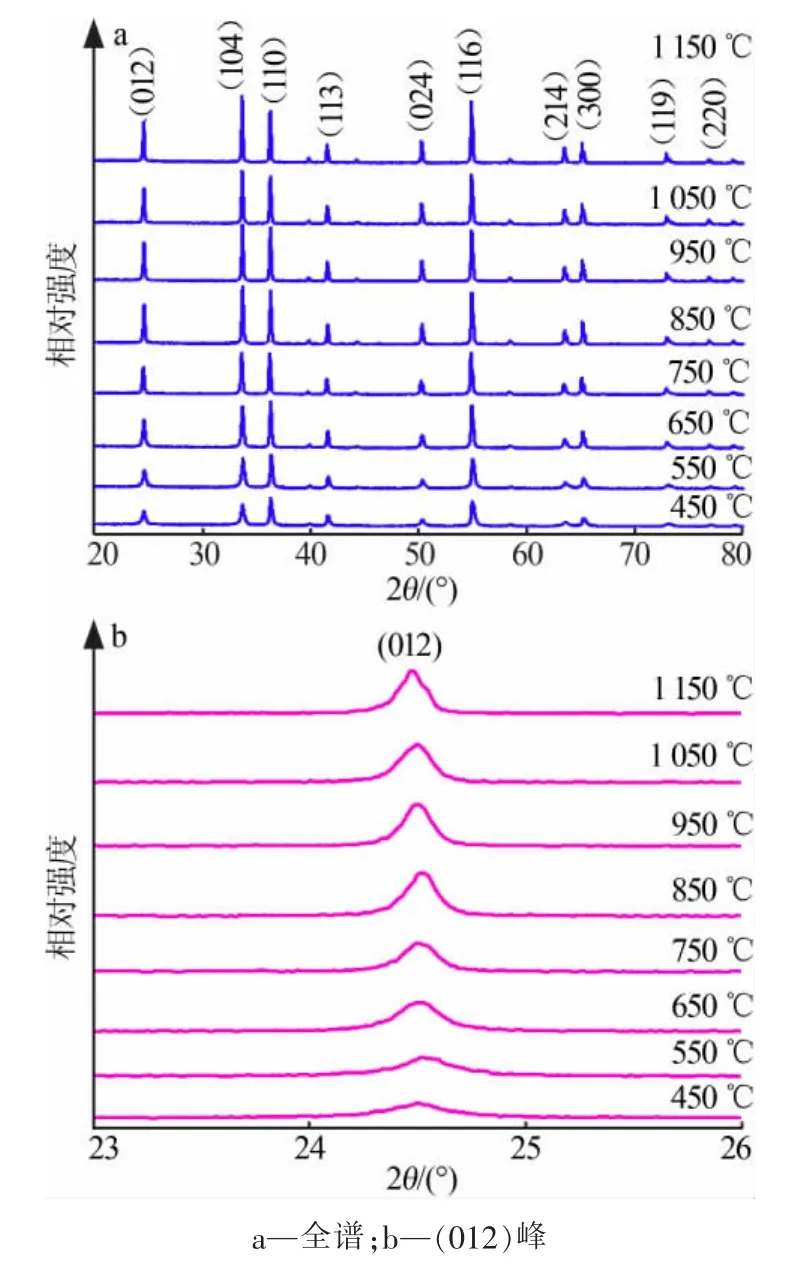
图3 不同温度热分解的样品的XRD图

表1 Cr2O3的成分 %
2.4 三氧化二铬的表观形貌
将不同温度热分解制得的三氧化二铬产品在扫描电子显微镜上进行观察,其形貌结果如图4所示。从图4可见,随着热分解温度的升高,Cr2O3粒径逐渐变大,形貌也随之变化。可以发现,粒径变化规律和XRD结果相一致。由图4a~c可见,样品在450~650℃热分解,Cr2O3分布不均且团聚严重,颗粒极其细小,基本在50 nm以下,没有规则的形貌。由图4d、e可见, 样品在750~850℃热分解,Cr2O3颗粒粒径分布均匀,没有严重的团聚现象,得到的Cr2O3颗粒为相对比较规则的球状颗粒,粒径在100 nm左右。由图4f~h发现,样品在950~1150℃热分解,Cr2O3开始由球状向六棱柱的形貌变化,形貌变得不规则,粒径在150~200 nm。整体上,可以看出图4e的三氧化二铬的形貌最为规则,分散性较好,粒径分布范围窄。因此,850℃为最佳的热分解温度。

图4 氧化铬粉末在不同反应温度下的SEM照片
2.5 三氧化二铬色度分析
将不同温度热分解制得的三氧化二铬产品在紫外可见近红外光谱仪(配备有积分球)上进行测定,其色度结果如表2所示。样品色度采用CIE-L*a*b*表色系统进行表征,L*值越大,其明度越高;a*在(+)侧数值越大,则表示红色程度越高,在(-)侧,则表示绿色程度;b*在(+)侧数值越大,则表示黄色程度越高,在(-)侧,则表示蓝色程度。从表2的结果可以发现,随着热分解温度的增加,样品L*值在450~650℃时快速增加,结合图4a~c,样品都存在团聚,但分散性越来越好,故L*增加,在750~1150℃时缓慢降低,此时,L*受粒径影响较大,粒径增加导致颗粒颜色变暗,但L*都在41以上,说明当L*达到一定值之后,再增加温度,对其明亮度影响不大,说明粒径的增加对明亮度影响不大;-a*和b*值整体呈现出增加的趋势,样品的颜色越来越绿,越来越黄,这是由于粒径的增加所导致,从a*b*值得到的结果与SEM的结果相一致。结合L*a*b*值综合来看,重铬酸铵在850℃以上温度热分解,制备的样品颜色为亮绿色,没有明显的颜色差别。因此,在850℃热分解制备三氧化二铬最为合适。

表2 Cr2O3色度值
3 结论
以铬铁合金在氨水溶液中电化学氧化制得重铬酸铵,热分解后获得产品Cr2O3。通过XRD分析,三氧化二铬结晶度随着温度升高而增加,三氧化二铬中铬的质量分数超过99%。在SEM图中可以看到,随着热分解温度的增加,晶粒尺寸增加;重铬酸铵在850℃热分解得到的Cr2O3粉体为球形,分散性较好,粒径为100 nm。CIE-L*a*b*结果表明,重铬酸铵在850℃以上热分解,合成的三氧化二铬为亮绿色。综合考虑,在850℃热分解即可制备结晶度较佳、粒径均一、形貌规则、颜色性能良好的三氧化二铬。
