飞燕草素对光诱导的视网膜氧化损伤的保护作用
2019-10-12彭佳媛杜旌畅刘婷婷杨利琼吴蔼林朱彦锋余小平
彭佳媛,杜旌畅,钟 茜,刘婷婷,杨利琼,吴蔼林,陈 玮,朱彦锋,余小平
0引言
光污染(light pollution)广泛存在于生活环境中,其导致的视网膜损伤已逐渐成为较严重的公共卫生问题[1]。研究证实,短时强光或长时弱光照射对视网膜可造成光化学损伤、热损伤和机械损伤,其中以视网膜光化学损伤(retina photochemical damage,RPD)为主[2]。流行病学研究表明[3],光损伤导致的视网膜疾病在未来20a将增加1倍,因而研究RPD的有效预防途径显得尤为迫切。花青素(anthocyanin)是一组天然黄酮类化合物,广泛存在于有色蔬果中,具有多种生物活性,包括抗氧化[4-5]、抗炎[6-7]、抑癌[8]和神经保护[9]作用。花青素主要有6种单体,即飞燕草素(delphinidin,Dp)、花葵素(pelargonidin)、锦葵花素(malvidin)、矢车菊素(cyanidin)、芍药花青素(peonidin)、矮牵牛素(petunidin),其中以花色苷Dp丰度较高,且羟基数量较多,其抗氧化生物特性高于其它单体[10-11]。我们前期研究[12-13]证实,黑米花青素能通过抗氧化、抗凋亡途径防护RPD,Dp是黑米花青素的主要活性成分,但是否能有效防护RPD尚不清楚。本研究以661W小鼠视网膜感光细胞和Sprague-Dawley(SD)大鼠为研究对象,从体内和体外角度探讨Dp是否通过调节氧化-抗氧化系统防护RPD。
1材料和方法
1.1材料
1.1.1实验细胞和动物661W感光细胞购自上海奥陆生物有限公司(来源于美国俄克拉何马州大学)。健康SPF级成年SD大鼠购自成都达硕实验动物有限公司[动物生产许可证号:SCXK(川)2015-030],体质量200±20g,饲养于SPF实验动物屏障环境。本研究符合动物伦理学要求,经伦理委员会审批通过。
1.1.2试剂和仪器主要试剂:Dp(美国Sigma公司,Dp为不溶于水的干粉,用DMSO配制成80mmol/L母液,-80℃保存);DMEM培养基、青霉素G、链霉素、胰蛋白酶(美国Hyclone公司);胎牛血清(美国Gibco公司);CCK-8试剂盒(日本同仁公司);乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒(中国南京建成公司);硫代巴比妥酸活性物质(thiobarbituric acid reactive substances,TBARS)(大鼠、小鼠)、LDH/SOD/GSH(大鼠)ELISA试剂盒(中国南京森贝伽公司);谷胱甘肽巯基转移酶(glutathione S-transferase,GST)试剂盒、RIPA裂解液(中国Solarbio公司);BCA(美国Thermo公司)。主要仪器:CO2培养箱(美国Thermo Scientific公司);细胞光照仪(自制);CMC-01多功能光照箱(自制);IX71倒置荧光相差显微镜(日本Olympus);Power Wave XS2酶标仪(美国BioTek);石蜡切片机(德国LEICA RM2235)。
1.2方法
1.2.1 661W细胞培养及分组661W细胞用含10%胎牛血清、青霉素G(100IU)和链霉素(100μg/mL)的高糖DMEM培养基常规培养,每3~4d用胰蛋白酶消化传代1次,收集对数生长期的细胞进行分组处理。(1)正常对照组:置于37℃、5% CO2培养箱中避光培养24h更换新培养基,继续保持原条件培养24h;(2)光照处理组:置于37℃、5% CO2培养箱中,2 000Lx强度白色荧光持续光照24h,更换新培养基,继续保持原条件光照24h;(3)Dp处理组:置于37℃、5% CO2培养箱中,2 000Lx强度白色荧光持续光照24h,将Dp处理组的3组细胞分别更换为含5、10、20μmol/L浓度Dp的培养基,继续光照24h[9,14]。
1.2.2 CCK-8法检测细胞活性收集对数生长期的细胞,根据实验分组接种细胞至96孔培养板,每孔加入200μL细胞悬液(5×104个/mL)。根据各组处理方法处理细胞后参考CCK-8试剂盒说明书,每孔加入新鲜配置的CCK-8溶液(培养基总体积的10%),同时设3个空白复孔,继续培养2h后在酶标仪450nm波长处测定光吸收值。
1.2.3细胞LDH、TBARS、SOD、GSH-Px、GST含量或活力测定制备处于对数期的661W细胞悬液(2×106个/mL),分别接种于5个T75培养瓶中,每瓶8mL,于37℃、5% CO2培养箱中培养24h。根据各组处理方法处理细胞后,于显微镜下观察细胞形态,收集各组细胞上清液,-80℃保存,BCA法测定蛋白浓度,按LDH试剂盒说明书检测其活力。然后收集细胞,低温离心,超声粉碎,低温提取蛋白,BCA法检测蛋白浓度,严格按照TBARS、SOD、GSH-Px、GST试剂盒说明书检测TBARS含量以及抗氧化酶系(SOD、GSH-Px、GST)活性。

图1 Dp对光损伤后细胞活性的影响 bP<0.01 vs光照处理组。
1.2.4 RPD动物模型的建立和分组将60只SD大鼠随机分为正常对照组、光照组和Dp处理组,每组各20只。对照组大鼠常规饲养30d;光照组大鼠常规饲养29d后以3 000Lx光照处理24h;Dp处理组大鼠先以Dp[100mg/(kg·d)]每日一次灌胃给药28d,停药暗适应24h后以3 000Lx光照处理24h[12-13]。
1.2.5大鼠视网膜形态学观察脱颈椎处死大鼠后摘取左侧眼球,用预冷的生理盐水洗去浮血,滤纸吸干后置于4%多聚甲醛中固定2h,常规脱水,浸蜡、石蜡包埋,经视神经矢状纵切,制成厚度5μm的切片。石蜡切片常规脱蜡至水,0.01mmol/L PBS缓冲液漂洗1次,5min;苏木精染色5min,自来水冲洗1min;1%盐酸-70%乙醇分色30s,自来水冲洗或浸泡30min至切片变蓝色;1%伊红溶液染色10min。梯度乙醇脱水:75%乙醇1min,85%乙醇3min,95%乙醇7min,100%乙醇Ⅰ 10min,100%乙醇Ⅱ 10min。二甲苯透明:二甲苯Ⅰ 20min,二甲苯Ⅱ 20min。中性树胶封片,晾干,于倒置光学显微镜下观察视网膜形态。
1.2.6抗氧化指标检测脱颈椎处死大鼠后摘取右侧眼球,用预冷的生理盐水洗去浮血,滤纸吸干后,剥取视网膜,置于预冷的细胞裂解液机械匀浆,4℃下3 000r/min离心10min。提取视网膜组织蛋白,BCA法检测蛋白含量。按南京森贝伽公司ELISA试剂盒说明书检测各组大鼠视网膜TBARS、SOD、GSH-Px、GST含量。

2结果
2.1 Dp对光损伤后细胞活性的影响CCK-8法检测结果显示,正常对照组、光照处理组、Dp处理组(5、10、20μmol/L浓度Dp)细胞活性(OD值)分别为3.280±0.075、1.690±0.201、3.405±0.168、3.398±0.360、2.587±0.012,差异有统计学意义(F=40.092,P<0.001)。与正常对照组相比,光照处理组细胞活性明显下降(P<0.01);与光照处理组比较,Dp处理组细胞活性均明显升高(P<0.01),且呈剂量相关性(图1)。
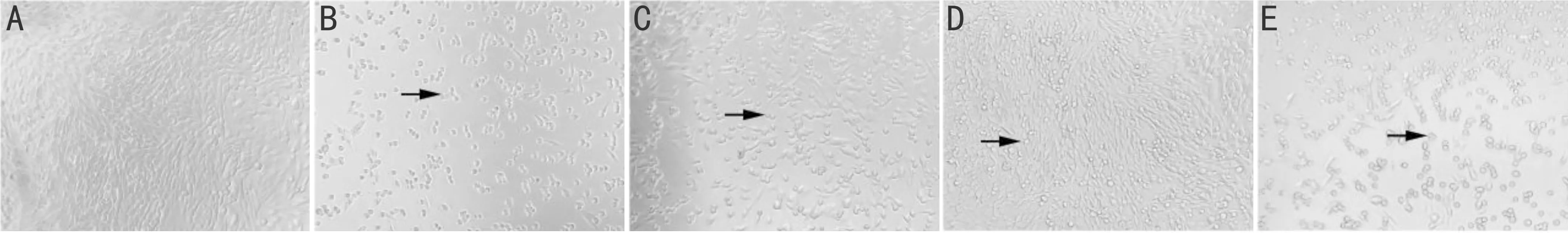
图2 Dp对光损伤后细胞形态的影响(×100) A:正常对照组:细胞生长旺盛,排列紧密;B:光照处理组,细胞皱缩,大量脱落;C:5μmol/L Dp处理组:细胞脱落较少;D:10μmol/L Dp处理组:细胞脱落较少;E:20μmol/L Dp处理组:细胞脱落较多。箭头所指为死亡细胞。

图3 Dp对光损伤后细胞LDH、TBARS、SOD、GSH-Px、GST的影响 A:LDH;B:TBARS;C:SOD;D:GSH-Px;E:GST。aP<0.05,bP<0.01 vs 光照处理组。
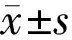
表1 Dp对光损伤后细胞LDH、TBARS、SOD、GSH-Px、GST的影响
2.2 Dp对光损伤后细胞形态的影响倒置显微镜下观察,正常对照组细胞生长良好。光照48h后细胞大量脱落、死亡,悬浮于培养基中,且存活细胞的胞壁出现皱缩,贴壁生长能力降低。不同浓度Dp处理组细胞的数量和贴壁能力明显较光照处理组升高,且该升高趋势呈现Dp剂量相关性(图2)。
2.3 Dp对光损伤后细胞LDH、TBARS、SOD、GSH-Px、GST的影响正常对照组、光照处理组、Dp处理组(5、10、20μmol/L浓度Dp)细胞LDH活力、TBARS含量及SOD、GSH-Px、GST活性差异均有统计学意义(P<0.001,表1)。光照处理组细胞LDH活力较正常对照组明显增高(P<0.01),而Dp处理组细胞LDH活力均较光照处理组显著降低(P<0.01),且呈剂量相关性。与正常对照组相比,光照处理组细胞TBARS含量明显升高,SOD、GSH-Px、GST活力均明显降低(P<0.01),经不同浓度Dp处理后,各组细胞TBARS含量均降低;SOD、GSH-Px、GST活性均升高(P<0.01),且具有剂量依赖性(图3)。
2.4各组大鼠视网膜形态学结构倒置光学显微镜下观察各组大鼠视网膜结构发现,光照损伤会导致大鼠视网膜外核层细胞间隙增大,光感受器细胞结构紊乱,外核层厚度变薄,而Dp可保护大鼠视网膜结构(图4)。
2.5各组大鼠视网膜组织TBARS、SOD、GSH-Px、GST变化正常对照组、Dp处理组、光照处理组的大鼠视网膜组织中TBARS、SOD、GSH-Px、GST含量差异均有统计学意义(P<0.001,表2)。与正常对照组相比,光照处理组的大鼠视网膜组织中TBARS含量上升,SOD、GSH-Px、GST含量均下降(P<0.01);与光照处理组相比,Dp处理组的大鼠视网膜组织中TBARS含量下降,SOD、GSH-Px、GST含量均升高(P<0.01,图5)。

图4 各组大鼠视网膜形态学结构(A~C×200,D~F×400) A、D:正常对照组,外核层中感光细胞致密、排列有序;B、E:Dp处理组,外核层中感光细胞排列较为有序,细胞数量较多;C、F:光照处理组,外核层中感光细胞排列松散,细胞数量减少,外核层厚度变薄。箭头所示为大鼠视网膜外核层。

图5 各组大鼠视网膜组织TBARS、SOD、GSH-Px、GST变化 A:TBARS;B:SOD;C:GSH-Px;D:GST。bP<0.01 vs 光照处理组。
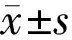
表2 各组大鼠视网膜组织TBARS、SOD、GSH-Px、GST变化
3讨论
视觉的形成需要一定光量刺激视网膜,视网膜病变尤其是视锥细胞损伤会导致夜盲和视野缩窄,最终导致中心视力严重受损,然而视锥细胞继发损伤的病理机制却仍未明确。近年来,本课题组[12-13]及其他研究[2,15]均证实,在3 000Lx连续光照下,视紫红质可吸收过量光子产生较多自由基,进而使膜结构(盘膜、线粒体膜、核膜及内质网膜)中的脂类发生过氧化连锁反应,形成脂质过氧化物和活性氧介质(reactive oxygen intermediate,ROI),组织内过氧化产物累积会导致视锥细胞发生氧化应激损伤。本研究中过度光照导致661W细胞形态发生改变,CCK-8检测结果表明,细胞活力明显下降,并释放大量LDH,与陈胜等[16]和Zhou等[17]研究结果一致,说明过度光照会抑制细胞活力,诱导细胞受损。光照后661W细胞和大鼠视网膜组织中脂质过氧化TBARS明显上调,与Izawa等[18]采用小鼠构建RPD模型后检测视网膜组织中TBARS结果相似,表明过度光照会导致视网膜组织中TBARS含量增加。SOD、GSH-Px、GST是体内重要的抗氧化酶系,对机体的氧化与抗氧化平衡起到至关重要的作用[19-20]。本研究发现,光照后661W细胞和大鼠视网膜组织中抗氧化酶系(SOD、GSH-Px、GST)活性降低,说明光照促使视网膜细胞氧化应激水平升高,打破视网膜中氧化-抗氧化系统平衡,损伤感光细胞形态,长期光损伤可导致视网膜光感受器丢失,是视网膜变性发生和发展的高危因素。
氧化应激不是视网膜功能障碍和变性发展的唯一因素,其它因素如炎症、血管改变和细胞变性等也是导致视网膜疾病发生发展的主要因素,但减少氧化应激已被公认为是视网膜疾病的有效的姑息治疗方法。黄体酮、硫辛酸(lipoic acid,LA)和萝卜硫素(sulforaphane,SFN)是常用的临床前研究该类疾病的抗氧化剂。黄体酮可减少自由基引起的损伤[21],增加抗氧化酶SOD的表达[22],还可通过清除细胞内自由基减少脂质过氧化,抑制氧化应激[23];LA是亲水亲脂分子,其能在水和脂质环境中发挥抗氧化和抗炎作用[24]。视网膜光损伤的体内研究证实,SFN能促进核因子NF-E2相关因子(nuclearfactor erythroidderived 2-like 2,Nrf2)和硫氧还蛋白-1(thioredoxin-1,Trx1)的表达,具有抗Caspase活性,抑制氧化后炎症反应的作用[25]。
目前,关于视网膜功能障碍治疗的研究中使用的抗氧化剂种类颇多,但均未涉及天然化合物花色苷。Dp被认为是花青素中的一种高效抗氧化剂[26-27]。新近研究发现,Dp能通过抗活性氧(reactive oxygen species,ROS)依赖性的氧化应激反应保护骨髓源性肝干细胞(BDHSCs)[28]。Ogawa等[14]也发现,Dp能显著减少光损伤后661W细胞中ROS含量。本研究发现,在光照后的661W细胞中加入不同浓度的Dp处理24h,镜下观察和CCK-8检测结果显示,细胞的数量和活性明显升高,且该升高趋势呈现Dp剂量相关性(尤其在5~10μmol/L升高明显);661W细胞释放出的LDH检测结果中,Dp明显降低了LDH活性,呈剂量相关性(5μmol/L降低效果最明显),说明Dp具有抗光诱导的661W细胞损伤的作用。另外,我们还发现Dp处理后,细胞内过氧化物产物TBARS在Dp浓度为10~20μmol/L内下降明显,抗氧化酶体系(SOD、GSH-Px、GST)活性均在Dp浓度为5μmol/L升高明显,动物实验进一步证实Dp能通过调节氧化-抗氧化系统防护RPD,与课题组前期研究动物体内花青素防护RPD结果一致[12-13]。此外,课题组前期体内实验发现花青素能够升高核因子κB(nuclear factor kappa B,NF-κB)活性,同时降低Caspase-1表达,抑制感光细胞凋亡,Dp是否具备同样的功效,值得我们进一步探讨。
综上所述,本研究通过构建RPD的体外细胞模型和体内动物模型发现,Dp可以降低光损伤后细胞内过氧化物产物TBARS含量,提高抗氧化酶系(SOD、GSH-Px、GST)活性,说明Dp对光诱导的视网膜的氧化应激损伤具有防护作用,为研究与光感受器细胞氧化损伤相关的视网膜疾病的发病机制和植物化学药物调控眼科疾病的研究提供了实验依据。
