BHMT对同型半胱氨酸诱导的人晶状体上皮细胞氧化损伤的保护作用
2019-10-12周海燕薛雨顺王新川
周海燕,薛雨顺,严 宏,李 迪,王新川
0引言
晶状体蛋白质是晶状体内重要的结构蛋白,晶状体蛋白质结构发生变化、溶解度改变,凝集、交联均可导致光散射和晶状体透明度改变,进而引起视力下降。大量的研究已证实蛋氨酸(Methionine,Met)对维持晶状体透明度是非常重要的,甜菜碱高半胱氨酸甲基转移酶(betaine-homocysteine methyl transferase,BHMT)是Met循环中重要的酶。BHMT主要在肝脏和肾皮质中有较大量表达,它利用同型半胱氨酸(homocysteine,Hcy)和提供甲基的甜菜碱(betaine,Bet)催化Met的再合成[1-2]。前期我们利用基于同位素相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)标记的蛋白质组学技术研究分析了不同年龄人白内障晶状体核与透明晶状体核间的差异蛋白质,并首次报道了BHMT在高龄组白内障晶状体核区的水平较年轻组明显下调,进一步通过新的临床白内障晶状体标本进行了验证[3]。但其在晶状体老化和白内障形成中如何参与代谢等确切机制尚不清楚。已有研究发现,高Hcy是导致年龄相关性疾病的重要风险因素[4]。除此,还与多种眼部疾病相关[5]。在白内障的研究中,高水平的Hcy与年龄相关性白内障发病密切相关[6-7]。本研究利用BHMT基因过表达人晶状体上皮细胞(HLEC)进行研究,观察Hcy干预下细胞中内质网应激蛋白、ROS及抗氧化系统相关酶水平及凋亡相关酶Caspase-12的变化,探讨BHMT在高浓度Hcy环境下对晶状体的保护作用。
1材料和方法
1.1材料
1.1.1实验细胞和仪器与试剂HLEC-B3细胞、胎牛血清(FBS,Ausbian)、DMEM(Corning)、胰酶(上海生工生物工程股份有限公司)、Puromycin(Clontech)、D-Hanks(上海吉凯基因技术有限公司),BCA蛋白定量检测试剂盒、SDS-PAGE凝胶配制试剂盒(中国碧云天公司)、乳酸脱氢酶试剂、抗-GRP78试剂盒(Abcam,Cambridge,MA)、Caspase-12检测试剂盒(Abcam,Cambridge,MA)、抗-Nrf2试剂盒(Santa Cruz Biotechnology,USA),同型半胱氨酸化合物(梯希爱化成工业发展有限公司)。荧光显微镜(奥林帕斯)、CO2培养箱(日本三洋)、倒置显微镜(上海蔡康光学仪器有限公司)、离心机(赛默飞世尔科技有限公司)、生物安全柜(上海振样创空气净化设备有限公司),GV358载体,AgeI/AgeI酶切(上海吉凯基因化学技术有限公司),EdU试剂盒(C10310锐博)。
1.1.2分组将HLEC随机分为3组。正常组:正常HLEC+10% FBS培养基;对照组:感染了空载体的HLEC+10% FBS培养基+5mmol/L Hcy;BHMT过表达组:BHMT过表达病毒感染HLEC+10% FBS培养基组+5mmol/L Hcy。根据Velazquez等的实验方法[8],孵育24h后检测相关指标。
1.2方法
1.2.1 BHMT基因过表达慢病毒载体的构建基因BHMT(NM_001713)由上海吉凯基因化学技术有限公司合成,所扩增的BHMT基因条带大小为1 262bp,插入经AgeI/AgeI酶切的GV358慢病毒载体构建GV358-BHMT慢病毒质粒,将重组慢病毒质粒GV358-BHMT,pHelper1.0载体,pHelper2.0混合液稀释后,利用Lipofactamin 2000脂质体对HEK293T细胞进行转染,48h后收集细胞并采用Western blotting法检测BHMT表达情况,裂解细胞提取总蛋白,BCA法测定蛋白浓度,经SDS-PAGE分离后电转移至PVDF膜上,一抗(1∶500)孵育过夜后给予二抗(1∶1000)孵育,漂洗后加入配置好的显色液用ECL法结合X光片显色。
1.2.2 BHMT基因过表达慢病毒载体感染细胞根据1.2.1构建BHMT基因过表达慢病毒载体,转染HEK293T细胞后48~72h进行病毒收获,确定采用相应的浓缩纯化得到高滴度的慢病毒保存液,病毒感染HLEC-B3后,通过抗性筛选获得过表达慢病毒感染细胞株,提取mRNA,经过qPCR检测表达水平。BHMT上游引物序列:5’-CCACTTTGACCCCACCATTA-3’;下游引物序列:5’-GCTAGCTCATTTGTGGTCATC-3’。以GAPDH基因为内参照基因,采用2-△△Ct法计算目的基因的相对表达量。
1.2.3细胞增殖能力的测定EdU细胞增殖实验方法:取对数生长期细胞,以每孔2 000细胞接种于96孔板中,培养至正常生长阶段;制备适量50μmol/L EdU培养基;每孔加入100μL 50μmol/L EdU培养基孵育2h,弃培养基;PBS清洗细胞2次,每次5min;每孔加入50μL细胞固定液(即含4%多聚甲醛的PBS)室温孵育30min,弃固定液。每孔加入50μL 2mg/mL甘氨酸,脱色摇床孵育5min后,弃甘氨酸溶液;每孔加入100μL PBS,脱色摇床清洗5min,弃PBS;每孔加入100μL 1×Apollo染色反应液,避光、室温、脱色摇床孵育30min后,弃染色反应液;加入100μL渗透剂(0.5% TritonX-100的PBS)脱色摇床清洗2~3次,每次10min,弃渗透剂;每孔每次加入100μL甲醇清洗1~2次,每次5min;PBS清洗1次,每次5min;去离子水按100∶1的比例稀释试剂F,制备适量1×Hoechst 33342反应液,避光保存;每孔加入100μL 1×Hoechst 33342反应液,避光、室温、孵育30min;弃染色反应液;加入100μL PBS清洗2次;染色后立即进行荧光显微镜观测。
1.2.4氧化损伤标志物检测
1.2.4.1检测ROS含量培养的细胞加入DCFH-DA荧光探针于培养基,浓度为10μmol/L。37℃孵育细胞30min,收集细胞,37℃避光30min,流式细胞仪检测。
1.2.4.2测定GSH活性用可见分光光度计(波长420nm)测算组织中谷胱甘肽(GSH)活性:取各组样本0.5mL,加应用液2mL混匀,3 500~4 000r/min离心10min,取上清液1mL进行显色反应。混匀,静置5min,420nm处,1cm光径,蒸馏水调零比色测各管OD值。
1.2.4.3 Western blotting检测细胞内质网应激相关蛋白及凋亡相关蛋白(GPR78,Nrf2,Caspase-12)接收细胞样品,PBS洗涤2次后,适量预冷的2×Lysis Buffer裂解,刮下细胞转移入EP管中,冰上裂解10~15min后超声破碎细胞,取上清BCA法测定蛋白浓度。加样进行SDS-PAGE凝胶电泳、转膜及脱脂牛奶封闭,按照不同检测试剂盒比例加入一抗(1∶1000),之后于4℃冰箱内与一抗孵育过夜,室温漂洗后按照比例加入二抗(1∶10000),孵育1h,再次漂洗后加入配置好的显色液,于Bio-Rad发光成像仪显色。蛋白质表达量以“目的蛋白灰度值/GAPDH灰度值”表示。

2结果
2.1 Western blotting检测BHMT蛋白表达情况重组慢病毒质粒转染HEK293T细胞48h后,BHMT慢病毒转染组细胞BHMT蛋白表达水平明显高于正常组和空载体转染组(图1),表明BHMT基因过表达慢病毒载体构建成功。
2.2 qPCR检测BHMT mRNA表达情况采用BHMT基因过表达慢病毒载体感染HLEC-B3细胞后进行实时定量PCR检测,所得结果与GAPDH的结果相比较,通常认为Ct值相差2以上即存在显著差异。本实验中正常组为1.0032±0.090,空载体感染组为1.475±0.047,BHMT慢病毒感染组为986.181±106.033,差异有统计学意义(P<0.05,图2),BHMT基因表达丰度明显升高,约是正常组的986.181倍,空载体感染组与正常组比较差异无统计学意义(P>0.05)。
2.3 BHMT基因过表达对HLEC增殖能力的影响利用EdU试剂盒对HLEC进行增殖能力检测,正常组、对照组、过表达组细胞增殖能力分别为(33.342±0.045)%、(28.099±0.307)%、(58.141±0.192)%,差异有统计学意义(F=38.726,P<0.05)。与正常组相比,过表达组细胞增殖比例増加,差异有显著统计学意义(P<0.01),而对照组与正常组相比,差异无统计学意义(P>0.05),见图3。
2.4 BHMT基因过表达对氧化损伤指标的影响细胞内ROS水平:使用流式细胞仪行DCFH-DA定量检测显示,正常组、对照组、过表达组细胞内ROS水平分别为(89.2043±0.3511)%、(91.4502±0.0606)%、(49.5625±0.4502)%,差异有统计学意义(F=99.348,P<0.05)。与正常组相比,过表达组ROS降低,差异有显著统计学意义(P<0.01),而对照组与正常组相比,差异无统计学意义(P>0.05),见图4。
2.5 BHMT高表达对HLEC内GSH活性的影响各组GSH活性结果见表1。三组间GSH活性差异有统计学意义(F=93.375,P<0.05)。与正常组相比,过表达组GSH活性増加,差异有显著统计学意义(P<0.01),而对照组与正常组相比,差异无统计学意义(P>0.05)。

图1 Western blotting检测BHMT蛋白表达。

图2 qPCR检测BHMT mRNA表达情况 aP<0.05 vs正常组。

图3 各实验组细胞增殖比例 aP<0.05 vs正常组。
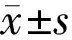
表1 各实验组GSH活性
2.6 Western blotting检测GRP78、Nrf2、Caspase-12在各组表达的差异三组GRP78相对表达量分别为1.1081±0.031、1.2433±0.020、0.2282±0.013,正常组及对照组明显高于过表达组,差异均有统计学意义(P<0.05);正常组、对照组、过表达组Nrf2的相对表达量分别为0.1061±0.047、0.1081±0.040、0.8276±0.070,正常组与对照组明显低于过表达组,差异均有统计学意义(P<0.05),见图5。正常组、对照组、过表达组凋亡相关酶Caspase-12的相对表达量分别为0.3032±0.055、0.8781±0.043、0.1026±0.050,过表达组与正常组明显低于对照组,差异均有统计学意义(P<0.05),见图6,表2。
3讨论
前期我们利用iTRAQ标记的蛋白质组学技术研究分析了不同年龄人白内障晶状体核与透明晶状体核间的差异蛋白质,并首次报道了BHMT在高龄组白内障晶状体核区的水平较年轻组明显下调,进一步通过新的临床白内障晶状体标本进行了验证[3]。但其在晶状体老化和白内障形成中如何参与代谢等确切机制尚不清楚。在胎儿晶状体文库中,BHMT是一个大量表达的基因[9]。Rao等[10]第一次在恒河猴的晶状体核中发现了BHMT,其表达约占核部总蛋白的0.5%~10%,但具体机制不清。BHMT是Met循环中重要的酶,它利用Hcy和提供甲基的甜菜碱(betaine,Bet)催化Met的再合成[11-12],是机体在生理状况下维持Hcy稳定代谢水平的重要功能蛋白质。实验研究已经观察到Hcy对人类和动物晶状体上皮细胞的影响,高浓度Hcy可以诱导晶状体细胞发生严重的氧化应激反应,引起白内障的发生和发展[7,13]。Hcy升高导致大量的活性氧的产生,诱导细胞死亡和凋亡,可能导致了皮质性白内障的形成[14]。而后囊下白内障的形成可能与玻璃体内Hcy的含量增多有关[15]。研究认为Hcy是一种引起白内障的内质网应激源。内质网应激是指由于内质网中钙离子紊乱和蛋白质不能正常折叠导致细胞内质网内稳态失衡、生理功能发生紊乱的一种亚细胞器的病理过程,葡萄糖调节蛋白78(glucose-regulated protein78,GRP78)是内质网应激反应的标志性蛋白[16]。细胞内抵御过量ROS损伤的最重要机制是由PERK依赖的转录激活因子(NF-E2-related factor2,Nrf2)调控的[17-18]。Nrf2调控许多抗氧化防御基因,包括GR、谷胱甘肽-s-转移酶、硫氧还蛋白、硫氧还蛋白还原酶及另外的抗氧化酶。研究发现在相同的诱导条件下BHMT转基因小鼠的高Hcy血症发病率明显低于对照组,并可保护肝脏细胞免受高同半胱氨酸浓度的损伤[19-20]。Zhang等[21]发现两种miRNAs通过分化靶向海刺参中BHMT来直接影响体腔细胞中Hcy含量,靶基因BHMT siRNA或补充Hcy均可明显促进体腔细胞ROS的产生,表明靶基因BHMT通过调控Hcy的含量发挥生物学功能。

图4 各实验组细胞内ROS水平。

图5 GRP78,Nrf2在各组表达的Western blotting分析。

图6 Caspase-12在各组表达的Western blotting分析。
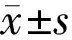
表2 各组细胞内相关蛋白质表达
前期我们成功构建了人晶状体上皮细胞BHMT基因过表达慢病毒载体,在实验中观察到空载体感染组及BHMT慢病毒感染组的细胞增殖率及活性未出现抑制现象[22]。然后观察其对Hcy干预的人晶状体上皮细胞的氧化损伤的抑制作用。本研究发现,当加入Hcy干预后,BHMT过表达细胞内ROS水平较正常组及对照组明显降低,GSH活性明显升高,提示BHMT可以在细胞接受高Hcy刺激后,减轻细胞的氧化损伤程度。Nrf2的降低也进一步说明了对照组细胞内抵御过量ROS损伤的屏障削弱。内质网应激反应标志性蛋白GRP78的表达较阴性对照组明显降低,提示高Hcy启动了内质网应激反应,而BHMT可有效地抑制这种反应,增强细胞的保护作用,同时抑制了凋亡相关酶Caspase-12的表达。
综上所述,由于Hcy诱导了内质网应激反应的启动,并导致晶状体上皮细胞中ROS的产生,ROS降低了游离谷胱甘肽的数量,削弱了氧化防御系统,加剧了更加氧化的环境,导致晶状体发生氧化损伤。而BHMT可以抑制Hcy对细胞的氧化损伤作用,减少细胞ROS水平,升高GSH活性,减轻内质网应激反应,抑制了细胞凋亡,最终表现为可以有效防护高Hcy环境下晶状体上皮细胞氧化损伤。证明了其在防治与Hcy有关的疾病方面的积极作用,为白内障氧化损伤机制提供新的依据。
