山药多糖对急性酒精中毒小鼠的解酒作用
2019-10-12周庆峰康洁马亢张雁冰
周庆峰,康洁,马亢,张雁冰
(1.商丘师范学院生物与食品学院,河南商丘476000;2.郑州大学药学院,河南郑州450006)
多糖是一种由多个单糖聚合生成的高分子碳水化合物,其糖基组成为葡萄糖、半乳糖及甘露糖,具有免疫增强、抗衰老、降血脂等多种功能,亦是制备功能保健食品的优质原料[1-2]。
山药为薯蓣科植物薯蓣的块茎,是我国传统药食同源保健食品之一,山药多糖是山药的主要活性成分,具有提高机体免疫、抗衰老、抗突变、抗氧化、抗肿瘤和降血糖等功能[3-4]。
急性酒精中毒是指人在短时间内大量饮酒后导致神经中枢系统兴奋及随后进入的抑制状态。轻者可见烦躁多语、恶心呕吐,重者可导致昏迷、呼吸缓慢、体温下降,严重影响人的身体机能[5]。目前,国内外对多糖解酒效果已有较为广泛的研究,如玉郎伞多糖、枳椇子多糖、麦冬多糖、石斛多糖等均已证明能够延长醉酒潜伏期,抑制氧自由基的释放,延缓酒精在肠胃的吸收等作用,进而起到保肝、护肝和解酒作用[6-9]。那么山药多糖是否也具有解酒保肝作用,目前还未见明确报道。因此,在本研究中,首先建造小鼠急性酒精中毒模型,通过观察给药后醉酒小鼠入睡潜伏期和醉酒时间,以及测定血清和肝组织中反应肝功能的生化指标的变化,来探索山药多糖的解酒护肝作用,明确其解酒防醉效果,为开发新的解酒药物提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 实验动物
健康小鼠,体重20 g~30 g,均为清洁动物,检疫合格,自由饮水,由商丘师范学院实验中心提供。饲养环境温度为(23±2)℃,湿度为 40%~60%,明暗交替周期为12 h。
1.1.2 药品
山药选自河南省商丘市孙付集乡出产的铁棍山药;山药多糖为本校功能食品研发实验室制备,收率为0.31%;56°白酒(选自红星牌二锅头):北京红星酒业有限公司;乙醇脱氢酶(alcohol dehydrogenase,ADH)试剂盒、谷草转氨酶(glutamic oxalacetic transaminase,AST)试剂盒、谷丙转氨酶(alanine transaminase,ALT)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒:南京建成生物工程研究所。
1.1.3 器材
Agilent 7890A 气相色谱仪:美国安捷伦科技有限公司;手提式压力蒸汽灭菌器:浙江新丰医疗器械有限公司;JJ-2 组织捣碎匀浆机:常州国华电器有公司;小鼠灌胃器:北京合力科创科技发展有限公司。
1.1.4 药品配置
1)山药多糖制备。采用水提法制备山药多糖,其工艺条件为:山药粉过筛目数80 目、提取温度55 ℃、料液比 1 ∶30(g/mL)、提取时间 4.0 h,获得山药粗多糖。为进一步除去蛋白质,采用氯仿∶正丁醇为4 ∶1(体积比)的Sevage 试剂与多糖提取液按4 ∶1(体积比)混合,振摇20 min 后,在4 000 r/min 下离心10 min,分去水层与溶剂层交界处的变性蛋白质,重复提取2 次~5 次,沉淀干燥后备用[10]。
2)山药多糖含量检测。取不同浓度的甘露糖溶液,用苯酚-硫酸法测定总糖含量,制作标准曲线。取25 mg的山药粗多糖,按同样的操作方法,测定其吸光度值,用上述标准曲线方程计算其多糖含量[11]。
1.2 方法与观察指标
1.2.1 小鼠醉酒模型的建立
选取75 只昆明小鼠,实验前将动物禁食12 h,将小鼠随机分为5 组,每组15 只,分别按0.1、0.2、0.3、0.4、0.5 mL/10 g 体重灌胃56°红星二锅头。灌胃后小鼠立即放在垂直的铁丝网上,通过记录攀附时间、耐受时间、醉酒时间、醉酒率、死亡率,取醉酒率最高而小鼠死亡率较低的剂量进行小鼠急性酒精中毒实验[12]。实验结果表明,采用0.4 mL/10 g 体重的酒精灌胃剂量能使实验小鼠的醉酒率最高,同时死亡率最低,因此选择此剂量作为后续实验的最佳醉酒剂量。
1.2.2 山药多糖对醉酒小鼠耐受时间和醉酒时间的影响
取小鼠60 只,雌雄各半,随机分为4 组,分别为山药多糖高、中、低剂量组(0.8、0.4、0.2 g/kg 体重)和生理盐水对照组,每组10 只,禁食12 h 后,进行称重并记录。先分别灌胃给予低、中、高剂量的山药多糖和生理盐水,30 min 后按0.4 mL/10 g 体重的酒精剂量给予白酒灌胃,获得醉酒小鼠(小鼠醉酒与否以翻正反射是否消失为标准,小鼠灌胃后将其背向下,轻放入鼠笼,若小鼠背向下的姿势保持30 s 以上,则认为翻正反射消失,即为醉酒)。在排除灌胃后立即死亡及3 h 以上仍未出现醉酒状态的小鼠后,观察记录小鼠从给酒后到出现翻正反射消失(即出现醉酒)的时间,比较各组小鼠醉酒时间和醒酒时间(小鼠复苏的判断标准为醉酒小鼠翻正反射恢复,并且行动灵活自如,毛滑顺)[13]。
1.2.3 山药多糖对醉酒小鼠血液乙醇和乙醛浓度的影响
取小鼠60 只,按1.2.2 所述方法分组给药后,按照1.2.1 所述的醉酒模型建立方法给予酒精灌胃。灌胃1.5 h 后,摘小鼠眼球取血,分离血清,根据参考文献方法,采用气相色谱法测定血清中乙醇和乙醛的浓度[14]。
1.2.4 山药多糖对醉酒小鼠肝脏部分生化指标的影响
取血后,将小鼠采用颈椎脱臼法处死,取肝脏并用滤纸吸净肝脏表面水分和血液后用9 倍质量的生理盐水制成10%(质量分数)的匀浆液,4 ℃下离心15 min(3 000 r/min),取上清液,按照试剂盒说明书,测定肝脏中谷草转氨酶(AST)、谷丙转氨酶(ALT)、乙醇脱氢酶(ADH)、超氧化物歧化酶(SOD)的含量[15-16]。
1.2.5 统计分析
采用SPSS13.0 统计软件,数据用均数±标准差表示,组间比较采用t 检验。与对照组相比,P<0.05 为差异有统计学意义,P<0.01,表示差异非常显著,P>0.05,表示无显著差异。
2 结果与讨论
2.1 小鼠醉酒模型的建立
小鼠醉酒模型见表1。
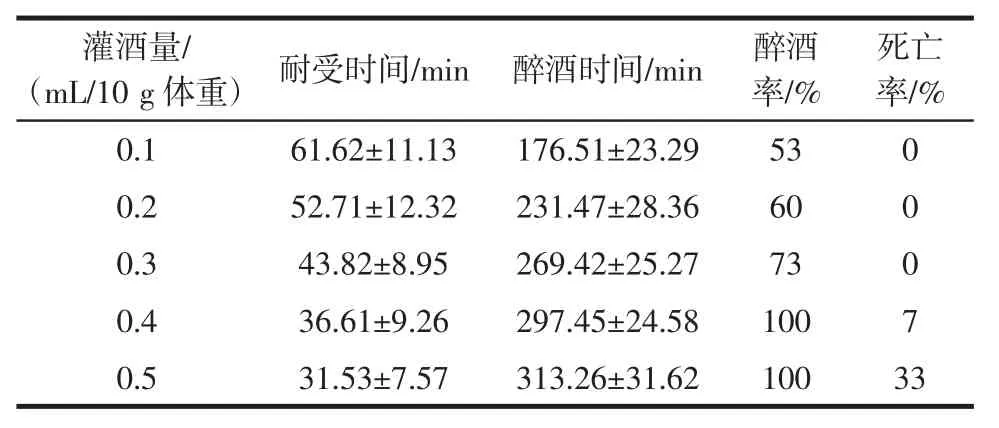
表1 小鼠醉酒模型的建立Table 1 Establishment of drunkenness model in mice
当给酒量在0.1 mL/10 g~0.5 mL/10 g 范围内时,随着给酒量的增加,小鼠的醉酒时间、醉酒率和死亡率都明显升高,耐受时间降低;其中0.4 mL/10 g 和0.5 mL/10 g 灌酒组醉酒率均达到100%,小鼠表现为后腹拖地,翻正反射消失。相比之下,0.5 mL/10 g 灌酒组有5 只小鼠死亡,醉酒致死率最高;而0.4 mL/10 g灌胃组只有1 只小鼠死亡,综合考虑,本实验确定0.4 mL/10 g 为建立小鼠醉酒模型的剂量。
2.2 山药多糖对醉酒小鼠醉酒潜伏期和醉酒时间的影响
山药多糖对醉酒小鼠醉酒潜伏期和醉酒时间的影响见表2。

表2 山药多糖对小鼠醉酒潜伏期和醉酒时间的影响Table 2 Effects of rhizoma dioscoreae polysaccharide on the drunked latency and sleeping time of drunk of mice
与模型组相比,山药多糖低剂量组既能增加小鼠醉酒耐受时间和减少醉酒时间(P<0.05)。山药多糖中、高剂量组的醉酒潜伏期显著延长,醉酒维持时间显著缩短(P<0.01)。
2.3 山药多糖对醉酒小鼠血液生化指标的影响
山药多糖对醉酒小鼠血清乙醇和乙醛浓度的影响情况见表3。

表3 山药多糖对醉酒小鼠血清乙醇和乙醛浓度的影响Table 3 Effects of rhizoma dioscoreae polysaccharide on serum alcohol and acetaldehyde content
采用气相色谱法对醉酒小鼠血清中乙醇和乙醛的浓度进行了检测,结果表明,与模型组相比,山药多糖低剂量组既能降低醉酒小鼠血清中乙醇(P<0.05),山药多糖中、高剂量组降低乙醇浓度更为显著(P<0.01);与模型组相比,山药多糖各剂量组均能显著降低醉酒小鼠血清乙醛浓度(P<0.01)。
2.4 山药多糖对醉酒小鼠肝脏生化指标的影响
山药多糖对醉酒小鼠肝脏生化指标的影响见表4。
AST 和ALT 是临床上判断是否存在肝功能异常的重要指标。在本实验中,与对照组相比,模型组小鼠的ALT 和AST 活性显著升高(P<0.01),说明酒精对肝功能造成了一定的损害。而与模型组比较,低、中、高3个山药多糖给药组血清中ALT 和AST 活性降低明显(P<0.01),表明山药多糖对急性酒精中毒引起的肝细胞损伤具有一定的保护作用。SOD 活性和ADH 活性也是评价肝脏功能的重要生化指标,在我们试验中,3种剂量的山药多糖还能够显著增高肝组织中SOD 活性和ADH 活性(P<0.01);进一步提示山药多糖可以预防急性酒精中毒造成的小鼠肝损伤氧化应激情况,对小鼠的肝脏起到保护作用。数据显示,山药多糖低剂量组既能较好的起到降低ALT 和AST 活性、升高SOD 和ADH 活性效应(P<0.05),与低剂量给药组相比,山药多糖中、高剂量组降低ALT 和AST、升高SOD和ADH 活性的能力更加显著(P<0.01)。

表4 山药多糖对醉酒小鼠肝脏AST、ALT、ADH 和SOD 活性的影响Table 4 Effects of rhizoma dioscoreae polysaccharide on AST,ALT,ADH and SOD activity in liver of drunk mice
3 结论与讨论
急性酒精中毒是酒精服用过量后引起的一种中枢神经系统障碍状态。当饮酒过量时,机体已经无法对乙醇进行有效分解,导致大量的乙醇经血液循环进入大脑并作用于中枢神经系统,进而产生恶心、呕吐、甚至神志不清等一系列不良反应。
乙醇脱氢酶(ADH)是乙醇代谢过程中的关键酶,其活力水平决定乙醇代谢能力的高低[17]。另外,过量饮酒会在机体内产生大量的氧自由基和脂质过氧化物,进而对肝细胞造成不同程度的损伤。超氧化物歧化酶(SOD)是机体内清除氧自由基的重要酶之一,可通过清除体内的超氧阴离子来阻断过氧化反应,进而保护细胞免受氧自由基的攻击。
谷丙转氨酶(ALT)、谷草转氨酶(AST)活性变化是肝细胞受损的间接标志,当酒精造成肝细胞损伤时,会出现细胞膜被破坏,同时细胞通透性增加,使肝细胞中的ALT 与AST 渗入血液进而引起血清中的活性升高,因此临床上常用于肝功能水平的评价指标[18]。
山药多糖是山药最重要的功能组分,已被证明具有抗氧化、提升免疫、降低血糖等多种功能活性[19]。在研究中,发现山药多糖可通过影响乙醇代谢和脂质过氧化等多种途径产生肝细胞保护作用。实验中还发现,山药多糖能显著延长醉酒耐受时间,缩短睡眠时间,降低乙醇和乙醛质量浓度,进而对醉酒小鼠急性酒精中毒产生一定的解毒作用。实验结果充分表明,山药多糖对急性酒精中毒小鼠具有较为显著的解酒作用,在保护酒精造成的肝脏功能损伤方面具有较大的应用价值。尽管本研究已经证明了山药多糖的解酒功效,但山药多糖解酒作用的具体机制,以及是否能与葛根、枳椇子等经典的解酒护肝药材产生协同解酒作用,目前仍不明确。有报道称葛根可通过影响白细胞介素-10、白细胞介素-6 和抑制一氧化氮蛋白表达,来抑制酒精代谢产生的炎性变化[20-21],山药多糖是否也是通过这些细胞因子来产生解酒抗炎作用,仍需要在进一步研究中加以探索。
