混合浮床对南海湖湿地富营养化水体修复的作用
2019-10-11王志超王智超缪晨霄杨文焕于玲红张明钰宋嘉乐李卫平
王志超, 王智超, 缪晨霄, 杨文焕, 于玲红, 张明钰, 宋嘉乐, 李卫平
(1.内蒙古科技大学 能源与环境学院, 内蒙古 包头 014010; 2.包头南海子湿地保护区管理处, 内蒙古 包头 014010)
N,P营养盐作为植物所需的基本元素,对植株的长势起着决定性作用。但随着其在地表水中浓度的不断增加,由此带来的水体富营养化问题也越发严重,这不仅会破水环境中生物的多样性,还可能导致生态完整性的丧失,引起如藻类水华频发、沉水植物消失、潜在毒素滋生等现象的发生[1]。因此对于富营养化水体的改善,根本途径在于对水体N,P营养盐的去除[2]。传统的理化方法往往治标不治本,不仅成本高且易出现反复,而生态浮床不仅具有原位修复的特点,且造价低廉结构灵活,不产生二次污染。同时还具有污染扩散防治、修剪护岸、栖息地保护、水质净化及景观绿化等多种功能[3]。浮床对水质的净化主要由浮床植物实现,而浮床植物则通过吸收水体中营养物质实现自身增长,其中一些植物在过量吸收氮养的同时,甚至可以降解水体中的有毒化学物质[4]。且随植株生长,水下繁密的根系所分泌的生物粘附介质对水中污染物也可起到一定吸附作用,实现污染物与植物的结合并有效利用。同时这种粘附介质还可起到除水中悬浮颗粒(SS)的作用,提升水质并改善透明度[5]。对于依赖光合作用的藻类而言,漂浮于水面的生态浮床可形成一定的遮光效应,间接减少了藻类对于光源的获取,且由于植物与藻类间对营养盐存在竞争关系及化感作用,也进一步使藻类的生长得到抑制。目前,利用生态浮床技术防治水体富营养化在我国已取得了一定的成果。Chang Yuanhsiou等[6]研究了一种以太阳能板为曝气能源的生态浮床对校园废水的净化效果;郭一鸣等[7]建立了一种新型生态浮床用于恢复沉水植物的生长并对水中营养盐进行吸收;Wang Wenhuai等[8]以高密聚乙烯浮板为载体,研究了强化生态浮床对城市景观水体的净化效果。然而,但在目前众多研究中,侧重点更多偏向于新型组合浮床对小型封闭静态水体污染物的去除效果,有关植株在自然开放水域的生长特性、植物交互作用对植株分蘖繁殖的影响及植株N,P累积量与生物量关系方面的研究仍少为报道。为此,本试验从以上3个方面入手,在南海湖生态修复试验工程中,通过单植物与混合植物两种浮床体系的搭建,研究其对富营养化水体的净化效能及水域环境改善能力,分析植物交互作用与水质净化的关系,为后期南海湖规模化建设提供理论依据和经验基础。
1 材料与方法
1.1 研究区概况
南海湖(40°30′8″—40°33′32″N,109°59′2″—110°2′26″E)位于内蒙古包头市东河区南侧,属半干旱中温带大陆性季风气候。年平均降雨量不足400 mm,年蒸发量约2 300 mm,最冷1月平均气温-11.8 ℃,最热7月平均气温22.9 ℃。整个湖体的形成源自于黄河改道,以黄河水、地下水及大气降水作为主要补水来源,全年光照充足,光能与渔业资源丰富。同时由于保护区地处全球候鸟迁徙的重要途径路线,也使其成为鸟类栖息的重要场所之一[9]。研究水域主要指标详见表1。
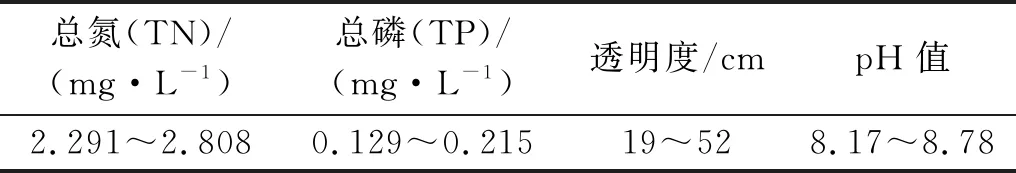
表1 试验水域水体指标
1.2 供试植物
浮床植物作为生态浮床中最为重要的组成部分,其选择的合理性直接影响着浮床整体的净化效果。目前可用于生态浮床的植物可大致分花卉类、蔬菜类、饲料类及水生植物类。而为作为浮床核心技术,植株本身也应具有无害化、易驯服、可水生、易维护等特点。考虑到试验场地处于高原寒旱区,从每年11月份起进入为期长达5个月的冰封期,植物在自然环境下最佳生长日期多集中于6—9月间,且整体土壤环境及水质pH值均呈弱碱性。因此植物的易驯服性和本土性应作为植株选择的首要因素[10]。通过文献查阅[1-2]以及与当地多年从事植物种植和研究的相关人士进行沟通调研后,最终选取水葱(Scirpusvalidus)、千屈菜(Lythrumsalicaria)、风车草(Cyperusalternifolius)作为本试验浮床植物供以研究。
1.3 生态浮床构建
试验场地位于南海湖鸟类博物馆西侧,该区域游客稀少,人为干扰因素较低,同时为减少水体交换作用对净化效果的干扰,提前采用防水布沿岸边进行水体隔离,形成约600 m2的独立水域。试验采用0.3 m×0.3 m的正方形高密度聚乙烯空心塑料基盘作为浮床材料,各基盘用螺丝链接,每个基盘1个植物种植孔,种植密度为9株/m2,浮床总面积设计为64 m2,共分4组,每组16 m2,长、宽皆为4 m,平均覆盖率11%。为研究植物交互作用对水质净化效果的影响,试验采用单植物种植与交叉混合种植两种方式进行浮床搭建。前3组为单植物浮床,分别种植水葱、千屈菜、风车草,第4组为混合植物浮床,按照3种植物1∶1∶1的方式进行种植,具体如图1所示。
1.4 试验方法
1.4.1 试验植物 于7月初栽种,并于9月末进行收割,植物生长期间,每隔15 d对其生长状况及浮床周边水域TN,TP浓度变化进行采样监测。在浮床四周距水面30 cm深处分别设置4各采样点,各浮床整体数据以4组数据平均值为准。采样时间设置为10:00—12:00。具体时间安排详见表2。

注:A为水葱; B为千屈菜; C为风车草。图1 混合浮床每1 hm2面积的种植方式

表2 2019年7-9月植物及水质样本采集时间
1.4.2 统计植物成活率,定期采集植物样本进行分析测量 现场随机抽取3株植物(包括茎叶与根部)洗净后带回实验室,主要测试指标包括株高、分蘖数、鲜重、干重、植物体内氮磷含量等。首先用吸水纸将植物表面水分吸干测量鲜重,后将植物置于烘箱内在105 ℃下杀菌3 h,并于80 ℃烘至恒重,记录植株干重。最后将烘干的植物粉碎过60目筛,经浓H2SO4-H2O2法消煮,定容检测。具体方法详见表3。

表3 浮床水域水质指标及植物体氮磷含量检测方法
2 结果与分析
2.1 两种浮床体系植物的生长特性
两种体系浮床中3种植物单株分蘖数的变化如图2所示。随时间变化,植株的分蘖繁殖呈不同变化趋势,由于植物对试验区水体存在适应过程,3种植物分蘖情况整体呈前期缓慢中后期增快的现象。其中风车草、水葱的分蘖过程比千屈菜更明显,单株分蘖数相比千屈菜每整株多2~4株。从移栽前到8月初,各浮床体系植物长势基本接近,但由于植物交互作用对内源激素分泌的影响,使得后期同种植物在不同浮床中的分蘖发育有所差异[11]。其中水葱在8月间的分蘖最为迅速,至8月末单植物浮床整株分蘖数达18株,混合浮床分蘖数达20株。而至此之后到试验结束前风车草则体现出了较强的繁殖能力,单植物浮床平均分蘖数26株,混合浮床达30株。
图3显示了各植物移栽前与收割后的生物量变化。从图3可以看出,两浮床体系植株生物量(鲜重)变化明显,单植物浮床中水葱、千屈菜、风车草整株生物量分别为移栽前的113,195和205倍,而混合浮床可分别达到127,221和233倍,直至收割后,混合浮床中水葱和风车草整株生物量(鲜重)达1.43和1.98 kg/株,相比单植物浮床增量12.32%~15.16%。结果表明,混合浮床中同种植物的长势要优于单植物浮床。因为4组浮床处于同一水域,影响植株分蘖繁殖的诸多因素中,如光照、温度、种植密度及养分,其来源皆具有同源性,这种情况下植物内部激素的变化对分蘖的调控就占据了主导地位[12]。在植物生长过程中,细胞分裂素作为内部激素的主要成分,其分泌情况直接影响植株的生长态势。又因为混合浮床中植物交互作用只能通过植株根细在水下进行,而细胞分裂素的主要合成场所又集中于植株根部,说明植物交互作用对细胞分裂素等植物激素的合成起到了一定的促进作用。同时细胞分裂素又可以增强植物对氮素的利用率[13-14],间接增强了混合浮床植株的分蘖繁殖,因此相比之下混合浮床的植株生物量要高于单植物浮床。

图2 单植物浮床与混合浮床中各植物分蘖数变化

图3 栽植前后单植物与混合植物浮床各植物生物量对比
2.2 两种浮床体系中植物体对N,P的吸收
两种浮床系统中,植物N,P的吸收能力如图4所示。通过显著性检验分析,3种植物对于N,P的吸收能力均存在差异性,就N吸收能力而言,千屈菜与水葱、风车草存在显著关系(p<0.05),而对P吸收能力而言,3种植物差异则更为明显(p<0.05),千屈菜的平均N,P吸收能力可达10.08和3.40 g/kg,分别为水葱和风车草的1.54和2.26倍。而相比之下同种植物在两种浮床系统中的单株N,P吸收能力则表现出相同水平(p>0.05)。结果表明,由混合栽种方式产生的交互作用无法干扰植物自身对N,P的吸收。原因是植物的生长状况主要由遗传因素、环境(外源)因素以及内源因素决定[15],植物的形态及木质素合成皆由遗传物质主导,并直接决定植物体营养盐吸收饱和度,而植物间交互作用仅仅作为一种外源刺激因素,虽然可以间接影响植物内部激素分泌,但从根本上讲却无法改变3种植物自身的遗传特性[16],改变N,P吸收能力。结合图5可知,尽管3种植物各自N,P吸收能力存在差异,但整株累积量却呈现相反趋势。不难看出,千屈菜由于物种优势,对N,P营养盐具有较高的吸收能力,但整株N,P累积量却稍显乏力,受分蘖数及自身条件限制,收割后千屈菜整株生物量仅为水葱和风车草的67%和49%,表明各植物体N,P累积量差异仍主要来自于生物量的差异[17]。同时,混合浮床中各植株N,P累积量均高于单植物浮床,更加说明生物量对于植物体N,P累积的重要性。
表4数据显示了各浮床体系N,P累积的具体情况。各浮床单位面积N,P吸收能力,可由植物收割后与栽植前体内N,P含量的差值,再结合种植密度及植物成活率求得。根据计算结果,单位面积N吸收均风车草浮床最高,达12.169 g/m2,混合植物浮床次之,为11.257 g/m2。单位面积P吸收量混合浮床最高达2.602 g/m2,千屈菜其次为2.473 g/m2。尽管风车草N吸收能力较强,但P吸收量仅2.063 g/m2,为各浮床最低。综合考虑,混合浮床更适合作为南海湖富营养化水体修复的浮床形式推广使用。

图4 单植物浮床与混合植物浮床各植物N,P吸收能力对比

图5 单植物浮床与混合植物浮床各植株N,P累积量对比表4 浮床植物收割后N,P累积量

植物名称干重/(g/株)栽前栽后(单)栽后(混)N含量/(g/株)栽前栽后(单)栽后(混)N吸收量/(g/株)单一混合成活率/%N吸收量/(g·m-2)单一混合水葱0.77150.72170.370.0271.2161.2921.1891.26592.79.919千屈菜1.21137.90155.130.0310.8900.9920.8590.96194.17.27411.257风车草1.15236.15272.480.0171.4041.6101.3771.59389.212.169植物名称干重/(g/株)栽前栽后(单)栽后(混)P含量/(g/株)栽前栽后(单)栽后(混)P吸收/(g/株)单一混合成活率/%P吸收量/(g·m-2)单一混合水葱0.77150.72170.370.0020.2810.3170.2790.31592.72.327千屈菜1.21137.90155.130.0030.2950.3300.2920.32794.12.4732.602风车草1.15236.15272.480.0020.2590.2300.2570.29889.22.063
2.3 两种浮床体系对水体TN,TP的净化效果
2.3.1 两浮床体系对水体TN的净化效果分析 试验各浮床水体TN含量随试验天数的变化曲线如图6所示。
由图6可知,初始阶段,由于植株处于对试验水域的适应期,故分蘖较为缓慢,各组浮床水体TN浓度变化不明显。试验15 d后,正直七月中旬,植物进入迅猛生长期,生物量变化显著,水质净化效率随之提升,试验15~60 d千屈菜分蘖繁殖表现出相对优势,TN去除效率较高,但由此之后呈减缓态势。相比而言,其他3组浮床TN浓度变化趋势相近,其中风车草处理效果最好,而一开始除N较强的千屈菜则表现较差。试验30~45 d,各个浮床水体TN去效率有所减缓,在这之后整体又呈升高趋势,原因是浮床在水面上所形成的阴影区,长时间削减了藻类对于光源的获取,不但使其生长得到限制,也使得部分藻类因体循环失效而死亡分解,原本被藻类吸收的氮素又被释放回水体中[18],此时又正值植株营养盐最佳摄取阶段。因此,虽然TN去除效率相对降低,但整体去除效果仍呈升高趋势。到九月中旬即试验持续75 d后进入秋季,各植株对氮素的吸收相继进入饱和阶段,植物根系对营养物质的黏附作用有所削减,此时水体中TN的去除已由植物吸收逐渐向微生物吸附降解转化[19],加之受温度影响,植物生长速率、微生物数量及活跃程度均有所下降,因此各浮床水体TN浓度变化速率逐渐变缓[20]。
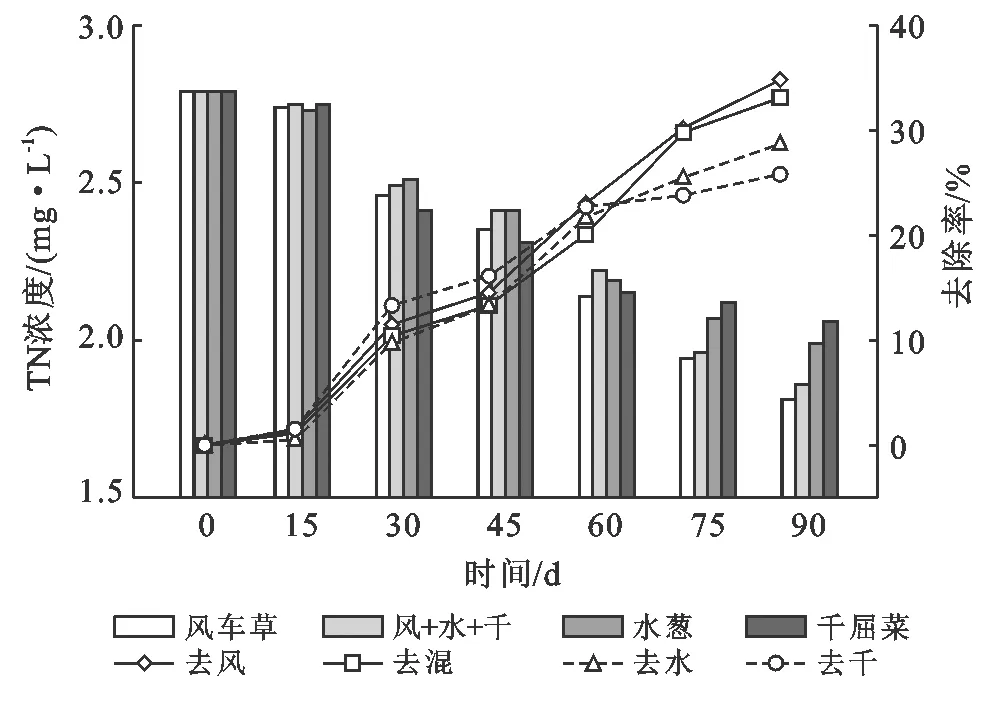
注:风+水+千表示水葱、千屈菜、风车草这3种植物的混合植物浮床;去风表示风车草植物浮床的TN去除率,去混表示混合植物浮床的TN去除率,去水表示水葱植物浮床的TN去除率,去千表示千屈菜植物浮床的TN去除率。下同。
图6 两种浮床体系水体TN含量变化
由于表5数据可知,至试验第90 d,4组浮床对水体中的氮素均具有较好的消减作用。去除效果最好的风车草浮床,水体TN浓度从2.78 mg/L下降到1.81 mg/L,去除率达到34.9%。其次是混合浮床和水葱,质量度分别下降至1.94和1.98 mg/L,去除率分别为33.1%和28.0%。

表5 各浮床对水体TN的去除效果
2.3.2 两种浮床对水体TP的净化效果 两种浮床体系对水体中TP去除效果如图7所示。各浮床对水体TP去除速率随时间变化均呈现慢→快→慢的变化趋势,试验35~75 d,由于物种自身优势,千屈菜在TP去除效率上明显优于其他植物。受其影响,混合浮床TP去除速率也随之加快。在此期间,伴随各植株的迅猛生长,植物根细越发繁密,依附于根系的微生物得以大量繁殖,这也为聚磷菌的生长创造了良好环境[21-22],同时植株光合作用产生的部分氧气也借助植物根系释放到水中,形成了一定的氧化太微环境,促进了聚磷菌对水体中P的超量吸收[23]。加之温度和光照强度等因素的协同作用,使得此阶段各浮床TP浓度明显降低。而此后虽然生物量仍在增长,但随温度的降低,微生物活性的减弱,且各植株对N,P的吸收近乎处于饱和状态,因此TP去除率变化趋势也相对平缓。到试验结束时,由于各植株生长规律不同,对营养盐需求量、自身饱和程度,根部聚磷菌数量及活性均存在差异,使得浮床整体TP去除总量各有不同。

图7 两种浮床体系水体TP含量变化
由表6可知,4组浮床中混合浮床对水体TP的去除能力最强,质量浓度由0.149 ml/L下降到0.084 ml/L,去除率达43.3%。水葱、千屈菜、风车草浮床水体TP质量浓度分别下降到0.096,0.092和0.102 mg/L,去除率按顺序依次为:千屈菜(38.2%)>水葱(35.5%)>风车草(33.4%)。

表6 各浮床对水体TP的去除效果
2.4 不同植物分蘖数与TN,TP去除率相关性
本研究对不同植物不同时期的分蘖数和TN,TP去除率进行相关性分析。结果表明,对于N的去除而言,同一时期植物分蘖数与浮床对水体TN的去除率在0.99置信度下的相关系数可达到0.950,说明两者相关性显著,其曲线拟合结果如图8所示;对于P的去除而言,分蘖数与浮床对水体TP去除率在0.99置信度下的相关性为0.918,表明植物分蘖数与TP的去除率同样呈现显著相关关系,两者曲线拟合结果如图8所示。由相关性分析结果可知,植物分蘖数与其所对应的浮床对水体TN,TP去除效果存在必然联系,即在交互作用影响下,植物分蘖繁殖得以间接增强,同等条件下整株植物生物量随之增高,尽管各植物对N,P的吸收能力存在差异,但植物体本身对N,P营养盐的累积量仍由其自身生物量决定[24],在同一水域环境前提下,由于植物对N,P吸收的增加,使得水体TN,TP浓度随之下降。相关性分析结果与植物体内氮磷累积量差异主要来自于生物量差异的结论是相吻合的。其相互关系可简单表示为:
交互作用→分蘖繁殖增加→生物量升高→植物体N,P累积增加→水体TN,TP浓度降低→富营养化程度减轻。

图8 植物分蘖数与水体TN,TP去除率曲线拟合关系
3 结 论
(1)试验所选3种植物对南海湖水体均具有一定耐受性,皆可作为南海湖生态工程备选植物。
(2) 试验结束时,混合浮床中水葱、千屈菜及风车草的分蘖数分别为26,18和30株,相比单植物浮床每整株多2~4株;3种植物生物量(鲜重)分别达1.43,0.96和1.98 kg/株,相比单植物浮床增量12.32%~15.16%。
(3) N吸收方面风车草浮床最佳,达12.169 g/m2,P吸收方面则混合浮床最好,为2.602 g/m2,从整体上看混合浮床对N,P的吸收仍相对全面,分别为11.257和2.602 g/m2。
(4) 各植物浮床对水体N,P去除率依次为TN:风车草(34.9%)>混合浮床(33.1%)>水葱(28.0%)>千屈菜(25.6%);TP:混合浮床(43.3%)>千屈菜(38.2%)>水葱(35.5%)>风车草(33.4%)。
