探讨鞘内注射siRNA-P300通过cAMP-PKA-CREB通路对神经病理性痛大鼠镇痛效果的影响*
2019-10-10刘志军姜云峰胡兵伟
刘志军,姜云峰,胡兵伟
(浙江省立同德医院麻醉科,杭州 310012)
脊髓损伤是一种在医疗实践中观察到的极其严重的身体创伤,影响着全世界200多万人的生活质量。脊髓损伤患者最常见的症状是慢性神经性疼痛。因此,开发有效的治疗药物对于脊髓损伤患者具有临床重要性[1-3]。研究发现脊髓损伤通过环磷酸腺苷(cyclic adenosine monophosphate,cAMP)-蛋白激酶A(protein kinase A,PKA)-反应元件结合蛋白(cAMP response element-binding protein,CREB)通路导致背角神经元和损伤部位的突触电路发生明显变化,进而导致神经细胞受体的表达异常,局部炎性细胞因子和活性氧物质的释放,小胶质细胞和其他免疫细胞中免疫应答激活[4-5]。PKA是G蛋白偶联受体的家族成员,研究表明脊柱L4~L6水平约60%的背根神经节神经元含有PKA。通过外周或中枢施用非炎性剂量的PKA激动剂刺激PKA可引起大鼠的机械痛觉和热痛觉过敏。研究进一步表明,P物质和降钙素基因相关肽(CGRP)的释放通过激活PKA促成急性和慢性疼痛[6-7]。在具有神经性疼痛的实验动物模型中,PKA的表达在诱导疼痛后的脊髓背角中上调,并且阻断脊髓背角PKA消除了在动物中观察到的机械痛觉和热痛觉过敏。P300是高等真核生物中作用广泛的辅助激活因子,也是一类组蛋白乙酰转移酶,近期研究发现,P300能够抑制疼痛相关基因及其上下游转录因子的表达,其可能是神经病理性痛的关键治疗点[8-9]。本研究拟基于cAMP-PKA-CREB通路探讨P300小干扰RNA(siRNA-P300)鞘内注射对神经病理性痛大鼠镇痛效果的影响,为脊髓损伤引起的神经病理性痛的治疗提供理论基础。
1 材料与方法
1.1动物分组及染毒 成年Sprague-Dawley大鼠(体质量180~200 g)60只由南京医科大学实验动物中心提供[合格证号:SCXK(苏)2014-0002]。在无特定病原体(SPF)、温度(22±2)℃、湿度40%~70%、2 h光照/黑暗循环(上午8:00光照)的软垫层条件下饲养,每笼5只,大鼠自由摄取饲料、自由饮水。实验进行前,动物适应喂养2 h。将大鼠分成3组:对照组、模型组、siRNA-P300组,每组20只,雌雄各半。实验严格按照《中华人民共和国实验动物管理条例》和《实验动物质量管理方法》进行,动物实验获得本院动物研究委员会的批准。
1.2各实验组的制备 模型组、siRNA-P300组大鼠制备坐骨神经慢性压迫性损伤(CCI)模型。具体操作如下:大鼠禁食、禁水12 h,水合氯醛(300 mg/kg,腹膜内)诱导麻醉。将每只大鼠左侧大腿中部的坐骨神经暴露,在坐骨神经三叉神经的近端,将大约7 mm的神经与黏附的组织分离,用4根结扎线松散地系在它周围,结扎之间距离约1 mm。手术后,缝合皮肤层和肌肉,手术区域用碘消毒。对照组仅暴露坐骨神经,不予结扎,并缝合皮肤层和肌肉。siRNA-P300组于造模成功后第1天开始给予siRNA-9300鞘内注射(注射剂量1.0 mL/100 g),具体操作流程为:在麻醉下,在L5和L6椎骨之间插入26 G规格的针头,注射约10 μL含有siRNA-P300混合物(0.2 μg/μL,美国Santa Cruz Biotechnology公司)的工作溶液,持续给药3周,对照组和模型组鞘内注射等体积生理盐水。实验结束后,每5分钟观察大鼠疼痛行为学1次,并计算疼痛加权评分(PIS):大鼠舔咬注射足或抽动为Ⅳ级;足抬起,不接触玻璃缸面为Ⅲ级;足掌轻微接触玻璃缸面,活动时有跛行为Ⅱ级;PIS=(TⅡ+2×TⅢ+3×TⅣ)/300,其中TⅡ、TⅢ、TⅣ分别为5 min内出现Ⅱ、Ⅲ、Ⅳ级行为的时间(s)。
1.3腰椎脊髓病理切片制作 腰椎脊髓组织常规脱水、包埋、切片,于二甲苯(Ⅰ) 15 min、二甲苯(Ⅱ) 15 min、二甲苯∶无水乙醇=1∶1 2 min、100%乙醇(Ⅰ) 5 min、100%乙醇(Ⅱ) 5 min、80%乙醇 5min、蒸馏水 5 min、苏木精液染色5 min、水洗10 min或流水冲洗5 min、1%盐酸乙醇30 s、水洗30 s、蒸馏水过洗5 s、0.5%伊红液染色1~3 min、蒸馏水稍洗30 s、80%乙醇稍洗30 s、95%乙醇(Ⅰ)1 min、95%乙醇(Ⅱ) 1 min、无水乙醇 (Ⅰ)3 min、无水乙醇(Ⅱ)3 min、二甲苯(Ⅰ) 3 min二甲苯(Ⅱ) 3 min、中性树胶封固。
1.4机械痛阈值、热痛阈的测定 各组大鼠处死前,根据文献[9]方法测定机械痛阈值、热痛阈。具体操作:美国Ⅱ TC公司生产的2390 series 电子 von Frey 压力测痛仪触压大鼠左足第3、4趾间的皮肤,当大鼠出现后足抬起、迅速回缩反应时读取数值作为热痛阈;热辐射刺激仪照射大鼠右侧足底紧贴玻璃板部位,记录抬足时间为机械痛阈值,截止时间为25 s。
1.5cAMP、PKA、CREB mRNA在脊髓组织中表达的测定 通过使用TRIzol试剂(美国Life Technologies公司)从同侧脊髓分离总RNA,并使用Oligo(dT)18引物将其反转录成cDNA。使用Applied Biosystems7300实时PCR系统(美国Applied Biosystems公司)进行实时定量PCR(qPCR)。qPCR引物如下,cAMP:正向5′-TCT TTC CTA CAA CAG CCT CCG-3′,反向5′-TAA ATG CTC GCT TCA AAC TCA G-3′;PKA:正向5′-TCG AAG GCG ACC TCA AGT G-3′,反向5′-TTC GGT GTA GCT TTG GAT CCA-3′;CREB:正向5′-ACC GTC GCC CAT CAT CAA-3′,反向5′-TTG CAC TGC CAA CTC TTT GTC T-3′;GAPDH:正向5′-ATG ACT CTA CCC ACG GCA AG-3′,反向5′-CTG GAA GAT GGT GAT GGG TT-3′;其中GAPDH用作内参。qPCR反应条件:94 ℃预变性10 min;94 ℃ 10 s,55 ℃ 10 s,72 ℃ 10 s,40个循环。使用阈值循环(Ct)方法分析数据,并将结果表示为倍数差异。实验重复3次。
1.6cAMP、PKA、CREB在脊髓组织中表达的测定 通过腹腔注射水合氯醛(300 mg/kg)深度麻醉后,用生理盐水经心脏灌注动物,然后用0.1%磷酸盐缓冲液(PBS)配制的pH为7.4的4%多聚甲醛灌注20 min。于L4和腰椎将脊髓片段解剖出来并在4%多聚甲醛中固定,然后切成25 μm厚。将每组的切片与山羊抗体鼠cAMP(1∶200)、PKA(1∶100)、CREB(1∶100)一抗一起孵育。然后,用PBS洗涤切片并与二抗孵育。用PBS洗涤3次后,在免疫荧光显微镜(Zeiss AX10,徳国)下研究样品的免疫荧光染色的形态学细节。双盲进行检查。随机编码图像,并通过Image Pro Plus 6.0软件(美国Media Cybernetics Inc.Rockville公司)分析。染色评分标准:0表示小于5%阳性染色细胞(阴性染色);1+表示5%~20%阳性染色细胞(弱表达),2+表示21%~50%阳性染色细胞(中表达),3+表示大于50%阳性染色细胞(强表达)。染色强度评分为0~3(0,阴性;1,弱;2,中等;3,强)。然后将数量和染色强度评分的值相乘,得到范围为0~9的结果。
1.7ELISA测定大鼠脊髓组织中cAMP、PKA、CREB、白细胞介素(IL)-2、IL-6、肿瘤坏死因子α(TNF-α)水平 无菌条件下,称取0.1 g脊髓组织,加入少量液氮,在研钵中迅速将海马组织碾碎至粉末状;将组织粉末转入2 mL Eppendorf管中,加入1.2 mL PBS(pH为7.4),充分振荡混匀,2 000×g、4 ℃离心20 min,收集上清液。大鼠cAMP、PKA、CREB、IL-2、IL-6、TNF-α ELISA试剂盒购自美国R&D Systems公司。使用酶标仪(Model 550,美国Bio-Rad公司)在450、512、539、429、529、487 nm波长下读取吸光度(A)值。实验重复3次。
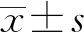
2 结 果
2.1各组大鼠机械痛阈值、热痛阈、PIS的比较 与对照组比较,模型组、siRNA-P300组机械痛阈值、热痛阈降低,PIS升高(P<0.05);与模型组比较,siRNA-P300机械痛阈值、热痛阈升高,PIS降低(P<0.05)。见表1。
2.2各组大鼠脊髓组织病理形态学比较 对照组脊髓区神经元细胞完整,结构正常,染色清晰,细胞核呈卵圆形位于中央;模型组脊髓区可见大量坏死神经元,且细胞脱失现象明显,细胞核固缩,可见中性细胞及少量嗜酸性细胞浸润;siRNA-P300组脊髓区见少量坏死神经元,且神经元细胞结构较为完整,神经元细胞核呈卵圆形位于中央,分布均匀。见图1。
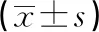
表1 各组大鼠机械痛阈值、热痛阈、PIS的比较
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较
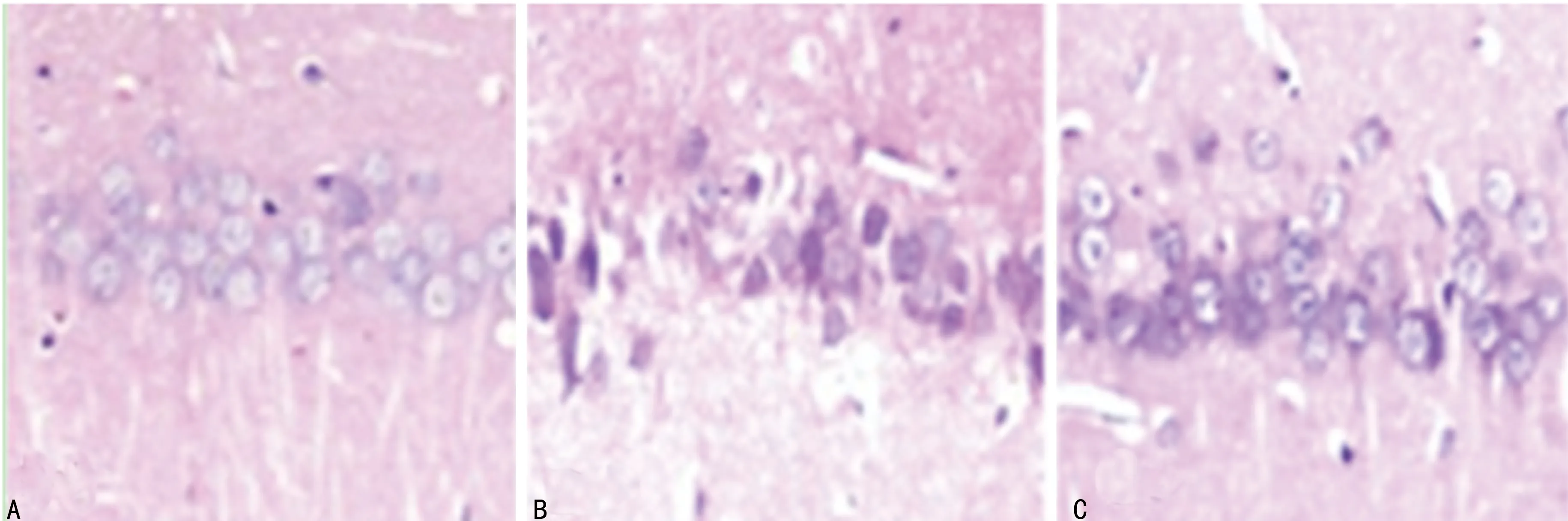
A:对照组 B:模型组 C:siRNA-P300组
图1各组大鼠脊髓组织病理形态学观察(苏木素-伊红×400)
2.3各组大鼠脊髓cAMP、PKA、CREB mRNA表达水平比较 与对照组比较,模型组、siRNA-P300组脊髓cAMP、PKA、CREB mRNA表达水平明显升高(P<0.05);与模型组比较,siRNA-P300组脊髓cAMP、PKA、CREB mRNA表达水平明显降低(P<0.05)。见表2。
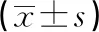
表2 各组大鼠脊髓cAMP、PKA、CREB mRNA表达水平比较
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较
2.4各组大鼠脊髓cAMP、PKA、CREB表达评分比较 免疫组织化学法下,cAMP、PKA、CREB主要定位于细胞核,其阳性表达为棕褐色;与对照组比较,模型组、siRNA-P300组脊髓cAMP、PKA、CREB表达评分明显升高(P<0.05);与模型组比较,siRNA-P300组脊髓cAMP、PKA、CREB表达评分明显降低(P<0.05)。见表3、图2。
2.5各组大鼠脊髓IL-2、IL-6、TNF-α表达水平比较 与对照组比较,模型组、siRNA-P300组脊髓IL-2、IL-6、TNF-α表达水平明显升高(P<0.05);与模型组比较,siRNA-P300组IL-2、IL-6、TNF-α表达水平明显降低(P<0.05)。见表4。
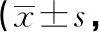
表3 各组大鼠脊髓cAMP、PKA、CREB表达评分比较分)
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较
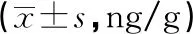
表4 各组大鼠脊髓IL-2、IL-6、TNF-α表达水平比较
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较

图2 各组大鼠脊髓部cAMP、PKA、CREB表达情况观察(免疫组织化学×400)
3 讨 论
脊髓损伤引起的神经性疼痛与感觉异常及改变的刺激-反应功能有关,例如异常性疼痛,痛觉过敏和某些区域的感觉丧失。国际疼痛研究协会将神经性病理痛定义为“由躯体感觉神经系统的病变或疾病引起的疼痛”。神经性疼痛对患者的生活质量造成沉重负担,而目前可用的治疗方法效果通常存在局限。神经性病理痛的潜在分子机制仍然很难阐明,越来越多的证据表明,P300基因可能与神经性病理痛发病机制密切相关。P300基因在组织内广泛表达,其在各生物过程中发挥重要作用。P300通过桥接、支架或组蛋白乙酰转移酶(HAT)活性调节各种基因的表达,其在表观遗传学上导致炎症、肿瘤、神经退行性等疾病。siRNA可通过基因组中载体靶向沉默基因表达。鞘内应用siRNA已成为研究药物、受体或其他基因、蛋白质等小分子功能的有效方法[10-12]。研究已证实siRNA-P300能专一性抑制脊髓的P300 mRNA表达,导致P300介导的组蛋白乙酰化作用减弱,进而抑制各类疼痛相关转录因子的转录,最终缓解疼痛。本研究结果表明,与对照组比较,模型组、siRNA-P300组机械痛阈值、热痛阈降低,PIS升高;与模型组比较,siRNA-P300组机械痛阈值、热痛阈升高,PIS降低。结合病理学结果说明,siRNA-P300鞘内注射对脊髓区神经元细胞具有保护作用,对大鼠神经病理性痛具有镇痛效果。
PKA是G蛋白偶联受体的家族成员,同时也是一种非选择性阳离子通道。近期研究表明PKA可被多种内源性物理和化学刺激物激活,如高温,低pH(酸性条件),内源性大麻素和酰胺,N-油酰多巴胺和N-花生四烯酰-多巴胺等。PKA的激活导致痛苦的灼烧感[13-14]。PKA受体主要存在于外周神经系统的感受神经元中,但其也存在于包括脑和脊髓在内的中枢神经系统中。PKA参与疼痛的传递和调节,以及多种疼痛刺激的整合。有证据表明PKA具有调节外周和中枢神经系统神经性病理痛的作用[15-16]。近期研究表明,脊髓损伤大鼠浅表背角中PKA表达上调,PKA拮抗剂FSLLRY-NH2能减弱脊髓损伤诱发的机械痛觉和热痛觉过敏。cAMP、CREB分别是PKA的上、下游调控因子,研究表明cAMP、CREB也是参与神经性病理痛的两种重要神经递质物质,其表达水平在脊髓损伤大鼠的浅表背角中显著增加,在鞘内注射各自相应的抑制剂(SB366791、HC030031)后,大鼠机械痛阈值、热痛阈升高[17-18]。本次研究结果显示,与对照组比较,模型组、siRNA-P300组脊髓cAMP、PKA、CREB mRNA和蛋白表达水平明显升高(P<0.05);与模型组比较,siRNA-P300组脊髓cAMP、PKA、CREB mRNA和蛋白表达水平明显降低(P<0.05)。这与前述研究结果一致,同时也说明siRNA-P300可通过抑制cAMP-PKA-CREB通路的激活进而抑制神经病理性痛。近期研究发现,PKA在疼痛和神经源性炎症中具有功能性作用,PKA通过CREB通道活化各种化合物,包括刺激性物质、活性氧和炎症因子(IL-2、IL-6、TNF-α)等。本研究结果显示,与对照组比较,模型组、siRNA-P300组脊髓IL-2、IL-6、TNF-α表达水平明显升高(P<0.05);与模型组比较,siRNA-P300组IL-2、IL-6、TNF-α表达水平明显降低(P<0.05),这说明siRNA-P300抑制神经病理性痛与抑制cAMP-PKA-CREB通路的激活进而抑制炎症因子IL-2、IL-6、TNF-α的表达有关。
综上所述,siRNA-P300鞘内注射对脊髓区神经元具有保护作用,对大鼠神经病理性痛具有镇痛效果;其机制与siRNA-P300抑制cAMP-PKA-CREB通路的激活进而抑制炎症因子IL-2、IL-6、TNF-α的表达有关。
