血清miR-141和miR-195-5p在乳腺癌早期诊断中的临床意义
2019-10-09韩肖骅马保金
韩肖骅 马保金
(复旦大学附属华山医院普外科 上海 200040)
乳腺癌是常见的恶性肿瘤之一,全球每年新增病例约150万,严重危害女性的健康。早期乳腺癌预后较好,而晚期乳腺癌发生淋巴结转移和血性转移,预后往往较差,因此早诊断、早治疗可提高乳腺癌疗效及改善预后[1]。活组织检测有侵入性,且存在一定的取样误差,患者依从性不高。由于乳腺癌缺乏敏感的生物标记物,简便易行的乳腺癌早期诊断指标仍在探寻中。随着对肿瘤机制的研究越来越深入,微小RNA(miRNA)已经成为新型基因水平的肿瘤标记物,可用于肿瘤精确诊断,但组织标本获取有侵入性,限制了其在临床的应用[2]。血清miRNA相对较易获得,并且稳定性较好,在反复冻融、酸碱和煮沸等恶劣环境下不易降解,故循环miRNA受到越来越多的关注[3]。本研究通过检测血清miR-141和 miR-195-5p,观察其与临床指标、增殖和迁移的相关性,并评估其在乳腺癌早期诊断中的价值。
资料和方法
临床资料选择2015年1月至2018年6月在复旦大学附属华山医院诊断为乳腺癌的患者126例,作为乳腺癌组,平均年龄(52.37±6.37)岁(35~79岁);术后病理TNM分期:Ⅰ期22例,Ⅱ期43例,Ⅲ期50例和Ⅳ期11例;组织分级:Ⅰ级25例,Ⅱ级57例和Ⅲ级44例。选择同期在我院活组织检测为乳房良性病变患者75例,作为良性病变组,平均年龄(53.19±7.19)岁(45~76岁);选择同期在我院行健康体检者45例,为健康对照组,平均年龄(52.49±7.16)岁(45~73岁)。纳入标准:健康对照组和乳腺良性病变组无合并其他肿瘤;乳腺癌患者术前未行化疗、放疗等其他治疗(其中包括11例Ⅳ期术前不愿接受化疗和放疗的患者);所有患者均签订知情同意书。排除标准:非乳腺癌;肝炎、结核和急性肺炎等急慢性感染;脏器功能不全(如肝脏、肾脏和肺等);有疾病相关用药史。各组一般资料差异无统计学意义,各组比较的基线相同。
血液标本的抽取来院第1天和手术后1周抽取空腹肘静脉血约5 mL,室温静置20 min,3 000 r/min离心10 min (离心半径15 cm),分离出血清约3 mL,-80 ℃保存待检测。
血清miR-141和 miR-195-5p的检测采用苯酚氯仿法提取血清RNA。按照说明书进行miRNA的逆转录反应,其引物由上海昕浩生物合成。miRNA-141引物序列,正向:5’-ACACTCCAGCTGGGC-ATCTTCCAGTACAGT-3’,反向5’-CTCAACT-GGTGTCGTGGAGTCGCCAATTCAGTTGAGT-CCAACAC-3’;miR-195-5p引物序列,正向:5’-G-ATAGCAGCACAGAAATATTGGC-3’,反向:5’-TGCGGGTGCTCGCTTCGGCAAGT-3’;以U6作为内参的引物序列,正向:CTCGCTTCGGCAG-CACA,反向:AACGCTTCACGAATTT-GCGT。qRT-PCR的总反应体系为20 μL,主要组成为MgCl21.2 μL,PCR缓冲液2 μL,dNTPs (10 mmol/L) 0.4 μL,Taq酶0.3 μL,ddH2O 14.77 μL,探针和引物共0.33 μL,cDNA 1 μL。循环参数:95 ℃ 5 min,95 ℃ 15 s,60 ℃ 1 min,共40个循环。每个样品设置3个复孔,并以DEPC处理的ddH2O为阴性对照。检测结束后采用SDS2.0软件分析获得Ct值(图1)。并用前期合成iRNA的cDNA 1 μmmol/L,按10-2、10-3、10-4、10-5和10-6稀释后作为标准品,以浓度的对数为X轴,对应每个浓度的Ct值为Y轴,绘制成标准曲线,根据Ct值通过标准曲线计算出miR-141和 miR-195-5p的绝对浓度。

图1 miR-141 (A)和miR-195-5p (B)的溶解曲线Fig 1 Dissolution curves of miR-141 (A) and miR-195-5p (B)
慢性病毒转染构建对人乳腺癌细胞MX-1进行慢病毒包装,取对数生长期MX-1细胞与250 μL无血清DMEM高糖培养基和0.5 μg PMD2.G包装载体加入到3支1.5 mL无菌Eppendorf管中,分别加入1.5 μg miR-141、 miR-195-5p全长载体和相应的空白载体,另取无菌Eppendorf管加入无血清DMEM高糖培养基,并与20 μL转染脂质体混合,室温静置20 min,胰蛋白酶消化,将细胞稀释至1×106/L,取1 mL细胞悬液,接种于6孔板,加入DNA和脂质体,培养过夜后更换培养液,48和72 h后分别收集病毒悬液并过滤。病毒悬液和10%DMEM培养基按1∶1混合后培养MX-1细胞3天,筛选出细胞株,转染miR-141和 miR-195-5p全长载体的分别为miR-141组和 miR-195-5p组,转染空白载体的为对照组。
细胞增殖能力检测胰酶消化的MX-1细胞以2×106/L接种于96孔板,检测时间点为0、24、48和72 h,CKK-8试剂与10%DMEM高糖培养液1∶9混合培养细胞1 h,检测波长为450 nm,以各时点的吸光度(D)值与D0值(0 h时)的比值衡量细胞的相对增殖能力。
细胞迁移能力检测无血清DMEM高糖培养液按1∶8稀释Matrigel基质胶,共200 μL。取3只Transwell小室放置于24孔板中,迁移细胞密度调整为1×106/L,下室放置700 μL含10% FBS的高糖培养基,培养24 h后用10%甲醛固定细胞20 min,上室加入0.5%结晶紫溶液50 μL,拍照。用棉签擦去上室未穿出的细胞,200倍光镜下计数,取四周及中央5个视野,求平均值。
观察指标观察各组血清miR-141和miR-195-5p水平变化,乳腺癌患者术后血清miR-141和miR-195-5p水平变化,乳腺癌患者血清miR-141和miR-195-5p水平与临床指标、增殖和迁移的相关性,及其诊断乳腺癌的灵敏度和特异性。

结 果
各组血清miR-141和miR-195-5p水平比较血清miR-141水平:乳腺癌组显著高于良性病变组和健康对照组(P<0.01),良性病变组较健康对照组显著升高(P<0.01);血清miR-195-5p水平:乳腺癌组明显低于良性病变组和健康对照组(P<0.01),良性病变组较健康对照组明显降低(P<0.01)(表1,图2)。
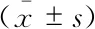
表1 各组血清miR-141和miR-195-5p水平比较Tab 1 Comparison of serum miR-141 and miR-195-5p levels in different groups
(1)vs.control group,P<0.01;(2)vs.benign lesions group,P<0.01.
良性病变组和乳腺癌组术后血清miR-141和miR-195-5p水平表达乳腺癌组术后血清miR-141水平为(1.37±0.57) fmol/L,明显低于术前的(8.22±2.19) fmol/L(t=33.978,P<0.01);乳腺癌组术后血清miR-195-5p水平为(5.77±1.62) fmol/L,明显高于术前的(2.20±0.84) fmol/L (t=21.960,P<0.01)。乳腺良性病组术后血清miR-141水平为(1.25±0.86) fmol/L,明显低于术前的(4.43±1.98) fmol/L(t=12.867,P<0.01);乳腺良性病组术后血清miR-195-5p水平为(6.26±1.86) fmol/L,明显高于术前的(4.93±1.88) fmol/L (t=4.355,P<0.01)。
乳腺癌患者血清miR-141和miR-195-5p水平与临床参数的关系乳腺癌组血清miR-141和miR-195-5p水平与年龄和肿瘤直径无明显相关性,而与淋巴结转移、雌激素受体(estrogen receptor,ER)、孕激素受体(progesteron receptor,PR)、人类表皮因子受体2 (human epidermal growth factor receptor 2,HER-2)、TNM分期、分子分型和组织分型具有明显的相关性(P<0.01,表2),通过多元线性回归发现,血清miR-141和miR-195-5p水平与淋巴结转移、PR、TNM分期和分子分型呈线性相关(P<0.05,表3)。

(1)vs.control group,P<0.01;(2)vs.benign lesions group,P<0.01.
图2 各组血清miR-141(A)和miR-195-5p(B)表达的比较
Fig 2 Comparison of serum miR-141 (A) and miR-195-5p (B) expressions in different groups
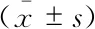
表2 乳腺癌临床病例参数与血清miR-141和miR-195-5p表达的关系Tab 2 Relationship between clinical indexes of breast cancer and expression of serum miR-141 and miR-195-5p
ER:Estrogen receptor;PR:Progesteron receptor;HER-2:Human epidermal growth factor receptor 2.

表3 血清miR-141和miR-195-5p表达水平与临床指标的多元线性回归分析Tab 3 Multiple linear regression analysis between serum miR-141 and miR-195-5p expression levels and clinical indicators
各组乳腺癌细胞在各时点相对增殖能力和迁移能力的比较乳腺癌细胞转染miR-141和miR-195-5p质粒后,与对照组比较,随着培养时间的延长,miR-141组增殖能力明显升高,而miR-195-5p组增殖能力明显降低(表4)。各组培养24 h后,通过Transwell迁移实验在200倍光镜下(图3)发现,对照组下室细胞数为(76.37±10.55)个,miR-141组下室细胞数为(138.34±15.67)个,miR-195-5p组下室细胞数为(65.46±9.42)个,miR-141组细胞迁移能力明显高于对照组(P<0.01),而miR-195-5p组迁移能力明显低于对照组(P<0.01)。
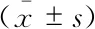
表4 各组在不同时点增殖能力的比较Tab 4 Comparison of proliferation ability in each group at different time points
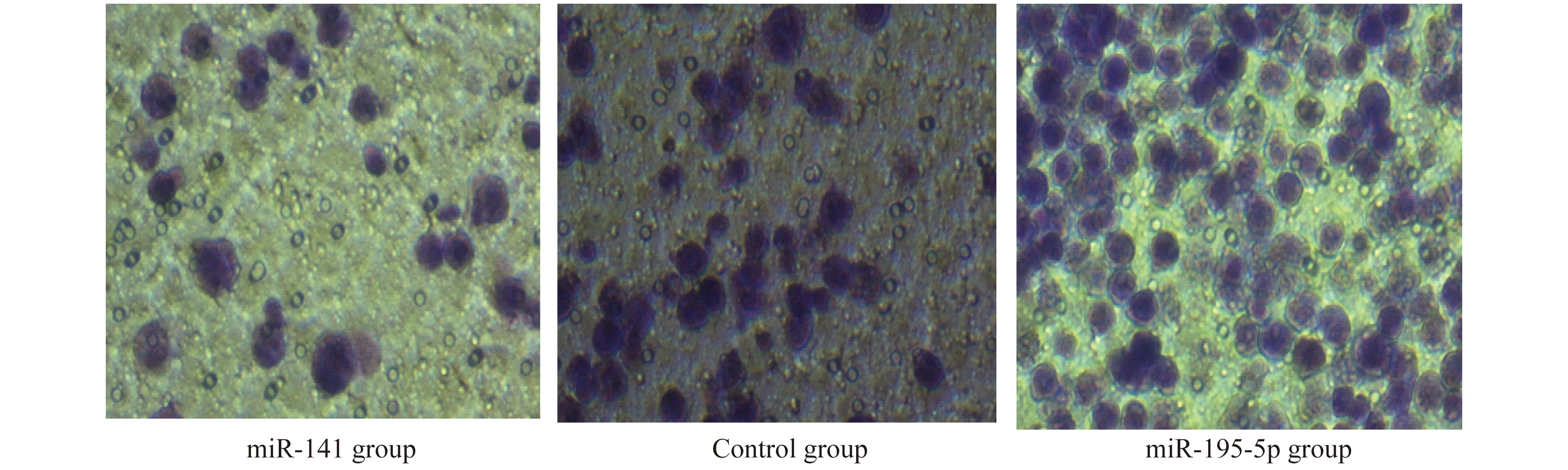
图3 细胞培养24 h后上室细胞的光镜观察(×200)Fig 3 Light microscopic observation of the upper chamber cells after 24 h of cell culture (×200)
乳腺良性病变与乳腺癌的ROC曲线分析以血清miR-141 (x1)和miR-195-5p (x2)水平根据乳腺良性疾病是否合并乳腺癌进行二元回归得出方程:y=1.093x1-1.886x2-0.245,代入方程后得出联合检测(miR-141+miR-195-5p)变量。以联合检测作为检验变量,以发生乳腺癌为状态变量绘制ROC曲线(图4)。联合检测诊断乳腺癌的灵敏度为88.1%,特异性为92.0%,AUC为0.964。联合检测的AUC明显优于miR-141(Z=3.413,P<0.01)和miR-195-5p(Z=3.426,P<0.01)单独检测,而血清miR-141和miR-195-5p的AUC比较差异无统计学意义(表5)。

表5 miR-141和miR-195-5p对乳腺癌的诊断效能比较Tab 5 Diagnostic efficacy of miR-141 and miR-195-5p in the diagnosis of breast cancer

图4 miR-141和miR-195-5p在诊断乳腺癌的ROC曲线分析Fig 4 ROC curve analysis of miR-141 and miR-195-5p in the diagnosis of breast cancer
miRNAs是一类小分子、非编码调控的RNAs,由20~24个核苷酸组成,在肿瘤的发生发展的过程中具有重要作用,可能是肿瘤早期诊断、治疗和评估预后的重要标记物[4-5]。miRNAs在肿瘤中稳定表达,并且在血液中具有较高的稳定性和特异性,有无创和重复检测等特点[6],因此血清miRNAs有望成为无创早期诊断肿瘤的新型肿瘤标记物。
本研究显示乳腺癌患者血清miR-141水平明显高于健康对照组和乳腺良性病变组,并且发现手术后乳腺癌患者血清miR-141水平明显降低。同时发现,乳腺癌患者血清miR-141表达水平与肿瘤直径和年龄无关系,而与淋巴结转移、ER、PR、HER-2、TNM分期、分子分型和组织分型具有明显相关性;通过多元回归分析发现,miR-141表达水平与淋巴结转移、PR、TNM分期和分子分型呈线性相关性,说明血清miR-141水平能够反映乳腺的恶性程度,与乳腺癌的预后有一定的相关性。miR-141在不同肿瘤中表达水平不同,且表达方式也有差异,与正常组织相比,胃癌组织中miR-141表达水平明显降低,并且与肿瘤分期呈负相关[7];在肝癌细胞中表达明显下降,可抑制肝癌细胞的侵袭和转移[8];而在结肠癌患者中血清miR-141呈高表达[9],并且认为血清中miR-141高表达说明结肠癌预后不良。在一项乳腺癌组织和乳腺正常标本中进行的miRNA表达谱分析发现,包括miR-141基因在内共有7个基因表达上调和2个基因表达下调,联合上述基因检测能够提高乳腺癌诊断的准确性[10]。本研究发现将miR-141质粒转染到乳腺癌后,促进肿瘤细胞的增殖和迁移,与文献报道的结果一致[11],说明miR-141对乳腺癌细胞生长和转移具有重要临床意义,推测miR-141可能是乳腺癌发生、发展和预后的重要指标。本研究还发现对于乳腺良性肿瘤鉴别乳腺癌,当血清miR-141>6.664 fmol/L时,灵敏度为80.2%,特异性为88.0%,AUC为0.904,对乳腺癌的诊断具有较高的特异性和灵敏度,可能成为效能较高的诊断指标。
本研究发现乳腺癌患者血清miR-195-5p表达水平明显低于乳腺良性病变组和健康对照组,且乳腺癌患者术后血清miR-195-5p水平较治疗前明显升高,说明miR-195-5p是乳腺癌的保护因子。用miR-195-5p质粒转染乳腺癌细胞后,发现miR-195-5p具有促进乳腺癌细胞增殖和迁移的作用,说明miR-195-5p是反映乳腺癌生物学特性的指标。这一研究结果与文献报道相一致:肿瘤细胞miR-195-5p呈低表达,上调miR-195-5p表达能够明显抑制细胞增殖[12-13]。本研究还发现乳腺癌患者血清miR-195-5p表达水平与年龄和肿瘤直径无相关性,而与淋巴转移、肿瘤分期及肿瘤分级呈负相关,与ER、PR和HER-2表达阳性呈正相关,通过多元回归分析发现miR-195-5p表达水平与淋巴结转移、PR、TNM分期和分子分型呈线性相关,说明miR-195-5p基因可能与抑癌基因类似。研究显示miR-195-5p在多种肿瘤中呈低表达:miR-195-5p能够抑制口腔鳞状细胞癌的侵袭和转移,抑制肿瘤的生长[14-15];miR-195-5p能够通过抑制血管内皮细胞因子的表达,降低肿瘤细胞的侵袭和迁移[16]。
本研究发现在诊断乳腺良性疾病和乳腺癌方面,患者血清miR-195-5p水平临界值为3.525 fmol/L,当小于该临界值诊断乳腺癌的灵敏度为96.8%,特异性为84.0%,AUC为0.912,说明miR-195-5p诊断乳腺癌具有较高的特异性和灵敏度。
本研究发现血清miR-141和miR-195-5p联合检测诊断乳腺癌的灵敏度为88.1%,特异性为92.0%,AUC为0.964,联合检测的AUC明显优于miR-141和miR-195-5p单独检测,而血清miR-141和miR-195-5p的AUC差异无统计学意义,说明血清miR-141水平与miR-195-5p水平之间存在某种平衡关系,miR-141相当于促癌基因,而miR-195-5p相当于抑癌基因。miR-141和miR-195-5p的来源仍不确定,目前认为主要来自凋亡或坏死细胞,细胞破坏后释放入血,是反映乳腺癌细胞增殖和迁移的指标,也是乳腺癌预后的指标,同时可能是诊断乳腺癌的早期标记物。
综上所述,miR-141和 miR-195-5p与乳腺癌细胞增殖和迁移具有密切联系,对诊断乳腺癌具有重要的临床意义。本研究未与经典的钼靶、超声和MRI等影像学方法在诊断乳腺癌的效能方面进行比较,需要在将来的研究中予以进一步阐明。
