膳食硫代葡萄糖苷衍生物抗癌活性及预防癌症的研究进展
2019-10-09任建敏
任 建 敏
(重庆工商大学 环境与资源学院,重庆 400067)
0 引 言
随着生活水平提高与人口老龄化,癌症已成为影响我国居民健康与生活质量的主要慢性病之一[1]。除了加强癌症早期诊断和治疗水平,让人们了解膳食与癌症等疾病的发生、发展及预防的联系,十分必要[2]。
越来越多的证据显示:人体健康得益于膳食中大量植物化学成分[3]。植物化学成分是逆境应力胁迫下植物合成的次生代谢物,它被人类纳入食物,诱导人体防御反应,产生酶与受体等,经代代演化遗传下来。膳食植物化学成分与人体酶和受体通过分子间化学作用,多途径激发人体保护机制,提高人类生存能力[4-5]。
硫代葡萄糖苷(Glucosinolates,GLs),是一类含硫的植物化学成分,广泛存在于十字花科芸苔属植物,如西洋菜、抱子甘蓝、花椰菜、西兰花、卷心菜、佳彩、羽衣甘蓝、辣根、白萝卜和红萝卜等蔬菜中[6],人类食用已有千年历史。硫代葡萄糖苷无毒副作用,人体摄入后,在胃肠道水解产生 4-甲基亚磺丁基异硫氰酸酯(萝卜硫素又称莱菔硫烷,SFN)、苯乙基异硫氰酸酯(PEITC)、吲哚化合物(如吲哚甲醇)等衍生物,除-N=C=S、-NH-、-SH 等活性基团与DNA、RNA、蛋白质、酶、活性因子等发生直接或间接作用外,其苯和吲哚芳香基团与人体芳烃受体(AhR)结合,较其他植物化学成分有更突出的生理活性,如调控细胞信号通路与表观遗传变异,诱导细胞保护酶、抑制炎症反应等[7-9],以预防癌症、肺部与心脑血管疾病,延缓衰老等[10]。膳食硫代葡萄糖苷衍生物的生理活性及对癌症等慢性病的化学预防作用,已形成新的研究领域[11-12]。
1 硫代葡萄糖苷及衍生物
硫代葡萄糖苷由β-D-葡萄糖基,硫化肟基和可变侧链R基组成(图2),根据R基的不同可分为:脂肪族GLs (图1a,b,c)、吲哚族GLs (图1d)和芳香族GLs三大类[12]((图1e)。

a 黑介子苷
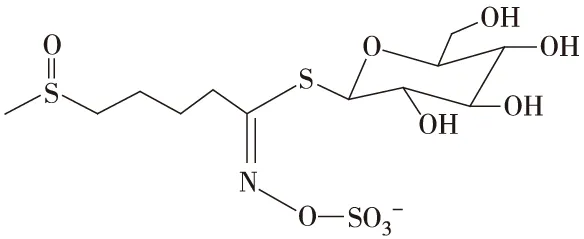
b 萝卜硫苷

c 脱羟萝卜硫苷
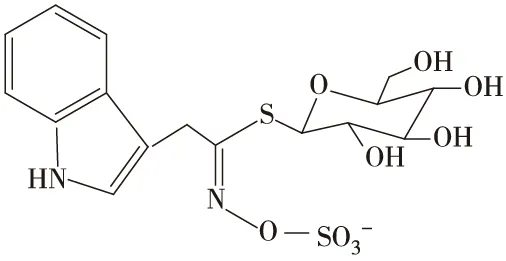
d 芸苔葡糖硫苷

e 豆瓣菜苷
膳食硫代葡萄糖苷以磺酸酯基阴离子存在(图1),溶于水,不具挥发性,热稳定性较好。经切割、咀嚼,隔离在植物韧皮薄壁组织细胞液泡中的芥子酶释放,或经肠道微生物作用,硫代葡萄糖苷水解,苷键断裂,获得D-葡萄糖和不稳定糖苷配基(磺酸酯基硫氧肟酸盐)。在不同 pH、温度、Fe2+和硫氰形成蛋白酶(TFP)与特异硫蛋白酶(ESP)条件下,经Lossen重排,硫代葡萄糖苷配基生成不同衍生物。pH>6.5,水解形成异硫氰酸酯(ITC),低pH和Fe2+作用生成氰酸酯、腈类、环硫腈等[13-14],如图2所示。

图2 硫代葡萄糖苷及酶解衍生物的结构
膳食中硫代葡萄糖苷直接食用,虽也能预防和治疗癌症、肺部与心血管等多种疾病,但正常生理条件下,水解衍生物SFN、PEITC等生理活性更高,经胃肠道吸收被动扩散进入毛细血管,与游离血浆蛋白硫醇可逆结合,跨越质膜进入组织细胞[15],发挥重要生理功能,抑制与预防癌症等疾病。
2 硫代葡萄糖苷衍生物抗癌活性
2.1 抑制氧化应激与慢性炎症
人体从膳食中摄取营养物质,因呼吸代谢持续产生活性氧簇(ROS)与活性氮簇(RNS)。低浓度ROS/RNS是重要的信号分子,但高浓度ROS/RNS产生氧化应激,导致慢性炎症。慢性炎症被证实是人类疾病包括癌症、心血管、肺部疾病、高血压、神经退行性和自身免疫疾病等引起的主要原因[16]。如果炎症和氧化应激串扰持续时间长,将产生过多的细胞 ROS/RNS,对大量生物大分子如脂质、蛋白质和DNA产生氧化损伤或发生化学反应,如ROS氧化DNA,将鸟嘌呤转化成8-羟基-2-脱氧鸟苷(8- OHDG),降低甲基-CpG结合蛋白和甲基转移酶(DNMTs)间结合力,导致致癌基因和肿瘤抑制基因失调等[17-19]。
研究证实,膳食硫代葡萄糖苷水解衍生物SFN、PEITC等,能诱导II相解毒酶与抗氧化酶,抑制氧化应激与慢性炎症[20-21]。
人体在正常生理状态下,大部分转录因子NF-E2相关因子2(Nrf2)以抑制状态与Kelch样环氧氯丙烷相关蛋白1 (Keap 1)偶联存在于细胞质中。SFN等进入细胞质后,与Keap1作用,有利于Nrf2与Keap1解偶联,使Nrf2转运到细胞核内与ARE结合,激活Keap1-Nrf2-ARE信号通路[22],上调抗氧化酶和II相解毒酶,如血红素氧化酶HO-1、NQO1、SOD、GSTs、UGT1A1、γ-半胱氨酸连接酶(γ-GCL)表达[23-24]。含芳环的PEITC、吲哚甲醇等结合芳烃受体(AhR),或通过提高靶基因中AhR与异生物反应元件(XREs)键合力,诱导I相酶代谢物和II相解毒酶[25]。SFN、PEITC也可诱导胞外信号调控激酶(ERK)和c-Jun氨基端激酶(JNK)磷酸化,随后Nrf2磷酸化并转位至细胞核,激活丝裂原活化蛋白激酶(MAPK)信号通路,上调II相解毒酶等转录[26-27]。
SFN等能与NF-κB信号通路若干靶蛋白结合,参与抑制炎症过程。SFN等与谷胱甘肽或其他氧化还原调控因子,如硫氧还蛋白或Ref-1等反应,影响MAPK和JNK下游效应器MyD88、p38,间接削弱NF-κB DNA间作用力,或直接与p50巯基结合,阻止Akt参与的NF-κB DNA作用,抑制TLR4信号级联[28-29]。PEITC和SFN也可通过阻止IKK/IkB磷酸化和p65 NF-κB核转位,抑制NF-κB转录活性,降低IL-6、iNOS、TNF-α和COX-2等,削弱炎症介质,抑制Toll样受体刺激而引起的干扰素调节因子3(IRF3)磷酸化,阻碍I型干扰素(IFNs)和干扰素诱导基因激活[30-31]。
SFN等还能靶向NF-κB通路其他激活蛋白,如CCAAT -增强子结合蛋白、cAMP反应元件结合蛋白和激活蛋白-1(AP-1),通过表观遗传机制,调控诱导促炎症性miRNA-155显著下调[32]。
SFN、PEITC等诱导II相解毒酶/抗氧化酶与抑制慢性炎症,在预防癌症等疾病中发挥重要作用[33-34]。
2.2 调控表观遗传变异
表观遗传变异是DNA序列不发生改变的情况下,导致DNA表达或显型改变[35]。最新大量证据表明,表观遗传如DNA甲基化、染色体重塑、组蛋白修饰和非编码miRNAs,持续异常导致癌症等疾病发生、发展[7,10]。而膳食植物化学成分包括SFN、PEITC等,有逆转许多表观遗传异常的潜能[7,10,36]。
2.2.1 对DNA甲基化影响
DNA甲基化是S-腺苷甲硫氨酸(SAM)的甲基,经DNA甲基转移酶(DNMTs)催化,转移到DNA链CpG二核苷胞嘧啶残基5′位置。DNA甲基化异常是癌细胞中首先被发现的表观遗传变异[37-38]。富含CpG启动子的高甲基化触发局部组蛋白修饰,引发细胞伪装机制,使基因启动子远离转录因子,导致肿瘤抑制因子和其他重要功能基因转录沉默。DNA低甲基化,导致基因组不稳和致癌基因与转位因子不适当激活[36, 39-40]。
用SFN,PEITC等处理人和小鼠癌细胞,伴随启动子脱甲基化和基因如谷胱甘肽-S转移酶 p1(GSTP1)、Nrf2、端粒酶逆转录酶(hTERT)、转化生长因子、β受体Ⅰ(TGFBR1)和半胱氨酸丰富血管生成诱导因子61(CYR61)重新表达,引起DNMTs活性降低[41-42]。
WONG C P等应用SFN等处理正常前列腺上皮细胞和前列腺癌细胞,得出:二组细胞DNMTs表达均减少,特别是不同基因序列启动子甲基化显著降低。在同一细胞系中,二衍生物共享相似靶基因,可逆转许多癌相关基因的甲基化异常[43]。
SFN,PEITC等还可经氧化还原,抑制谷胱甘肽(GSH)消耗,阻止甲基供体SAM耗竭所导致全身DNA低甲基化[44-45]。
2.2.2 调控组蛋白修饰
组蛋白丰富的转录后修饰也是重要的表观遗传变异,决定染色体状态与功能,在细胞死亡、生长以及癌症等疾病中发挥重要作用[46]。组蛋白氨基末端经转录后修饰,被认为是基因沉默触发的重要因素[36]。开放染色质状态和基因激活是在组蛋白乙酰转移酶(HATs)作用下,将乙酰基转移到组蛋白末端赖氨酸残基上;而浓缩的染色质状态和相应的基因沉默,通常是由组蛋白脱乙酰酶(HDAC)催化将乙酰基转移到辅酶A(CoA)调控[36,47]。
类似地,由组蛋白甲基转移酶(HMTs)和脱甲基转移酶(HDMs)介导赖氨酸和精氨酸残基的甲基化作用,被认为是激活或抑制不同癌症基因表达的机制[48]。如H3K4、H3K36和H3K79的甲基化可激活染色质转录,而H3K9、H3K27和H4K20的甲基化则抑制染色质转录[36,49]。
研究显示,膳食硫代葡萄糖衍生物SFN,PEITC等,通过抑制HDAC活性,降低组蛋白脱乙酰化,改变肿瘤生成过程,同时提高抑制肿瘤、促凋亡、抗氧化和抗炎基因的表达[50-51]。
Zhang C等发现吃花椰菜芽病人,其外周血单核细胞、不同癌细胞系(肾、结肠癌、前列腺癌、白血病和乳腺癌等)的HDAC活性抑制,均与SFN、PEITC等有关[52-53]。特别是在人乳腺癌和前列腺癌细胞系中,经SFN和PEITC处理,H3Ac,H3K9Ac,H4Ac乙酰化和H3K4甲基化增加,而H3K9和H3K27的甲基化减少[42,54]。SCC-13皮肤癌细胞经SFN作用,导致多梳蛋白表达与H3K27甲基化以SFN浓度呈依赖性降低,这与细胞G2/M期累积,降低细胞周期蛋白B1、A、依赖性激酶1和2(CDK1和CDK2)和增加抑癌基因p21Cip1表达一致[55]。
2.2.3 调控miRNAs表达
miRNAs是从约70~100个发夹寡核苷酸前体细胞中裂解,形成一种内源性小非编码RNA分子,通过抑制转录和/或触发目标mRNAs降解,调节基因表达[56-57],也是表观遗传重要组成部分。
对不同癌症研究表明:miRNAs与细胞信号通路相互作用,正常细胞与肿瘤组织或不同肿瘤间,显示特异基因表达[40, 58]。miRNAs在肿瘤组织表达增高或降低,有类似癌基因或抑癌基因两面作用。
miR-17-92致癌基因簇过度表达,能抑制肿瘤抑制基因(如E2F1)和/或控制分化与细胞凋亡基因(如BIM、PTEN),促进癌症发展[59]。相反,靶向癌基因RAS与BCL2的抑癌基因let-7和miR-15/miR-16表达升高,抑制癌症[60]。SFN、PEITC等,可以作为许多miRNA调控因子。
小鼠长期暴露于环境香烟烟雾,其肺中许多miRNA表达异常,可由PEITC和吲哚甲醇抑制[60]。吲哚甲醇能通过调控几个致癌miRNAs表达,降低乙烯基氨基甲酸酯对肺组织的致癌作用[61]。
在胰管腺癌(PDA)发展过程中,SFN可以调节诱导miR-let-7a,抑制K-RAS和癌症干细胞特性[62]。此外,在基底干细胞样导管原位癌(DCIS)细胞中,SFN可以调节miR-140、miR-29a、miR-21等表达,诱导更接近癌非干细胞的外泌体miRNAs显著改变,对非侵入性乳腺癌的早期阶段,是一种很有前景的化学预防剂[63]。
过去认为表观遗传终身固定不变,但最新研究表明,表观遗传是动态、随机、快速适应逆境与食物等应力变化并可逆转[64-65]。
3 膳食硫代葡萄糖苷衍生物在预防癌症中的应用
癌症的形成是一个长期、多步骤过程,从致癌起始发展到晚期和转移性癌症,可能需要10~30年[66-67]。
癌症的诱因分物理因素(如辐射、日照等)、化学因素(如食物、药物、活性代谢物ROS、激素、环境癌症诱变剂等)和病毒因素(如肝炎病毒),引发细胞DNA 、RNA、蛋白质、酶等分子结构与功能损伤。当损伤累积一定程度,基因修复受阻,影响氧化应激、炎症和细胞增殖在内的各种细胞信号转导[68]。伴随表观遗传基因变化,调控癌细胞分化、生长、凋亡等相关基因改变,导致癌细胞分裂失控转移[69]。
膳食硫代葡萄糖苷衍生物SFN、PEITC等,能在细胞内多途径靶向酶与受体产生防御,减弱、逆转或阻止癌症形成[70]。
据报道,人体摄入100 g (含湿量)花椰菜和豆瓣菜后,吸收SFN或PEITC的量可达50~200 μM[71]。大鼠口服50 μM SFN 4 h时后,血浆SFN峰值浓度达20 μM,半衰期约2.2 h,同时诱导细胞防御和细胞周期调节基因表达[72]。ApcMin小鼠食用5~10 μM/day SFN 3周后,血浆和肠道稳态浓度达124~254 nM和3~13 nM/g组织,并能有效预防小鼠腺瘤形成[73。大鼠口服10~100 μM /kg PEITC,体内血浆浓度达到9.2~42.1 μM[74]。对ApcMin/+小鼠小肠息肉模型,服用SFN膳食补充剂3周,肠息肉数量和大小明显减少,有较高凋亡和低增殖指数[75]。被辐照小鼠,用含SFN 1 μM的花椰菜提取物,局部应用11周,皮肤肿瘤发生率和多样性减少50%[76]。体内外实验证明,μM剂量的PEITC和SFN,对预防癌症是有效的[77]。
雌激素被认为是形成乳腺癌的一个危险化学诱因,在I相代谢酶CYP1B1作用下,产生4-羟雌二醇,生成自由基与DNA等结合,形成致癌物前体[78]。SFN、PEITC等可抑制I相代谢酶及代谢物活性,同时诱导II相解毒酶与抗氧化酶如NQO1、GSTs 、SOD、UGT等,促进代谢物灭活、解毒和排泄,抑制癌症形成[79]。
XIAO D等发现,pc-3细胞暴露在10 μM PEITC 24 h后,抗凋亡蛋白Bcl-2和Bcl-XL各下降56%和44%,同时产生凋亡蛋白酶前体[80]。经2.5 μM PEITC 处理HeLa细胞,引起G2/M积累,抑制41~79%细胞生长[81]。在HT-29细胞中,PEITC通过下调细胞周期蛋白A、D和E,诱导细胞周期G1停滞[82]。
WANG L G等[83]用PEITC处理LNCap细胞,发现p21和p27与依赖性激酶CDKs抑制剂表达提高,与PEITC诱导组蛋白超乙酰化,激活p21基因等转录有关。
SFN可上调死亡受体,促进细胞凋亡敏感[84]。SFN也可通过HDAC抑制剂活性,激活caspase 3、8和9,下调抗凋亡因子Bcl-2,导致pc-3细胞凋亡[85]。
PEITC、SFN还可与微管蛋白结合,抑制癌细胞分裂和增殖,从而发挥抗肿瘤作用[86]。
血管生成在肿瘤恶性转化和发展中扮演着重要的角色。SFN、PEITC等也能通过抑制低氧诱导因子-1(hif-1)和c-Myc血管生成转录因子,引起主要血管生成因子、血管内皮生长因子(VEGF)和基质金属蛋白MMPs抑制,降低血管生成和转移性潜能[87]。在HCT116人类结肠癌细胞、C6神经胶质瘤细胞、口腔癌细胞系YD10B及c57bl/6小鼠等研究中,SFN能降低VEGF与MMPs表达,抑制癌细胞转移,明显提高动物成活率[88-90]。
膳食十字花科蔬菜及硫代葡萄糖苷衍生物SFN、PEITC等对癌症的预防作用,也被许多流行病学与临床研究证实。
ZHANG Z等发现,十字花科蔬菜摄入与女性DCIS Ki-67蛋白表达呈负相关[91]。一项涉及78名前列腺癌患者的双盲、随机、安慰控制对照试验中,根治性前列腺切除术后,口服60 mg /day SFN,持续6个月,停药2个月后发现治疗组PSA明显下降,其PSA倍增时间更长[92]。
食用3~5份/week 十字花科蔬菜人群,癌症风险降低30%~40%,与食用量呈负相关[93]。对88 410名注册女护士跟踪14年,食用十字花科蔬菜多于5份/week的妇女,显示患非霍奇金淋巴瘤的风险较低[94]。在包含确诊前列腺癌1619例的对照研究中,摄入十字花科蔬菜的人群,尤其是晚期患者所占比例较低[95]。食用至少1份/week 十字花科蔬菜,其口腔、咽、食道癌、结直肠癌、乳腺癌和肾癌的风险,明显低于没有或偶尔食用的人群[96]。
另一项对照研究显示,低肾癌(RCC)风险也与食用较多十字花科和深绿色蔬菜一致。重要的是,该项研究证明,患RCC与食用十字花科蔬菜,比其他营养成分如α胡萝卜素、β胡萝卜素、β-隐黄素和叶黄素等,有更强的负相关,表明十字花科蔬菜硫代葡萄糖苷衍生物SFN、PEITC等,有更明显降低癌症风险的潜能[97]。
有趣的是,SFN、PEITC等对不同人癌细胞,有选择性细胞毒性作用,对正常细胞没有细胞毒性作用[93]。同时,SFN等因分子量较低,易穿过血脑屏障,有抗抑郁和抗焦虑效果[93],可克服癌症患者因辅助化疗诱发的焦虑、抑郁和/或情绪障碍。
4 结 论
人类癌症过程十分复杂,癌变过程有细胞表型变化,也有表观遗传基因等变化。癌症的发生、发展及预防,与膳食密切相关。大量研究证明,广泛存在于十字花科蔬菜中的硫代葡萄糖苷衍生物SFN、PEITC等,能逆转、抑制多种癌症形成,PEITC已进入临床试验阶段。重视膳食补充SFN、PEITC等,预防癌症等疾病,价廉、安全、有效,具有深远的现实意义。
