药物致癌试验中常用动物历史对照数据研究进展
2019-10-09于春荣尹纪业笪红远高广花王庆利
于春荣*,尹纪业*,笪红远,高广花,马 璟,王庆利
(1.国家食品药品监督管理总局药品审评中心,北京100022;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京100850;3.国家上海新药安全评价研究中心,上海201203)
随着国内创新药物研发的推进,需要进行致癌性评价的新药大量出现,致癌评价成为药物审评关注的焦点。致癌试验一般采用1项2年期大鼠试验和1项2年期小鼠试验组合,或1项2年期大鼠试验和1项6个月期的转基因小鼠试验组合。致癌试验由于周期长且结果数据繁多,除了要考虑受试物的分类、作用机制、剂量-效应关系、肿瘤的发生部位和合适的统计学分析等信息外,其试验结果的分析还需要有充足的自发性肿瘤背景数据可供参考,以帮助判断肿瘤发生率的增加是否与给药相关,用于进一步判断与人类的相关性。致癌试验中,同期对照组数据(有时是双空白对照组)能提供最具有相关性的对照,以确定哪些肿瘤是药物作用引起的。然而,在遇到罕见肿瘤和发病率异常的肿瘤时只能寻求可靠的历史对照数据加以解释判断。
迄今为止,多个不同啮齿类动物品系被用于致癌性试验。致癌试验的标准操作方案最早由经济合作与发展组织(Organization for Economic Cooperation and Development,OECD)(1981 年)和美国食品药品监督管理局(Food and Drug Administration,FDA)(Redbook,1982年)颁布,形成了开展啮齿类动物2 年致癌性试验的标准试验研究方案,但对啮齿类动物品系的选择未做明确要求。20 世纪70 年代后期开始,美国国家癌症研究所/美国国家毒理学计划(National Cancer Institute/National Toxicology Program,NCI/NTP)大多选用F344大鼠和B6C3F1小鼠开展致癌试验,而制药企业则在致癌试验中较多使用Wistar 大鼠、SD 大鼠和CD-1 小鼠。转基因小鼠在20 世纪90 年代后期逐渐被使用。据统计,到2011年,美国FDA药品评价与研究中心(FDA Center for Drug Evaluation and Research,CDER)40%的研究方案来自rasH2转基因小鼠[1]。
当前可参照的历史对照数据主要来自机构(工业毒理学动物数据登记处(Registry of Industrial Toxicology Animal Data,RITA),NTP 和Charles River(表1)和已发表论文(表2)。因各机构的数据库在不断维护更新中,本文未涉及。本综述主要对已发表论文的数据予以梳理,发现数据主要有不同种属自发性肿瘤性病变、特定系统或器官的自发性肿瘤病变(垂体、神经、肾上腺、眼球和卵巢等组织)及历史对照数据的评估和使用规范等类型。总体上呈现的时间趋势是,早期论文主要关注历史对照数据的建立和完善,近几年逐渐过渡到特定系统和器官的数据对比。

表1 有关致癌试验中动物自发性肿瘤历史对照数据的数据库
本综述按动物品系,对上述论文中致癌性试验的正常对照组动物出现的自发性肿瘤进行了归纳,并对比自发性肿瘤的发生特点(种类、发生率和发生率范围),进一步认识历史对照数据的发展现状,从而增加从业人员对实验动物自发性肿瘤的了解,为致癌性试验的顺利开展提供数据支持。
表2 已经发表的有关致癌试验中动物自发性肿瘤历史对照数据的论文
1 SD大鼠历史对照数据
Baldrick[5]汇总了SD大鼠的13个致癌试验(雌雄各765只)(表3)。试验中全部雌雄SD大鼠平均生存率分别为38%~57%和22%~48%。恶性肿瘤发生率达12%~15%。最常见的肿瘤为内分泌系统肿瘤,其中垂体腺瘤最高,在雌雄SD大鼠发生率分别为70.3%和49.3%。纤维腺瘤是SD 大鼠乳腺肿瘤中最多见的类型(发生率为55.6%),腺癌发生率高于腺瘤。其他常见肿瘤见于皮肤系统,包括乳腺纤维腺瘤、乳腺腺癌、乳腺腺瘤、皮肤纤维瘤、皮肤角化棘皮瘤和雄性动物毛囊肿瘤。常见的生殖系统肿瘤是睾丸间质细胞瘤和子宫内膜间质息肉。雄大鼠淋巴细胞白血病是血液系统最常见肿瘤。
Chandra 等[3](1992 年)总结了17 个致癌试验统计数据(2669 只正常对照组SD 大鼠)。结果显示,雌雄大鼠总的肿瘤发生率分别为22.4%和14.9%,生存率分别为41%~53%和42%~65%,恶性肿瘤发生率17%~19%。最常见的肿瘤类型也是内分泌肿瘤。雌大鼠常见肿瘤依次为乳腺肿瘤(31.3%)、甲状腺C 细胞瘤(2.9%)、子宫内膜间质息肉(2.6%)、肾上腺皮质腺瘤(1.9%)、恶性淋巴瘤(1.6%)、皮肤纤维瘤(1.3%)和胰岛细胞腺瘤(1.1%)。雄大鼠常见肿瘤依次为良性嗜铬细胞瘤(4.0%)、皮肤角化棘皮瘤(4.0%)、胰岛细胞腺瘤(3.7%)、甲状腺C细胞瘤(3.6%)、皮肤纤维瘤和鳞状细胞乳头状瘤(2.0%)、肝细胞腺瘤(2.0%)、恶性淋巴瘤(1.9%)、组织细胞肉瘤(1.4%)和肾上腺皮质腺瘤(1.2%)。
Harleman 等[36](2012 年)比较了RITA 数据库中正常对照组2158只SD大鼠和5419只Wistar大鼠乳腺肿瘤的发生情况,发现Wistar大鼠乳腺肿瘤发生率远低于SD大鼠(24%vs 58%),并且Wistar大鼠乳腺肿瘤和子宫肿瘤的发生率呈反比关系,这可能与催乳素的释放有关。
Weber等[37](2017年)对比了SD大鼠和Wistar大鼠的自发性肿瘤的发生情况,发现Wistar大鼠的总体肿瘤发生率也低于SD 大鼠,主要是与雌Wistar 大鼠垂体腺瘤和乳腺肿瘤的发生率低于雌SD 大鼠(垂体腺瘤:64%vs 70%;乳腺肿瘤:22.3%vs 72%)有关。
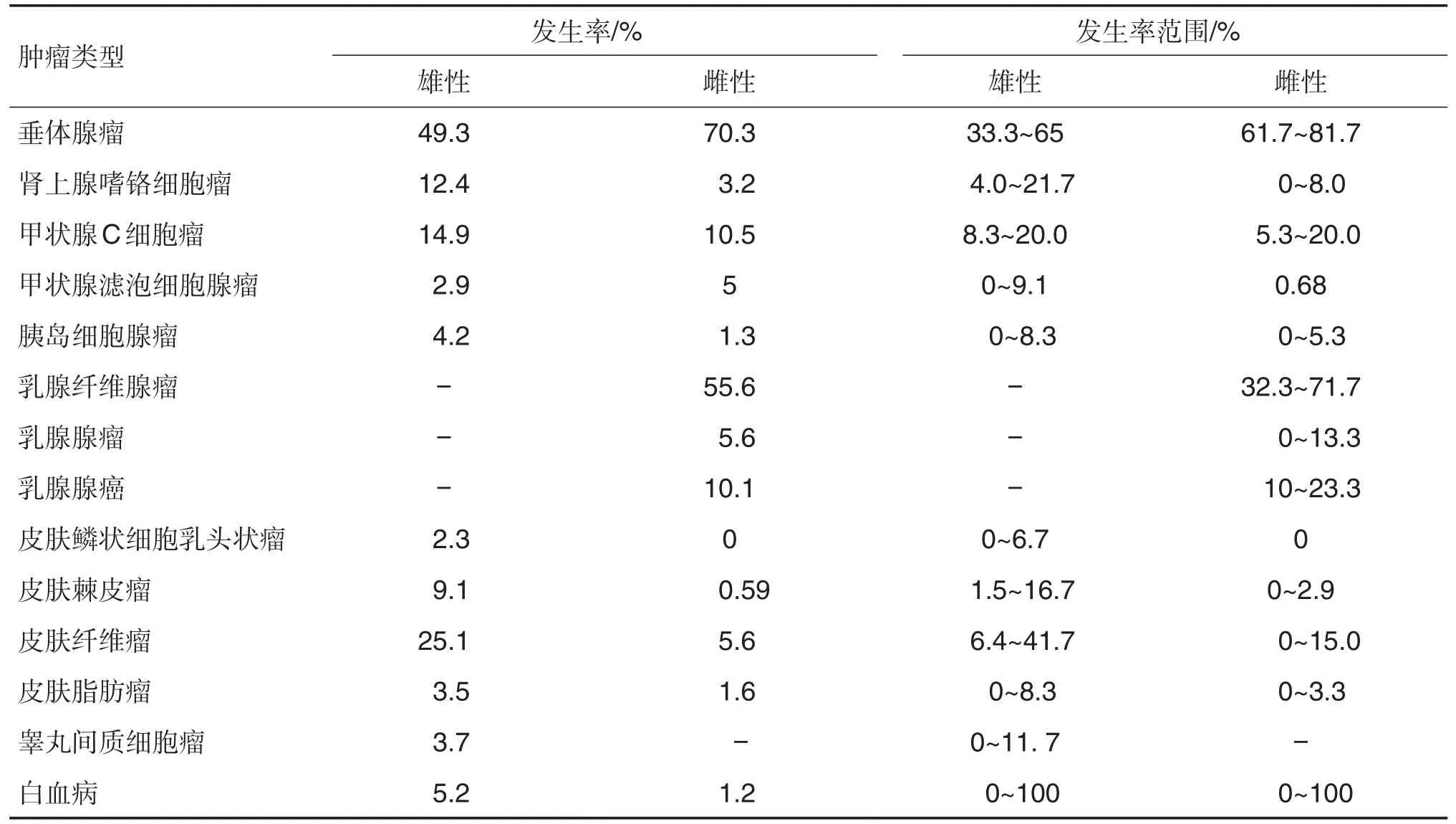
表3 SD大鼠常见自发性肿瘤发生率
2 Wistar大鼠历史对照数据
Poteracki 等[7]汇总了Wistar 大鼠的5 个致癌试验(正常对照组雌雄各465 只),雌雄大鼠肿瘤发生率分别为78%〔361/1599,肿瘤总数为1599 个(注:一个动物可发生多个肿瘤)〕和89%(415/1599),其中良性肿瘤占81%(1293/1599),恶性肿瘤占19%(306/1599)。发生率最高的肿瘤为垂体腺瘤和雌性乳腺纤维腺瘤(表4)。
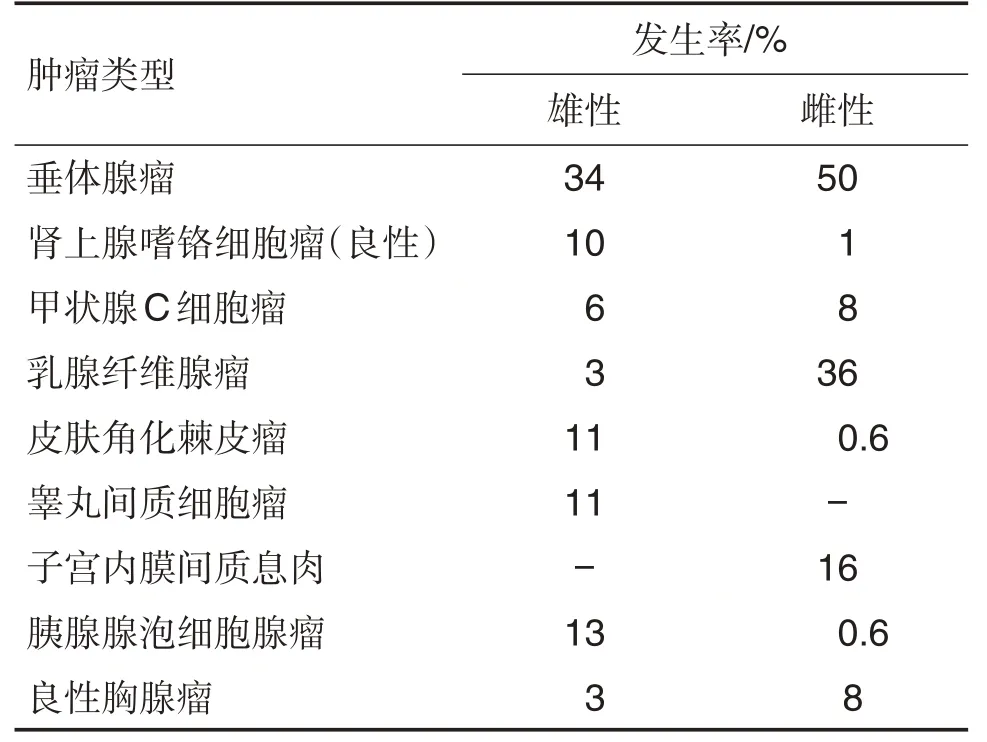
表4 Wistar大鼠常见自发性肿瘤发生率
Carlus等[8]报道了Wistar Hannover大鼠(雌雄各470 只)自发性肿瘤的发生情况(表5),与Wistar大鼠肿瘤类型和发生率差别不大,肿瘤主要见于内分泌系统、表皮和生殖系统等。
3 F344大鼠历史对照数据
Haseman 等[11](1998 年)汇总了NTP 1990-1997 年结束的致癌试验(雌雄动物数范围分别为1282~1351 只和1333~1354 只)。数据显示,总的肿瘤发生率高达96%,其中恶性肿瘤发生率,雌雄分别为43%和64%(表6)。高发肿瘤中,雄性动物睾丸间质细胞瘤发生率达89.1%,单核细胞白血病也是F344 大鼠常见的恶性肿瘤(雌雄动物分别为28.1%和50.5%)。此外,内分泌系统肿瘤在该品系大鼠中也普遍高发,其中雌雄动物垂体腺瘤的发生率分别为54.2%和30.4%。可见,F344大鼠是多种肿瘤的易发种属,发生率总体上高于SD 大鼠和Wistar 大鼠,且雌雄动物肿瘤发生率差异大。2 年期雄性大鼠致癌试验平均生存率约为50%,雄性大鼠主要的死亡原因与白血病、垂体腺瘤和严重的肾病等有关。
Tennekes等[43]对比了20年间自发性肿瘤发生率随时间的变化情况,SD 大鼠的子宫内膜间质息肉(仅雌性)和肠系膜淋巴结血管瘤的发生率呈升高的趋势,总体上,这种肿瘤发生率的变化在Wistar大鼠和SD大鼠多于F344大鼠,并指出此种时间相关的变化可能主要与基因漂移有关。Kuroiwa等[44]对比了同一个实验室内肿瘤发生率随时间变化的趋势,发现甲状腺C 细胞瘤、雄性动物胰腺胰岛细胞腺瘤和子宫腺癌的发生率有升高的趋势,且与时间相关的变化可能主要与动物本身的因素而非环境因素有关。Gopinath[45]发现某些肿瘤发生率随时间也存在一定波动,但无显著差异,其中乳腺纤维腺瘤发生率存在随时间逐渐增加的趋势,同时垂体腺瘤(雌雄)发生率存在随时间逐渐下降的趋势。
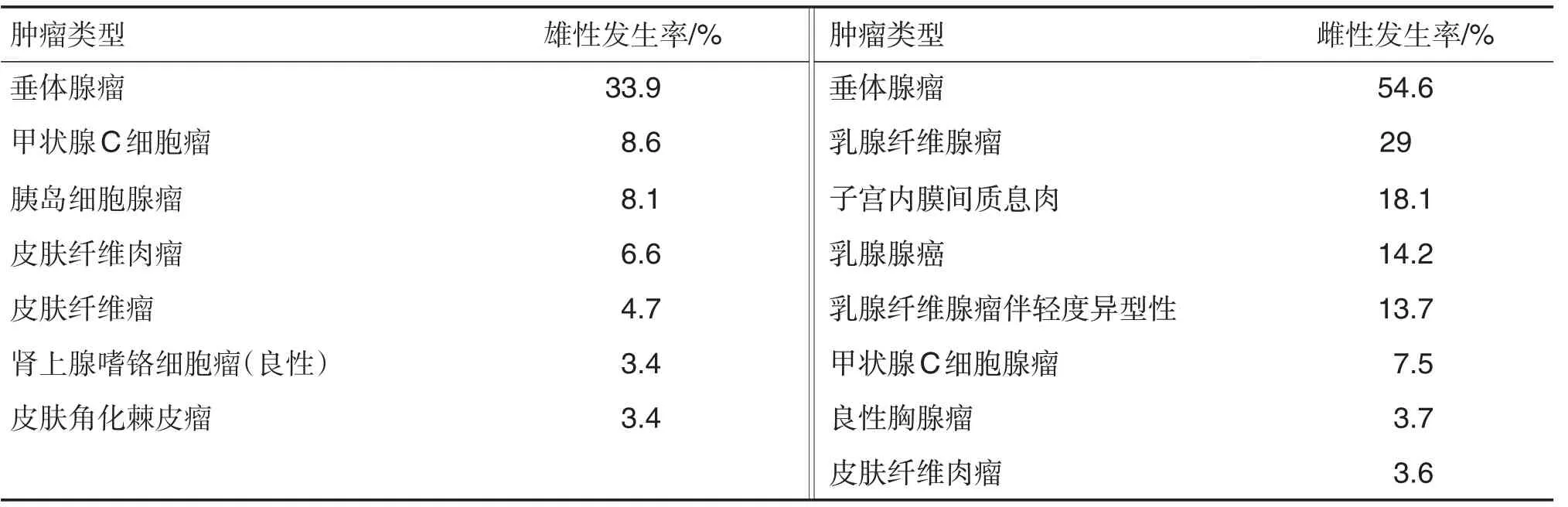
表5 Wistar Hannover大鼠常见自发性肿瘤发生率
4 B6C3F1小鼠历史对照数据
Haseman等[11]汇总了NTP开展的小鼠的21个致癌试验(正常对照组雌雄动物数范围分别为1092~1353 只和1341~1355 只)。数据显示,肝肿瘤的发生率最高,肺肿瘤、恶性淋巴肿瘤、脾血管瘤和血管肉瘤发生率也较高,垂体等内分泌系统肿瘤发生率相对偏低(表7)。
5 CD-1小鼠历史对照数据
Chandra等[14-15]汇总了正常对照组小鼠雌雄各725只。肺泡/支气管腺瘤、淋巴网状细胞瘤和肝细胞腺瘤是CD-1 小鼠的常见肿瘤,且发生率存在雌雄差异。其中雄性小鼠发生率最高的肿瘤为肺泡/支气管腺瘤(19.3%),而雌性小鼠发生率最高的肿瘤为淋巴网状细胞瘤(16.4%)。
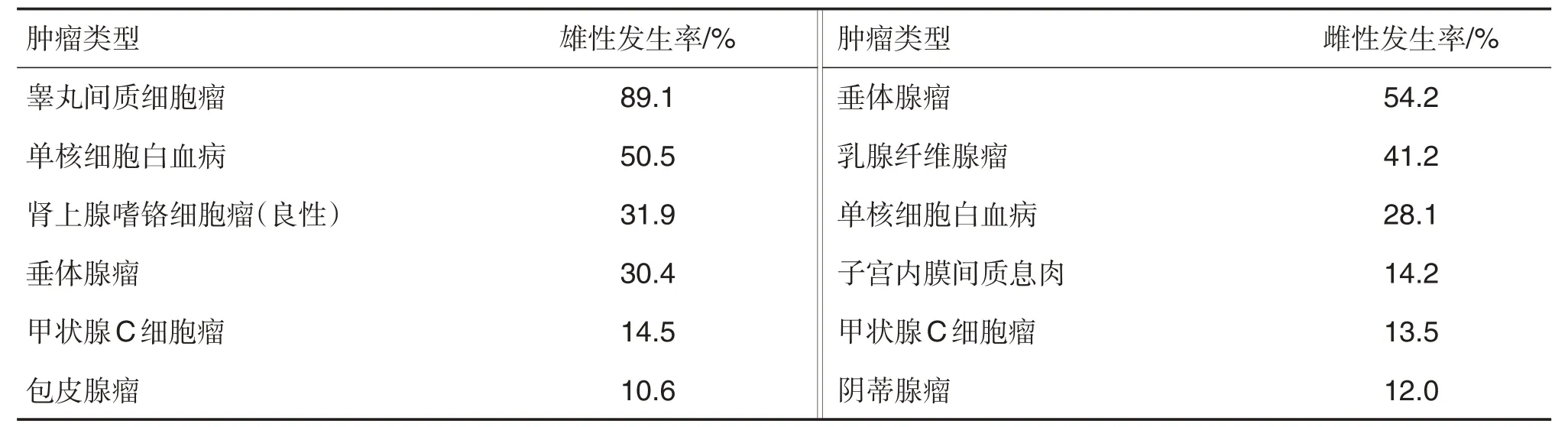
表6 F344大鼠常见自发性肿瘤发生率
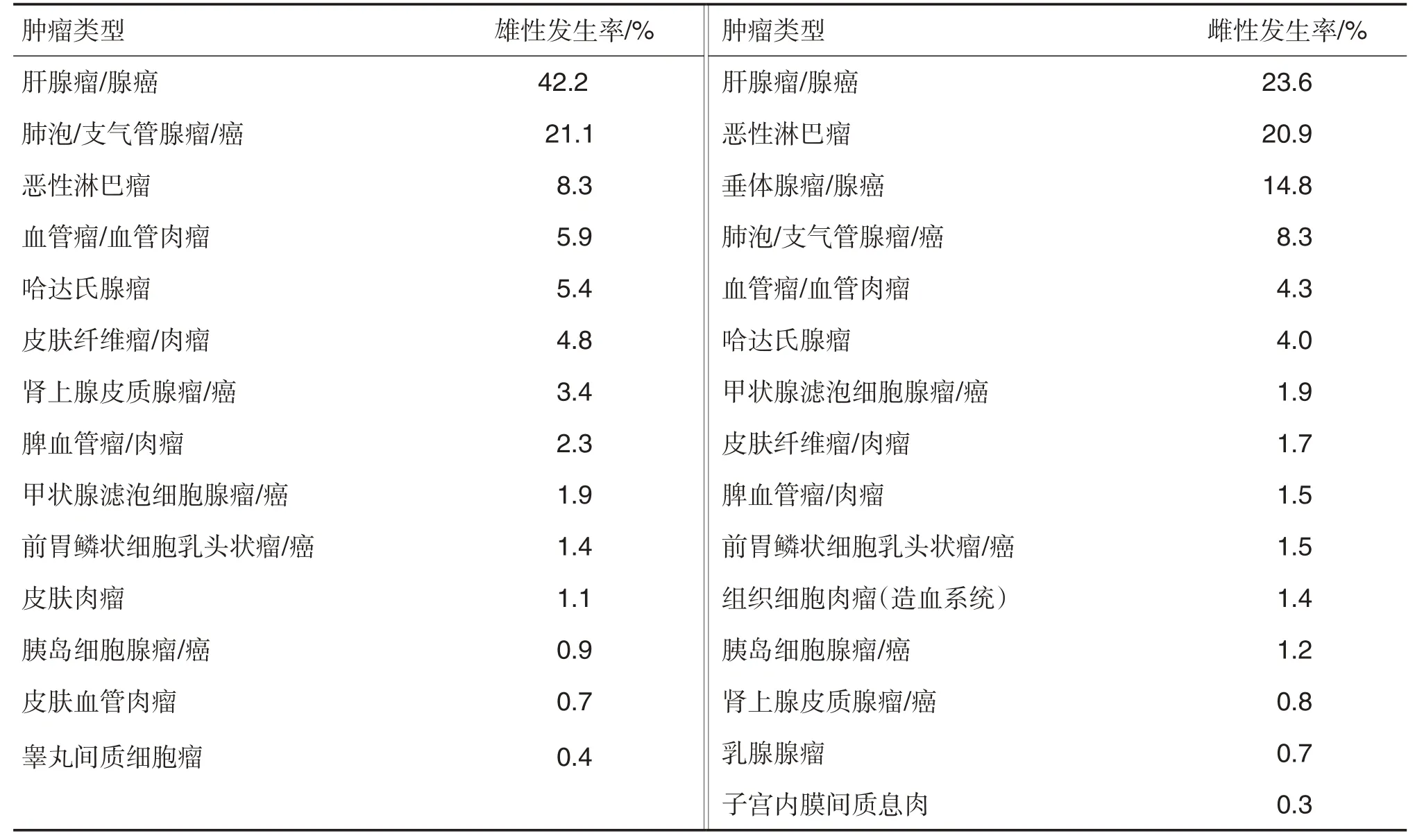
表7 B6C3F1小鼠常见自发性肿瘤发生率
Son 等[18](2004 年)总结了CD-1 小鼠20 个致癌试验(正常对照组小鼠1453只)中50周前死亡小鼠肿瘤发生率(死亡率0.07%)。结果显示,淋巴瘤发生率最高(22.8%)和肺泡/支气管腺瘤(0.04%)。Bertrand等[29](2014年)比较了2002-2013年致癌试验中不同品系动物神经系统肿瘤的发生率,发现CD-1小鼠神经肿瘤发生率80周为0.2%,108周为0.42%。
6 转基因小鼠历史对照数据
2年期大鼠致癌性试验因其种属特异性致癌机制和高发的自发性肿瘤,对人类肿瘤相关性的预测能力因此常被质疑。自1996 年转基因小鼠模型出现在人用药物注册技术要求国际协调会议(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)S1B 指导原则中以来,美国FDA 已经接受使用转基因小鼠模型开展致癌性研究[9]。目前,可用的转基因小鼠有Tg.rasH2,p53+/-,xpa-/-和Tg.AC 等。rasH2 转基因小鼠于1989 年由日本中央实验动物研究所(Central Institute for Experimental Animals,CIEA)建立。rasH2转基因小鼠模型具有预测准确率高(达76%),试验周期短的特点,因而被广泛使用[46]。
Nambiar 等[20](2012 年)汇总了rasH2 小鼠的11 个致癌性试验(正常对照组雌雄动物分别为363 只,333 只)(表8)。作者还总结了文献中rasH2的高发肿瘤:支气管/肺泡腺瘤(5.3%~5.4%)、脾血管肉瘤(3.0%~3.7%)、皮肤鳞状细胞乳头状瘤(1.3%~1.8%)、淋巴瘤(0.3%~2.4%)和胃鳞状细胞乳头状瘤(0.6%~1.3%)。由于转基因小鼠缩短了试验周期,高发的肿瘤发生率均<10%。在肿瘤发生谱上,转基因小鼠与BALB/c和C57BL/6等小鼠相似。
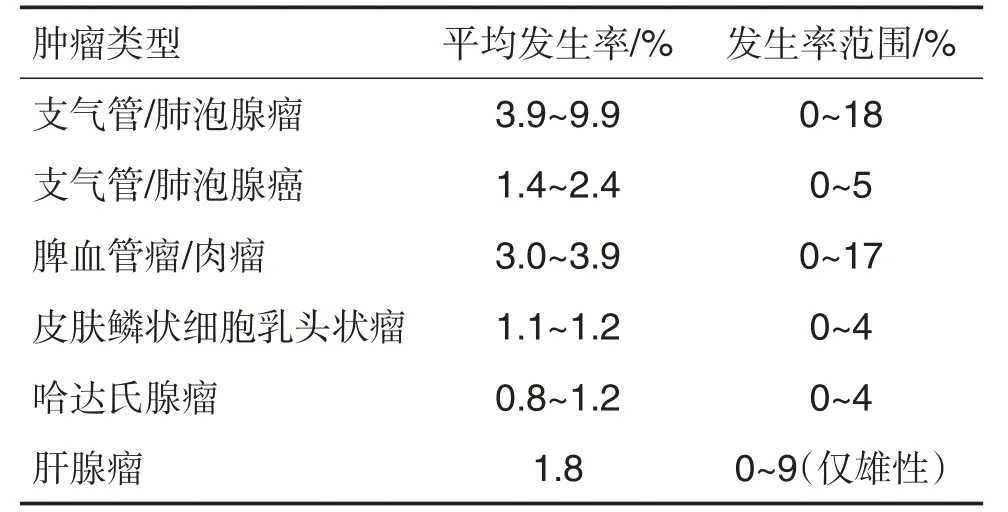
表8 rasH2转基因小鼠常见自发性肿瘤发生率[20]
7 结语
自发性肿瘤发生率具有雌雄差异。从上述数据可见,不同品系大鼠和小鼠的肿瘤发生率都具有雌雄差异。由于Wistar和SD大鼠的内分泌系统如垂体、甲状腺和乳腺等部位肿瘤高发,即呈现为雌性肿瘤发生率远高于雄性,这主要与大鼠特有的高催乳素水平有关[36]。而在其他品系如F344,B6C3F1和CD-1小鼠中,则呈现为雄性肿瘤发生率远高于雌性。Cook 等[47]指出,雄性动物癌的总发生率是雌性动物的1.69倍(性器官除外),而人也存在相似的趋势。化学致癌物引起的肿瘤也存在雌雄差异,原因可能与性激素受体表达,以及遗传易感性、饮食热量控制和体质量等多种因素有关[48]。
历史对照数据具有很重要的意义和价值。在致癌性研究中,毒性病理学家通过对比给药组动物和同期对照组的病变(增生性病变和肿瘤)发生率的差异,以判断该病变是否与药物作用相关,进一步确定是否具有致癌性。由于动物数量的限制和个体差异等原因,使得判断药物相关的病理改变和有剂量-效应关系的病理变化时常常受到“干扰”,这就需要参考有效的历史对照数据,特别是在出现罕见肿瘤的组间差异时,或者对照组和给药组均有发生时,又或者某一肿瘤发生率略超出同期对照的范围时[38]。不同种属实验动物的肿瘤自发病变数据不仅在致癌试验评价中提供参考,对于其他较长时间的动物试验中发现的病变进行分析评价也是一个有价值的资料。
有些因素会使历史对照数据受到影响。历史对照数据的价值很大程度上取决于数据的一致性。本综述引用的NTP 项目中的数据是当年最大的F344大鼠和B6C3F1小鼠的背景数据库(1998年),并在病理诊断时采用病理工作组(Pathology Working Group)形式以确保数据的一致性。因此,一致性越好的数据参考价值越大。影响数据一致性的因素包括解剖修切等组织处理过程,病理学家的诊断标准和术语的使用,以及动物种属、来源、设施环境、溶媒、饲料和给药途径等因素。其中,病理学家的标准术语的使用和诊断的一致性影响较大。国际通用的大小鼠术语和诊断标准(International Harmonization of Nomenclature and Diagnostic Criteria for Lesions in Rats and Mice,INHAND)[49]提供了最新的诊断术语,供全球毒性病理学家参考。按照我国新法规的要求,切实做好同行评议,必将大大增加病理诊断的一致性和可靠性,并可进一步建立各机构内部的对照数据库。
综上,历史对照数据在致癌试验中具有独特的重要性。首先,参考已有的历史对照数据,提高致癌性试验的设计和结果的判读水平。其次,不断提高组织病理诊断术语的规范化建设,加强同行评议、实验室内部和不同实验室间的历史对照数据的共建共享。
