活性氧在肿瘤发生和治疗中的作用研究进展
2019-10-09石焕焕朱运峰
石焕焕,朱运峰
(北京交通大学生命科学与生物工程研究院,北京100044)
活性氧(reactive oxygen species,ROS)是氧衍生的活性小分子,包括O2·-,·OH,RO2·,RO·和
某些非ROS[1]。线粒体和还原型烟酰胺腺嘌呤二核苷酸磷酸还原型辅酶Ⅱ(reduced nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶家族是内源性ROS 的2 个主要贡献者。线粒体是内源性ROS的最大贡献者之一。据估计,线粒体消
耗的约1%O2用于产生O2·-[2],线粒体有多达10 个能产生O2的已知位点[3]。复合物Ⅲ已被证明可将O2·-和H2O2释放到膜间隙和线粒体基质中,它们是许多生物过程所必需的,包括细胞分化、细胞信号传递和适应性免疫[4]。NADPH 氧化酶家族的主要功能是产生ROS,通过生物膜转移电子产生O2·-,它迅速转化为H2O2,可通过水通道蛋白扩散穿过膜,影响多种细胞信号转导[5]。在高浓度时,ROS可能损害生物大分子,包括DNA[6]、蛋白质[7]和细胞膜成分,并进一步在癌症的发生与发展中起作用[8]。
1 ROS与肿瘤发生发展相关的信号通路
在多数癌症患者中都检测到ROS 的升高[9],ROS 相关敏感信号通路蛋白在许多类型的癌症中表达持续升高,它们参与细胞生长、增殖、分化,蛋白质合成,葡萄糖代谢,细胞存活和炎症反应等生物功能[10]。ROS 可作为细胞信号转导的第二信使,参与磷酸肌醇-3 激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)调节的信号途径,以及NF-κB激活途径。
PI3K/Akt 通路参与许多关键的细胞功能,包括蛋白质合成、细胞周期进程、增殖、细胞凋亡和自噬[11-12]。乳腺癌细胞中,雌激素代谢产生的ROS可激活PI3K/Akt信号通路[13];上皮生长因子(epidermal growth factor,EGF)在人卵巢癌细胞中产生的H2O2激活Akt 及其底物P70 S6K1[14];此外,胆囊癌细胞中ROS 的抑制降低了磷酸化(活性)Akt 的水平并诱导了细胞凋亡[15]。ROS 还可灭活染色体缺失的磷酸酶和张力蛋白同源物(phosphatese and tension homology deleted on chromsome ten,PTEN),其负调节3,4,5-三磷酸磷脂酰肌醇(3,4,5-phosphatidyl inositol phospate,PIP3)的合成,从而通过氧化活性中心内的半胱氨酸残基来抑制Akt的活化;此外,ROS 能促进PTEN 上酪蛋白激酶Ⅱ的磷酸化,促使PTEN进入蛋白水解途径[16]。
NF-κB 是氧化还原调节的氧化应激传感器,并被低剂量的H2O2激活。如用白细胞介素1β(interleukin-1β,IL-1β)处理MCF-7乳腺癌细胞获得H2O2和超氧化物,此结果激活了NF-κB,同时也促进了细胞增殖[17]。NF-κB 诱导激酶(NF-κB inducing kinase,NIK)是NF-κB 途径中内源性ROS 的关键靶标,口腔鳞状细胞癌细胞中,ROS 可通过其促进NIK 活性和随后的NF-κB 反式激活的能力而作为NF-κB信号级联的生理信号调节剂起作用[18]。在口腔鳞癌细胞中,沉默超氧化物歧化酶(superoxide dismutase,SOD)可增加胞内ROS 水平,与NIK 和NF-κB 活性增加相关[18]。由4-羟雌甾二醇过量产生的ROS 通过诱导IκB 激酶α 和IκB 激酶β 活性增加NF-κB 的核转位及与DNA 的结合能力,从而有助于肿瘤细胞生长[19](图1)。
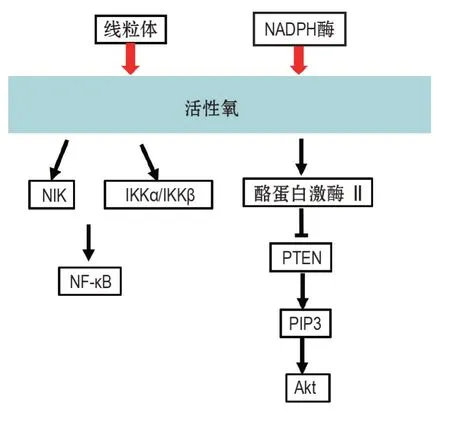
图1 活性氧相关信号通路.NIK:NF-κβ 诱导激酶;IKKα:Iκβ 激酶α;IKKβ:Iκβ激酶β;PTEN:张力蛋白同源物;PI3K:磷酸肌醇-3激酶;Akt:蛋白激酶B;PIP3:3,4,5-三磷酸磷脂酰肌醇.
2 ROS与肿瘤细胞增殖
低浓度的外源性H2O2通过增加细胞内ROS水平促进IgG 缺陷癌细胞存活[20]。通过小干扰RNA抑制抗氧化酶Mn-SOD 表达可导致卵巢癌细胞中超氧化物增加70%,促进癌细胞增殖[21]。NADPH氧化酶是ROS产生的主要原因之一,在HCT-15和HT-29 细胞中,干扰其表达后,显著抑制ROS 的产生,抑制细胞增殖[22]。在乳腺癌细胞中,抑制线粒体单向转运体可阻止ROS的产生,并抑制雌激素诱导的细胞增殖[23]。雌激素诱导的细胞增殖是由ROS介导的胞外信号调节激酶(extracellular signalregulated kinase1/2,ERK1/2)/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路激活引起的[24]。相反,抗氧化剂可抑制肿瘤细胞增殖[25]。抗氧化酶Mn-SOD 的稳定异位表达降低了胰腺肿瘤细胞的细胞生长[26]。此外,内源性Mn-SOD 和Cu/Zn-SOD 及过氧化氢酶和谷胱甘肽过氧化物酶的表达水平和活性与各种胰腺癌细胞系中的细胞增殖呈负相关[26]。
3 ROS与肿瘤细胞迁移和侵袭
基质金属蛋白酶(matrix metalloproteinase,MMP)家族是一类依赖于锌离子和钙离子的蛋白水解酶,主要的生理作用是降解细胞外基质,MMP 病理状态下参与组织重构、风湿性关节炎和恶性肿瘤转移等生理病理活动。
ROS 的生成介导信号转导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)-MMP2 级联的刺激激活[27],可使细胞表现出更高的迁移和侵袭能力[28]。A549 细胞暴露于Cd 2 μmol·L-1,胞内ROS产生显著增加,同时细胞的迁移和侵袭[29]增强。肾上腺素和去甲肾上腺素处理乳腺癌细胞后产生ROS水平升高,并且去甲肾上腺素处理诱导血红素加氧酶1、MMP-2和MMP-9的表达[30]。隐丹参酮可降低黑色素瘤细胞系A375细胞ROS水平同时还在体外阻断细胞迁移和侵袭,这与MMP-9的下调有关[31]。
此外,细胞迁移这一过程依赖于局灶性细胞-基质黏连的动态转换。黏着斑激酶(focal adhesion kinase,FAK)是调节局灶性细胞-基质黏连动态转换的关键蛋白,ROS 产生增加可导致FAK 的磷酸化增加从而促进细胞迁移[32]。侵袭性伪足是癌细胞中富含肌动蛋白的膜突起,促进细胞周围蛋白水解和侵袭行为,而NADPH 氧化酶系统产生的ROS是侵袭性伪足形成和功能所必需的[33]。
4 ROS与肿瘤细胞凋亡
细胞内ROS 的不成比例增加可诱导癌细胞周期停滞和凋亡。跨膜四蛋白超家族1(transmembrane-4-L-six-family-1,TM4SF1)是L6 家族的成员,可以调节细胞发育、生长和运动,TM4SF1 的减少可能通过上调BCa 细胞中的ROS,诱导细胞周期停滞和凋亡[34]。细胞周期蛋白B 是细胞周期蛋白家族的成员,与细胞周期蛋白依赖性激酶(cyclindependent kinase,CDK)相互作用以调节G2/M 周期检查点,ROS 的积累通过下调细胞周期蛋白B1而引起G2/M期阻滞[35];微原纤维相关蛋白5(microfibrin related protein 5,MFAP5)是细胞外基质糖蛋白,MFAP5敲低的细胞中ROS水平升高,诱导大量细胞分布于G2/M期,同时降低细胞周期蛋白B1、细胞周期蛋白D1和CDK4的表达[36]。
ROS 的增加可激活线粒体介导的胱天蛋白酶级联凋亡途径,增加的Bax/Bcl-2 比率,促进凋亡[37]。P38是MAPK 家族成员,参与凋亡信号转导以响应ROS 的增加。研究显示,可通过增加P22phox/NADPH 氧化酶1相互作用和降低谷胱甘肽水平来提高细胞ROS 的产生,激活P38/MAPK途径诱导人乳腺癌MDA-MB-231细胞凋亡[38],也能通过激活ROS-MAPK介导的线粒体信号通路诱导胃癌细胞中胱天蛋白酶依赖性细胞凋亡[39](图2)。
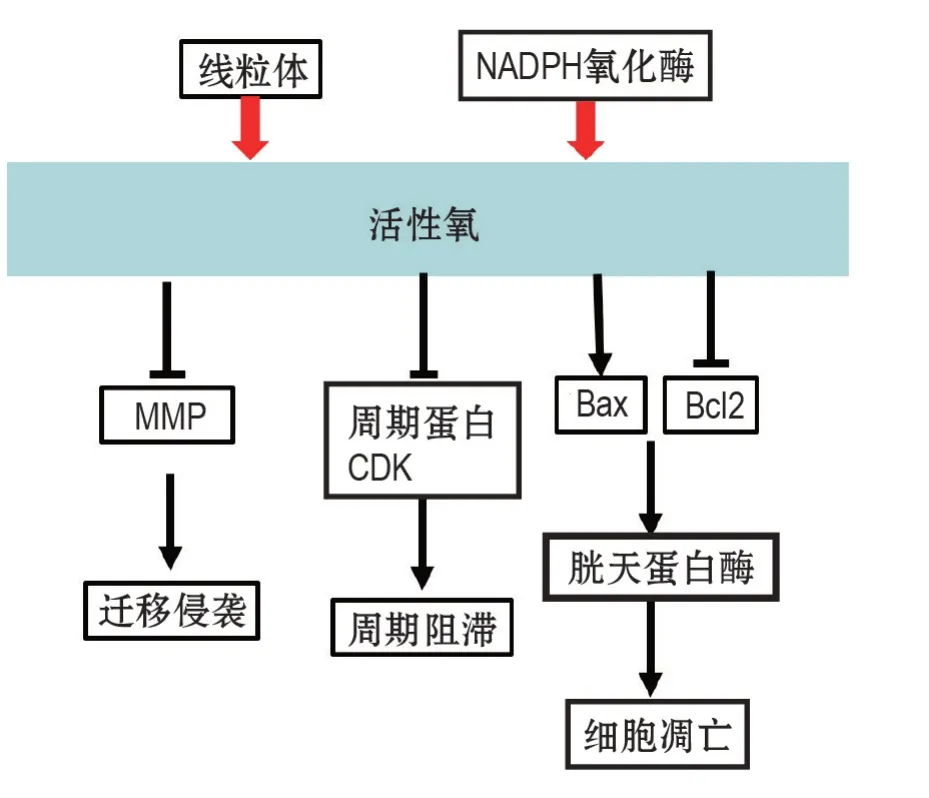
图2 活性氧对细胞迁移侵袭、周期和凋亡的影响.MMP:基质金属蛋白酶家族;CDK:细胞周期蛋白依赖性激酶.
5 ROS与干细胞
ROS在决定正常干细胞的命运中起重要作用,干细胞需低水平的ROS来维持静止和自我更新[40]。
在人类胃肠癌细胞中,干细胞样群(CD44高表达)具有较低的ROS 水平[41]。Chang 等[42]观察到这种产生低ROS的细胞群中干细胞标志物(OCT4和NANOG)的表达增加,并且比高产生ROS 的细胞群体致瘤性更高。多能干细胞(induced pleuripotent stem cells,iPSC)由于内源性抗氧化酶的上调而显著降低胞内ROS 水平[43]。谷氨酰胺在肿瘤干细胞(cancer stem cells,CSC)中的主要作用是作为谷胱甘肽合成的代谢前体以维持氧化还原平衡,并使细胞内ROS保持在相对低的水平。因此,谷氨酰胺的消耗导致ROS增加,其倾向于诱导细胞分化并最终导致CSC群体的逐渐减少[44]。当干细胞中产生过量的ROS时,它将直接导致组织更新和再生的恶化。过量的ROS 会损害干细胞自我更新、分化和增殖[45]。miR-155-5p 通过靶向共同转录因子C/ebpβ 来抑制抗氧化基因而诱导间充质干细胞ROS产生,引发移植的干细胞特性丧失[46]。
6 ROS在肿瘤治疗中的作用
基于ROS的肿瘤治疗是抗癌的新思路,目前被认为是癌症治疗的基本手段。与正常细胞相比,肿瘤细胞处于相对较高的氧化还原状态,因此通过调节细胞内ROS 水平选择性杀死肿瘤细胞。传统抗癌药物在这其中发挥着重要作用,同时新型ROS载体在其中也发挥重要作用。
6.1 针对ROS的传统抗癌药物
维生素C作为电子供体,可减少ROS[47]。王红阳院士研究团队发现,高浓度的维生素C对肝癌干细胞具有显著的杀伤作用[48]。进入细胞的维生素C通过增加细胞内ROS,引起DNA损伤和能量耗竭,最终导致细胞周期阻滞和凋亡。维生素C 也起着预防作用。如严重的获得性肺炎患者表现出ROS、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和IL-6显著增加,SOD活性显著降低和DNA损伤,维生素C 能显著降低ROS,TNF-α 和IL-6,减轻DNA损伤[49];长期补充维生素C的萎缩性胃炎患者,血清ROS含量显著降低,提示维生素C可减少萎缩性胃炎患者的氧化应激[50]。
一些天然化合物也可通过使ROS产生增加,从而诱导细胞凋亡。冬凌草有显著的抗肿瘤活性,据报道,冬凌草甲素可诱导多种癌细胞凋亡或自噬,这与其诱导细胞ROS产生增加有关[51-53];冬凌草甲素也可诱导食管癌KYSE-150 细胞产生ROS 依赖性的凋亡[54]。通过产生ROS,诱导P53、激活胱天蛋白酶和抑制STAT3 信号通路诱导结肠癌HCT116细胞凋亡[55]。木香烃内酯以浓度依赖性方式抑制食管癌Eca-109细胞的生长[56],这与线粒体膜电位的丧失和ROS 的产生有关,通过上调Bax,下调Bcl-2,显著激活胱天蛋白酶3 和多聚ADP-核糖聚合酶,引发食管癌细胞凋亡[56]。
6.2 ROS响应性载体疗法
肿瘤的病理微环境的ROS 水平较高,利用这一特点,研究者探索出ROS 响应性载体,利用载体/ROS高亲和力的特点,提高载体安全性的同时达到治疗疾病目的[57]。
多柔比星(doxorubicin,DOX)可由ROS 响应性载体运载,利用载体本身的ROS高亲和性得到释放而起到其抗癌活性。两亲性材料胶束作为载体运载DOX 可作为抗癌剂,利用癌细胞内高ROS 诱导两亲性材料降解,释放DOX 诱导癌细胞凋亡[58]。由硫醇缩酮运载DOX 和光敏感化合物,实现同步化疗和光动力疗法[59],硫缩酮连接光敏感基团启动光动力疗法,同时释放DOX达到抗肿瘤的疗效[60]。硼酸酯在氧化条件下会响应ROS 而有效降解,导致纳米系统的拆解,运载的DOX发挥作用,可有效逆转肿瘤耐药[58]。另一种ROS 响应性载体可通过阿帕替尼增强DOX敏感性和ROS介导的光动力疗法性能之间的协同作用成功地逆转了肿瘤耐药[61]。ROS 响应性载体可同时增加肿瘤氧合作用抑制缺氧诱导因子功能,优化放疗的治疗作用[62]。
7 展望
ROS 与许多疾病有着直接或间接的联系。当ROS 长期攻击人体细胞时,细胞正常活动遭到破坏,机体自身的氧化抗氧化失衡,ROS 堆积细胞受损影响自身免疫能力,导致疾病甚至癌症的发生。传统抗癌药物抑制癌细胞生长的机制上有许多文献报道,但在临床上的治疗效果鲜有了解,其能否在清除癌细胞的同时保护正常细胞还需长时间的研究,相信新型抗癌药物载体的探究和应用能更好地解决这一问题。随着对ROS在基础医学、临床医学和生物科学等方面研究的不断深入,人们在相关疾病的诊断、治疗方面将取得更大的突破。
