肉苁蓉苯乙醇总苷对脂多糖致大鼠急性肺损伤的抑制作用
2019-10-09由淑萍张石蕾
由淑萍,汪 波,赵 军,马 龙,张石蕾,刘 涛
(新疆医科大学1.公共卫生学院,2.护理学院,新疆 乌鲁木齐830011;3.新疆维吾尔自治区药物研究所,新疆 乌鲁木齐830004)
急性肺损伤(acute lung injury,ALI)是一种常见的临床危重急症,其主要发病机制是过度失控的炎症反应和促炎-抗炎反应失衡[1],虽然临床上对ALI 的治疗有一些新的突破,但发病率和死亡率依然居高不下。目前,ALI 的病因被归纳为直接因素和间接因素2大类,直接因素包括严重的肺部感染、吸入性肺炎和肺或胸部挫伤等,间接因素包括全身炎症反应综合征、脓毒症和重度胰腺炎等。尹刚等[2]以败血症大鼠ALI 模型作为间接因素,研究发现肉苁蓉对败血症所致大鼠ALI具有良好的保护作用。直接因素的肺部感染中,革兰阴性杆菌脂多糖(lipopolysaccharide,LPS)是引起ALI 及死亡的主要原因之一[3]。本课题组前期研究结果表明,肉苁蓉苯乙醇总苷(Cistanche phenylethanol glycosides,CPhG)是肉苁蓉发挥药效的主要物质基础,具有保护神经、抗高原肺水肿和脑水肿、保肝护肝、抗氧化、增加人体免疫功能和延缓衰老等多种功效[4]。但肉苁蓉是否能够对LPS等直接因素所致的ALI起到保护作用尚未见报道。基于此,本研究采用经口气管插管后雾化给予LPS溶液建立大鼠ALI模型,使LPS直接作用于肺组织,模拟临床上直接因素如肺部感染、吸入性肺炎所致的ALI,观察CPhG对ALI模型大鼠血清生化指标、细胞因子以及肺组织病理变化的影响,初步阐明CPhG 对LPS 所致大鼠ALI的保护作用及可能的作用机制。
1 材料与方法
1.1 动物、药物、试剂和仪器
SPF 级健康雄性SD 大鼠,体质量180~220 g,购自新疆医科大学实验动物研究中心,合格证号SCXK(新)2016-0002,使用许可证号为SYXK(新)2016-0003。动物实验的所有相关程序由新疆医科大学第一临床附属医院动物伦理委员会批准。
CPhG(产地:新疆和田,批号:20180502)(和田帝辰医药生物科技有限公司),主要包含松果菊苷与毛蕊花糖苷2 种成分,CPhG 纯度≥85.0%,其中松果菊苷纯度≥40.0%,毛蕊花糖苷纯度≥16.0%,用0.5%羧甲纤维素钠(carboxymethylcellulose sodium,CMC-Na)(西安正天药用辅料有限公司)将CPhG配制成不同浓度混悬液,置4℃冰箱保存待用。LPS(北京索莱宝生物有限公司)。
醋酸地塞米松片(dexamethasone acetate,Dex)(浙江仙琚制药股份有限公司);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)和IL-6 检测试剂盒(武汉华美生物工程有限公司);血清超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutatathione,GSH)活性及丙二醛(malondialdehyde,MDA)和一氧化氮(nitric oxide,NO)含量检测试剂盒(南京建成生物工程研究所有限公司)。
TDL-40C 型离心机(上海安亭),BC-5000Vet全自动血细胞分析仪(深圳迈瑞生物医疗电子股份有限公司),HH-501 恒温水浴锅(常州万合仪器制造有限公司),全自动酶标仪(美国Bio-Rad 公司),紫外分光光度计(日本岛津仪器公司),雾化注射器(北京慧荣和科技有限公司)。
1.2 实验分组和处理
雄性SD 大鼠60 只。随机分为6 组,正常对照组、模型(LPS 3 mg·kg-1)、模型+Dex 2 mg·kg-1(阳性药对照组)、模型+CPhG 125,250和500 mg·kg-1处理组[3,5],每组10 只。各用药组大鼠均ig 给予相应剂量受试物,正常对照组、模型组和模型+Dex 2 mg·kg-1组给予蒸馏水,连续30 d,阳性药对照组大鼠于造模前1 h ig给予Dex 2 mg·kg-1。
在第31天,各组大鼠除正常对照组外,其余组大鼠均ip给予1%戊巴比妥钠溶液(80 mg·kg-1)麻醉,采用雾化注射器给予LPS 3 mg·kg-1建立大鼠ALI模型,此次大鼠麻醉复苏时间约1 h。
1.3 样本采集和指标检测
造模后3 h进行第2次麻醉,经腹主动脉采血处死大鼠,全自动血细胞分析仪检测中性粒细胞百分比[6],其余血液于4℃,1500×g离心15 min,取上清液保存于-80℃超低温冰箱,检测MDA,NO,SOD和GSH 含量或活性[7]。结扎右肺,暴露气管并插管,向左肺注入4℃,PBS 溶液3 mL 进行支气管肺泡灌洗,重复3次。于4℃、1500×g离心15 min,收集上清液,分装后保存于-80℃超低温冰箱保存,ELISA 试剂盒检测细胞因子IL-1β,IL-6 和TNF-α的含量;取大鼠右肺后叶,甲醛固定,HE 染色做病理组织学检查,观察肺组织病理改变并行组织病理评分,每个实验组随机选取6张病理切片进行评分,评分标准选用Szarka等[8]建立的病理学分级标准,将肺损伤情况分为0~Ⅳ级(表1);中叶称重(湿重g)后,将其置于80℃干燥箱内,干燥48 h后取出,称重(干重g),计算肺湿/干重(W/D)比重。
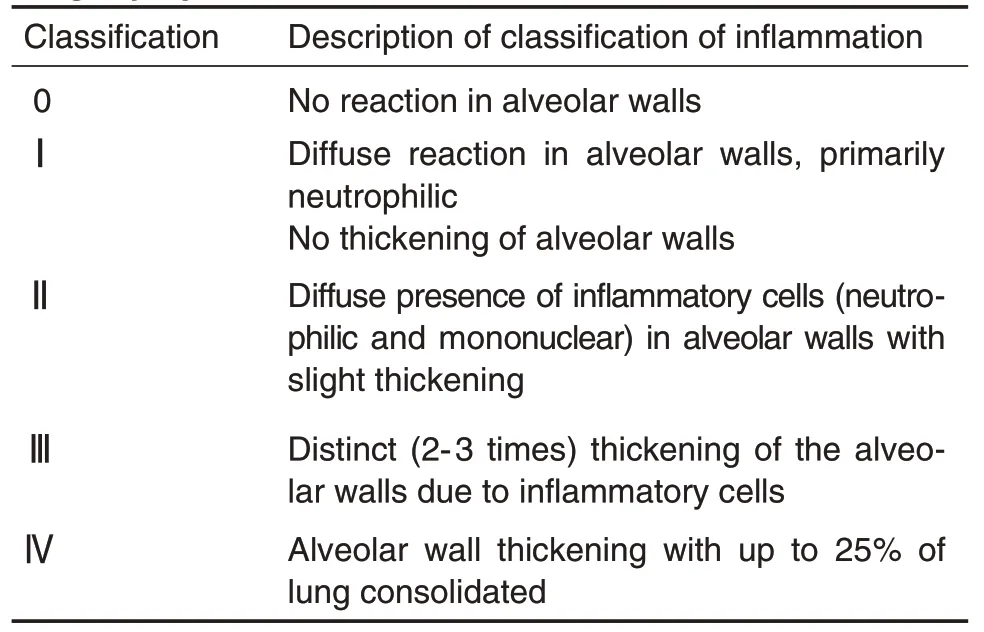
Tab.1 Pathological classifications standard for acute lung injury(ALl)
1.4 统计学分析
2 结果
2.1 CPhG 对LPS 致急性肺损伤大鼠全血中性粒细胞百分比的影响
全自动血细胞分析仪检测结果(表2)显示,与正常对照组相比,模型组大鼠全血中性粒细胞百分比明显增加(P<0.05)。与模型组相比,模型+CPhG 500 mg·kg-1组大鼠全血中性粒细胞百分比明显下降(P<0.05),且其作用优于模型+Dex 2 mg·kg-1组(P<0.05),并且中性粒细胞百分比随剂量的增加而降低(r=-0.465,P<0.05)。
2.2 CPhG对LPS致急性肺损伤大鼠右肺中叶W/D比值的影响
LPS致ALI大鼠右肺中叶W/D比值结果(表3)显示,与正常对照组相比,模型组W/D 比值显著升高(P<0.05);与模型组相比,Dex 可显著逆转LPS诱导的大鼠W/D 比值升高(P<0.05),模型CPhG125 和250 mg·kg-1组W/D 比值变化无统计学差异,模型+CPhG 500 mg·kg-1组W/D比值显著降低(P<0.05)。随着剂量的增加,W/D比值呈现逐步降低的趋势(r=-0.429,P<0.05)。
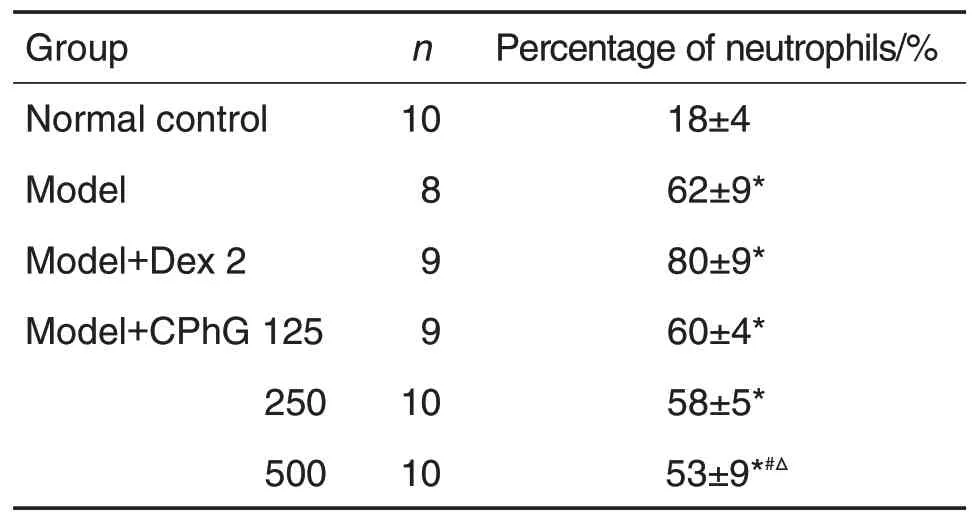
Tab.2 Effect of Cistanches phenylethanol glycosides(CPhG)on percentage of neutrophils in lipopolysacharide(LPS)-induced ALl rats
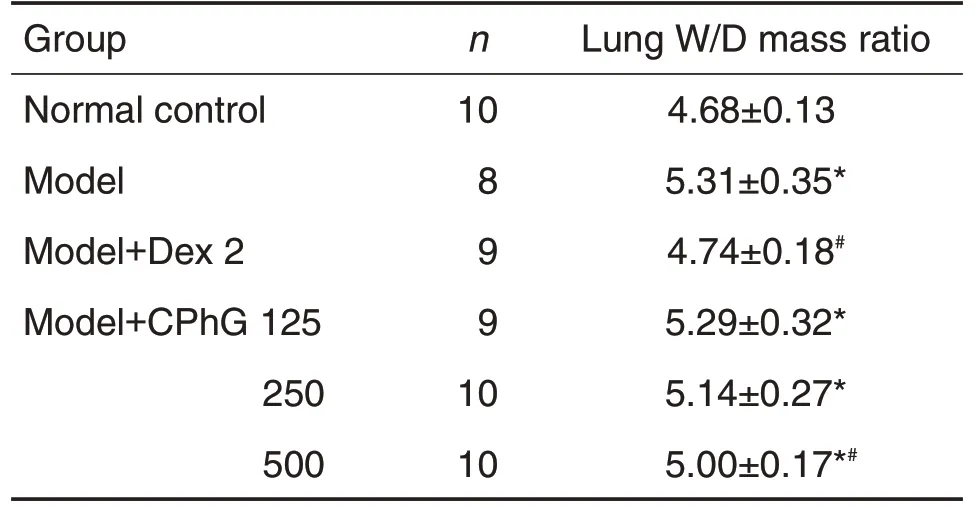
Tab.3 Effect of CPhG on lung wet/dry(W/D)mass ratio in LPS-induced ALl rats
2.3 CPhG 对LPS 致急性肺损伤大鼠血清中SOD和GSH活性及MDA和NO含量的影响
SOD和GSH活性及MDA和NO含量测定结果(表4)显示,与正常对照组相比,模型组SOD 活性降低(P<0.05),MDA 和NO 含量升高(P<0.05);与模型相比,模型+CPhG 500 mg·kg-1组大鼠血清中SOD 和GSH 活性明显增加(P<0.05),并且血清中GSH 活性均有随着CPhG 剂量增加而增加的趋势(r=0.376,P<0.05),而MDA和NO的含量明显降低(P<0.05),其中,模型+CPhG 500 mg·kg-1组MDA和NO含量降低明显(P<0.05)。
2.4 CPhG 对LPS 致急性肺损伤大鼠肺泡灌洗液TNF-α,lL-1β和lL-6含量的影响
ELISA结果(表5)显示,与正常对照组相比,模型组大鼠肺泡灌洗液中TNF-α,IL-1β 和IL-6 含量均明显增加(P<0.05);与模型组相比,模型+Dex 2 mg·kg-1阳性对照组和模型+CPhG 500 mg·kg-1组大鼠肺泡灌洗液中TNF-α 和IL-6 明显降低(P<0.05),TNF-α含量随着CPhG剂量增加而降低(r=-0.505,P<0.01)。
2.5 CPhG对LPS致急性肺损伤大鼠肺组织病理变化的影响
HE染色结果(图1)显示,正常对照组大鼠肺组织结构正常,肺泡壁表面光滑,肺泡腔清晰,结构完整,未见明显炎症细胞浸润;模型组大鼠肺间质增宽,肺泡壁毛细血管扩张充血,可见大量中性粒细胞、淋巴细胞、单核细胞浸润,支气管周围可见大量淋巴细胞、浆细胞,淋巴滤泡增生;模型+Dex 2 mg·kg-1组可见肺泡隔增宽,肺泡壁毛细血管壁充血,炎细胞浸润,部分肺泡腔内可见水肿液、漏出的红细胞和渗出的炎细胞;模型+CPhG125 mg·kg-1组可见大量炎症细胞浸润,炎性改变区域明显减少,间隔变窄,炎症有所改善;模型+CPhG 250 mg·kg-1组炎性区域更少,趋于好转;模型+CPhG 500 mg·kg-1组基本看不到增宽的肺泡间隔。
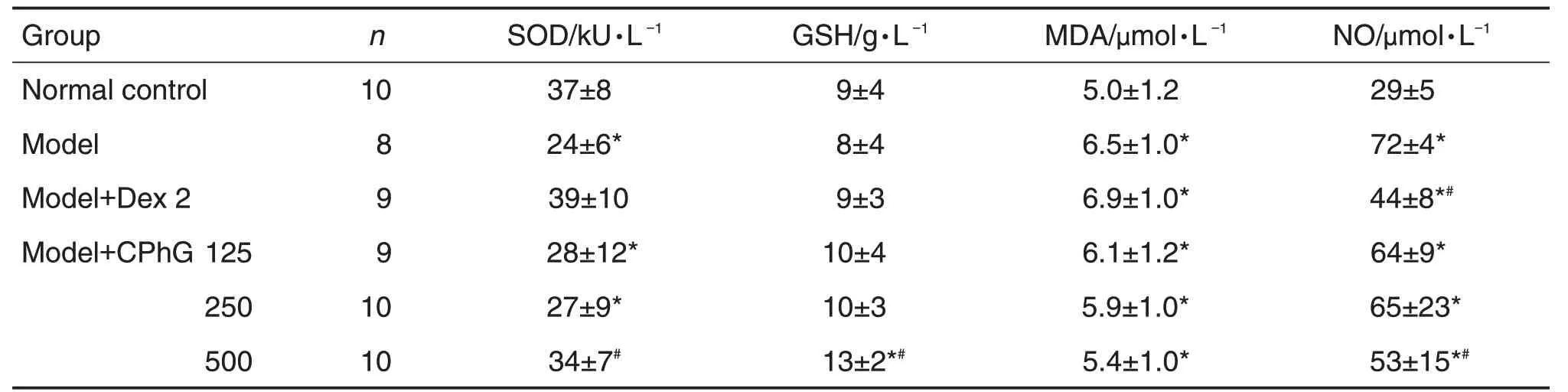
Tab.4 Effect of CPhG on serum SOD and GSH activity and MDA and NO content in LPS-induced ALl rats
肺组织病理分级结果及非参数检验(表6)可见,与正常对照组比较,各剂量组秩均值显著升高(P<0.01);而与模型组相比,模型+CPhG各剂量组秩均值显著降低(P<0.01),其中模型+CPhG 500 mg·kg-1组秩均值接近于模型+Dex 2 mg·kg-1组。
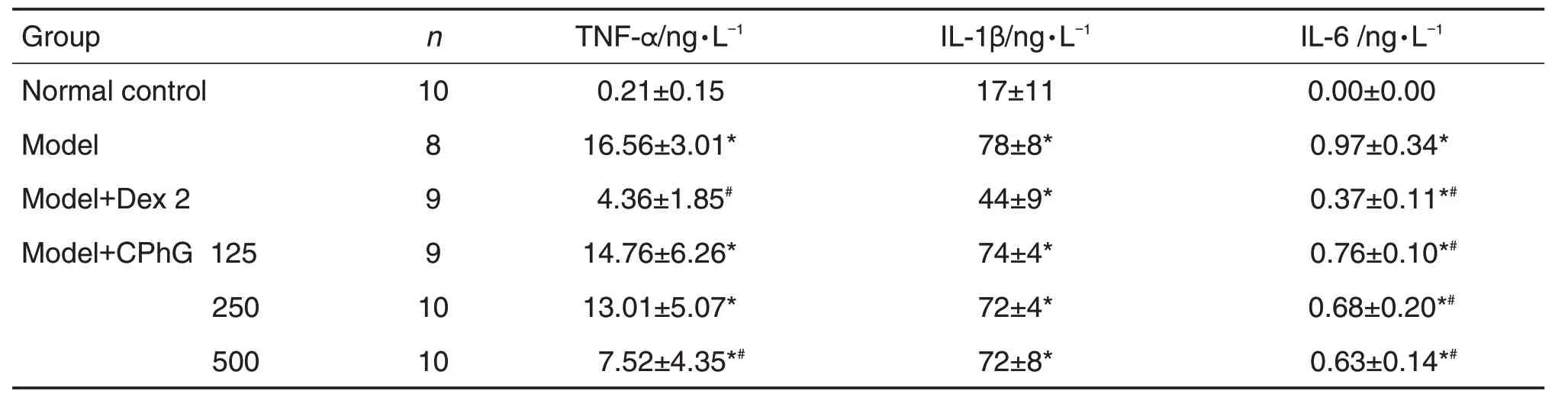
Tab.5 Effect of CPhG on interleukin-1β(lL-1β),tumor necrosis factor-α(TNF-α)and lL-6 levels in alveolar lavage fluid of LPS-induced ALl rats

Fig.1 Effect of CPhG on lung pathological sections of rats with ALl(HE staining).See Tab.1 for the rat treatment.
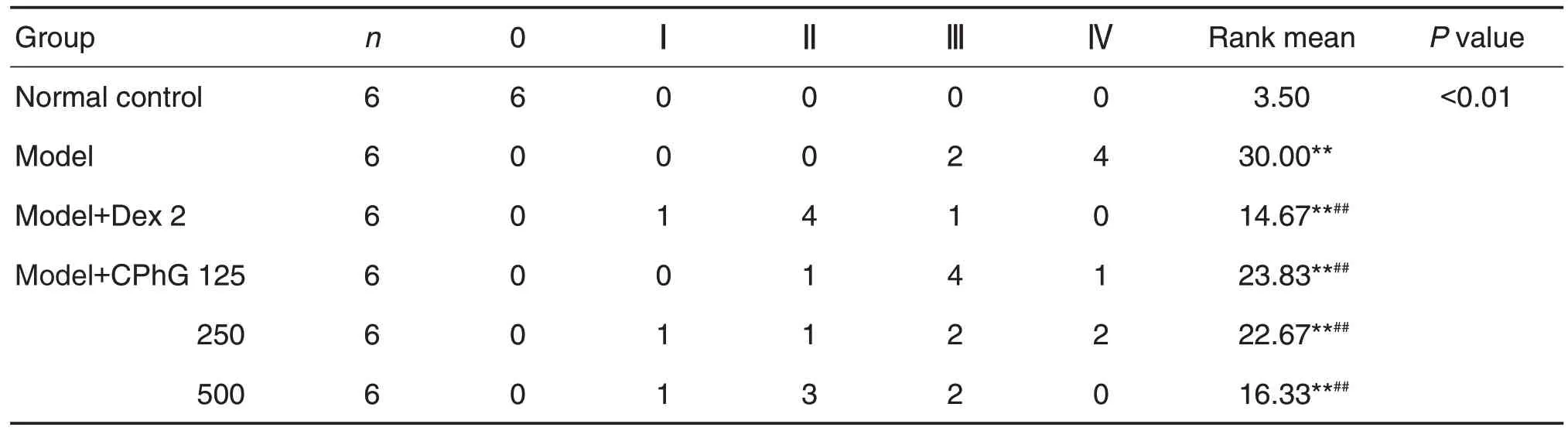
Tab.6 Effect of CPhG on lung pathological classification in LPS-induced ALl rats
3 讨论
本研究结果显示,CPhG 能够在一定程度上减轻大鼠ALI 模型肺部炎症程度,缓解肺水肿的程度。ALI 多由炎症介质及效应细胞共同参与,并呈现级联放大的炎症继发性损伤与继发性弥漫性肺实质损伤。有随机调查表明,ALI 患者死亡率高达35%~40%,随着医疗水平不断提升,ALI 患者的生存率已明显改善。研究表明,大部分苯乙醇类化合物具有抗炎作用[9],有研究者从玄参中提取得到苯乙醇苷类化合物,发现苯乙醇苷浓度0.5 mmol·L-1时能够对白三烯B4 产生较强的抑制作用,证明其具有抗炎作用,苯乙醇苷类化合物对金黄色葡萄球菌、链球菌、革兰阴性菌和革兰阳性菌均具有抑制作用,其抗炎作用主要依赖于其甲氧基的存在。
本研究采用经口气管插管后雾化给予LPS 溶液建立大鼠ALI 模型,使LPS 溶液随着大鼠的呼吸均匀地分布于各个肺叶,导致肺组织呈瀑布样炎症反应,其病理生理过程与临床上间接因素所致的ALI相符合。模型组大鼠在染毒后1 h,出现点头样呼吸,口唇略发绀,可闻及粗湿啰音,从全血中性粒细胞百分比和肺泡灌洗液中炎症因子水平来看,模型组大鼠各项炎症指标明显高于正常对照组;模型组大鼠肺组织病理切片显示,肺组织毛细血管充血和炎症细胞浸润等一系列明显的炎症改变,提示模型建立成功。
急性炎症反应的血象以中性粒细胞升高为主,它是反映炎症严重程度的重要指标。本研究结果显示,与模型组相比,模型+CPhG 各剂量组大鼠中性粒细胞百分比有不同程度的下降,其中模型+CPhG 500 mg·kg-1组降低明显,提示CPhG 在一定程度上能够减少中性粒细胞的增加,从而减少向炎症部位趋化的中性粒细胞,在一定程度上减轻了炎症反应。
肺组织W/D 比值直观地反映了肺组织水肿的程度,而肺水肿是导致急性呼吸衰竭的主要原因。本研究结果显示,模型+Dex 2 mg·kg-1肺水肿程度最轻,最接近于正常对照组,其余各组大鼠右肺中叶W/D比值较正常对照组均明显升高。但是模型+CPhG 500 mg·kg-1组W/D比值明显低于模型组,并且肺水肿程度随着剂量的增加而减轻,这表明CPhG能够降低肺部急性炎症中肺水肿的程度。
SOD 和GSH 是机体内重要的抗氧化活性物质,能够在急性炎症反应中减少自由基的产生,从而减轻肺组织损伤的程度,而MDA 是氧自由基作用于脂质的氧化终产物。从本研究结果来看,CPhG 能够增加大鼠血清中SOD 活性和GSH 含量,降低大鼠血清中MDA 含量,提示CPhG 能够通过增强抗氧化作用从而减轻炎症对于肺部的损伤程度。NO 在炎症反应中发挥多方面的介质作用,能够扩张血管,增加其通透性,增加炎性细胞的渗出。本研究结果显示,模型+CPhG 500 mg·kg-1组大鼠血清中NO 含量与模型组相比有明显降低,提示CPhG可能能够减少NO的产生而减轻肺部的炎症反应。
主要分泌IL-1β 的细胞包括肺泡巨噬细胞,它能够促进中性粒细胞从骨髓释放,诱导单核细胞和粒细胞向病灶趋化,释放溶酶体酶和炎症因子。TNF-α对肺组织有较强的损伤作用,它能够诱导肺内皮细胞活化、白细胞迁移、粒细胞脱颗粒和毛细血管渗漏,使水肿液大量积聚在肺泡,妨碍了肺泡细胞灌流和物质交换的功能[10],从而引起ALI。IL-6在急性炎症反应中处于中心地位,能够诱导B 细胞分化,诱导单核细胞分化,增强NK细胞活性。本研究结果表明,与模型组相比,CPhG可降低大鼠肺泡灌洗液中TNF-α,IL-1β和IL-6含量,提示CPhG可通过减少炎症介质的释放减轻ALI病程中出现的炎症反应,减轻肺损伤的程度从而起到一定的保护作用。
本研究病理组织学观察显示,与模型组相比,模型+CPhG 不同剂量组的炎症反应程均有不同程度的减轻,尤其是模型+CPhG 500 mg·kg-1组有明显好转,基本看不到增宽的肺泡间隔。提示CPhG 可减少肺泡毛细血管扩张充血的区域,减少炎细胞的浸润,缩小炎症灶,改善炎症反应。从肺组织病理分级的非参数检验来看,模型CPhG 各剂量组秩均值显著降低,其中模型+CPhG 500 mg·kg-1组秩均值接近于模型+Dex 2 mg·kg-1组,同样提示CPhG可减轻肺部的炎症损伤。
综上所述,CPhG 对LPS 诱导的ALI 具有一定的抑制作用,其机制可能与其抗氧化活性、减轻肺水肿程度和抑制炎症反应有关。CPhG可对ALI模型大鼠的中性粒细胞、血清生化指标、细胞因子及肺组织病理产生影响,从而对LPS 诱导的大鼠ALI起到抑制作用。本研究为临床应用CPhG防治ALI及研发新型药物提供了实验依据,具体的作用机制还有待深入研究。
