复方苦参注射液对人肝癌SMMC-7221细胞体外增殖、转移和侵袭的抑制作用及其机制
2019-10-09张婷婷李海剑武亚玲海丽娜
张婷婷,李海剑,武亚玲,海丽娜,4
(1.河南省食品药品检验所,河南 郑州450000;2.河南省食品药品审评查验中心,河南 郑州450000;3.北京振东光明药物研究院有限公司,北京100120;4.北京大学前沿交叉学科研究院,北京100871)
中国是肝癌发病重灾区。全球约85%肝癌新发病例出现在发展中国家,仅我国的肝癌新发病例就占世界肝癌病例总数的50%以上[1]。由于起病隐匿,确诊时多属中晚期,治疗效果较差,预后恶劣,严重威胁我国人民身体健康[2]。同时中晚期肝癌有明显的侵润性生长与血管侵犯,从而导致肿瘤病灶的弥散性生长与广泛转移[3]。复方苦参注射液(Compound Kushen Injection,CKI)是由苦参(Sophora flavescens Ait.)和白土苓(Heterosmilax yunnanensis Gagnep.)精制而成。中医认为,苦参具有清热燥湿之功效。苦参含有苦参碱(matrine)、氧化苦参碱(oxymatrine)、槐果碱(sophocarpine)和氧化槐果碱(oxalate)等多种活性成分[4-5]。临床上CKI 用于多种恶性肿瘤(如肺癌、胰腺癌、乳腺癌和结直肠癌等)的辅助治疗[6-8]。但CKI 在肝癌治疗中的作用,以及对肿瘤迁移和侵袭能力的影响尚不明确。为此,本研究通过体外培养人肝癌SMMC-7221细胞,观察CKI 对其迁移和侵袭能力的抑制作用,并探讨其对NF-κB信号通路的影响,为其进一步研究开发提供实验依据。
1 材料与方法
1.1 药品、试剂和仪器
CKI 购自山西振东制药股份有限公司(批号:20160506,总生物碱含量20 g·L-1);MTT,美国Sigma公司;Matrigel基质胶,美国BD公司;DMEM培养液,美国Gibco 公司;Transwell 小室,美国Corning 公司;兔抗人NF-κB 单抗,兔抗人GAPDH单抗和HRP 标记羊抗兔IgG 二抗,美国CST 公司;胎牛血清RNA 提取试剂盒,德国Qiagen 公司;SYBR Premix ExTaqTMⅡ试剂盒(货号:DRR820A),日本TaKaRa公司;其他试剂均为分析纯,购自北京化学试剂研究所。
CO2细胞培养恒温培养箱,美国Thermo 公司;紫外分光光度计,北京普析通用公司;荧光倒置显微镜,日本Olympus 公司;SYBR Green PCR 预混液,美国Thermo 公司;iCycle 实时定量PCR 系统、电泳仪和凝胶成像分析系统,美国Bio-Rad公司。
1.2 细胞和培养
人肝癌SMMC-7221细胞,购于美国ATCC,复苏后,在含10%胎牛血清的DMEM 培养基中培养,37℃、5%CO2及饱和湿度培养箱中培养3~4 d,待细胞汇合达80%时传代。
1.3 MTT法测定细胞存活率
将SMMC-7221细胞以1×107L-1的密度接种于96 孔培养板,每孔100 μL,每组5个平行孔,设空白孔。接种24 h后,加入终百分比为0.0%(细胞对照组)、2.5%、5.0%和10.0%CKI继续培养24 h。而后每孔加入终浓度为0.5 g·L-1的MTT,继续培养4 h后弃去上清,每孔加150 μL DMSO,30 min 后用酶标仪于570 nm测定各孔吸光度(A570nm)值。细胞存活率(%)=(实验组A570nm-空白组A570nm)/(细胞对照组A570nm-空白组A570nm)×100%。
1.4 划痕法检测细胞迁移
将SMMC-7221 细胞以1×108L-1的密度接种于24孔板中过夜培养。待细胞生长至融合状态,用无菌枪头均匀画5条横线,然后用PBS洗细胞3遍,去除划痕过程中产生的细胞碎片。加入终百分比为2.5%,5.0%和10.0%CKI溶液,同时设细胞对照组,将培养板放入细胞培养箱,24 h 后拍照。用Image J 软件计算划痕面积,从而得出细胞迁移率[9]。细胞迁移率(%)=实验组划痕面积/对照组划痕面积×100%。实验重复3次,取平均值。
1.5 Transwell法检测细胞体外侵袭
将Transwell小室用0.5%Matrigel基质胶50 μL铺板,置37℃培养箱孵育过夜,而后各孔加入100 μL DMEM 培养基,置37℃培养箱孵育30 min 水化基底膜,取出后吸出残余液体,备用。调整细胞悬液密度为1×108L-1,取90 μL加入Transwell小室上室中,同时各孔分别加入终百分比为0.0%,2.5%,5.0%和10.0%CKI 溶液10 μL,细胞对照组加入等体积PBS,每个浓度3个复孔。24孔板中每孔加入900 μL 含20%FBS的DMEM培养基,将Transwell小室放入其中,37℃,5%CO2培养箱常规培养24 h。取出小室,用镊子轻轻取下滤膜,用5%戊二醛4℃固定10 min,用0.1%甲紫染液于水平摇床上染色30 min,PBS漂洗3次,用棉签擦掉膜上层未穿过的细胞,置于载玻片上,100 倍镜下拍照,随机选取5个视野,计数侵袭细胞数[10]。侵袭率(%)=给药组细胞侵袭数/对照组细胞侵袭数×100%。
1.6 RT-PCR法检测NF-κB mRNA水平
终百分比为5.0%和10.0%CKI加入SMMC-7221细胞中孵育12 h 后收集细胞,Trizol 提取SMMC-7221 细胞RNA,按说明书操作,以GAPDH 为内参基因在实时荧光定量PCR 仪上进行扩增反应,引物序列:NF-κB 正向:5′-GGACCAGCAAAGGTTATTGTTC-3′,反向:5′-TTATACACGCCTCTGTCATTCG-3′;GAPDH正向:5′-CTTAGCACCCCTGGCCAAG-3′,反向:5′-GATGTCTGGAGAGCCCCG-3′。反应程序:95℃10 s,60℃30 s,共40个循环,以循环阈值(Ct 值)作为统计参数,mRNA 的表达水平采用2-ΔΔCt表示。每组重复3 次。
1.7 Western印迹法检测NF-κB蛋白表达水平
SMMC-7221 细胞以1×108L-1的密度接种到6孔培养板中,24 h后加入CKI(终百分比为5.0%和10.0%)同时设置细胞对照组,处理24 h 后终止培养,收集细胞,并加入SDS 裂解缓冲液于冰上裂解15 min。BCA法测定蛋白浓度并配平至浓度体积一致的样品,上样量20 μg,电泳后转膜至0.2 μm PVDF 膜。封闭液封闭1 h,一抗4℃孵育过夜,一抗浓度分别为GAPDH(1∶5000)和NF-κB(1∶2000),洗膜后加HRP标记的二抗(1∶5000),室温摇床孵育1 h,TBST洗膜后用ECL显影,以目标蛋白与内参蛋白积分吸光度比值反映目标蛋白的相对表达水平。
1.8 统计学分析
2 结果
2.1 CKI对SMMC-7221细胞存活率的影响
MTT 结果显示(图1),2.5%,5.0%和10.0%CKI 处理后,SMMC-7221 细胞存活率分别为细胞对照组的(92±8)%,(77±5)%和(56±7)%,其中5.0%和10.0%CKI 组细胞存活率较细胞对照组显著降低(P<0.01)。
2.2 CKI对SMMC-7221细胞体外迁移能力的影响
划痕修复实验结果显示(图2),经2.5%,5.0%和10.0%的CKI 处理24 h 后,SMMC-7221 细胞迁移率分别为(90±7)%,(50±10)%和(25±5)%,与细胞对照组细胞迁移率(100±8)%相比,5.0%和10.0%CKI 处理组细胞体外迁移率明显降低(P<0.01)。
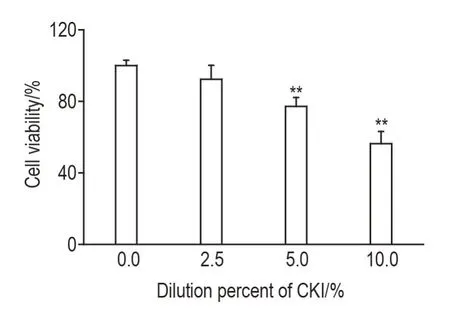
Fig.1 Effect of Compound Kushen Injection(CKI)on proliferation of SMMC-7221 cells by MTT.SMMC-7221 cells were treated with CKI at different dilution percentage for 24 h.±s,n=3.**P<0.01,compared with 0.0%CKI(cell control)group.
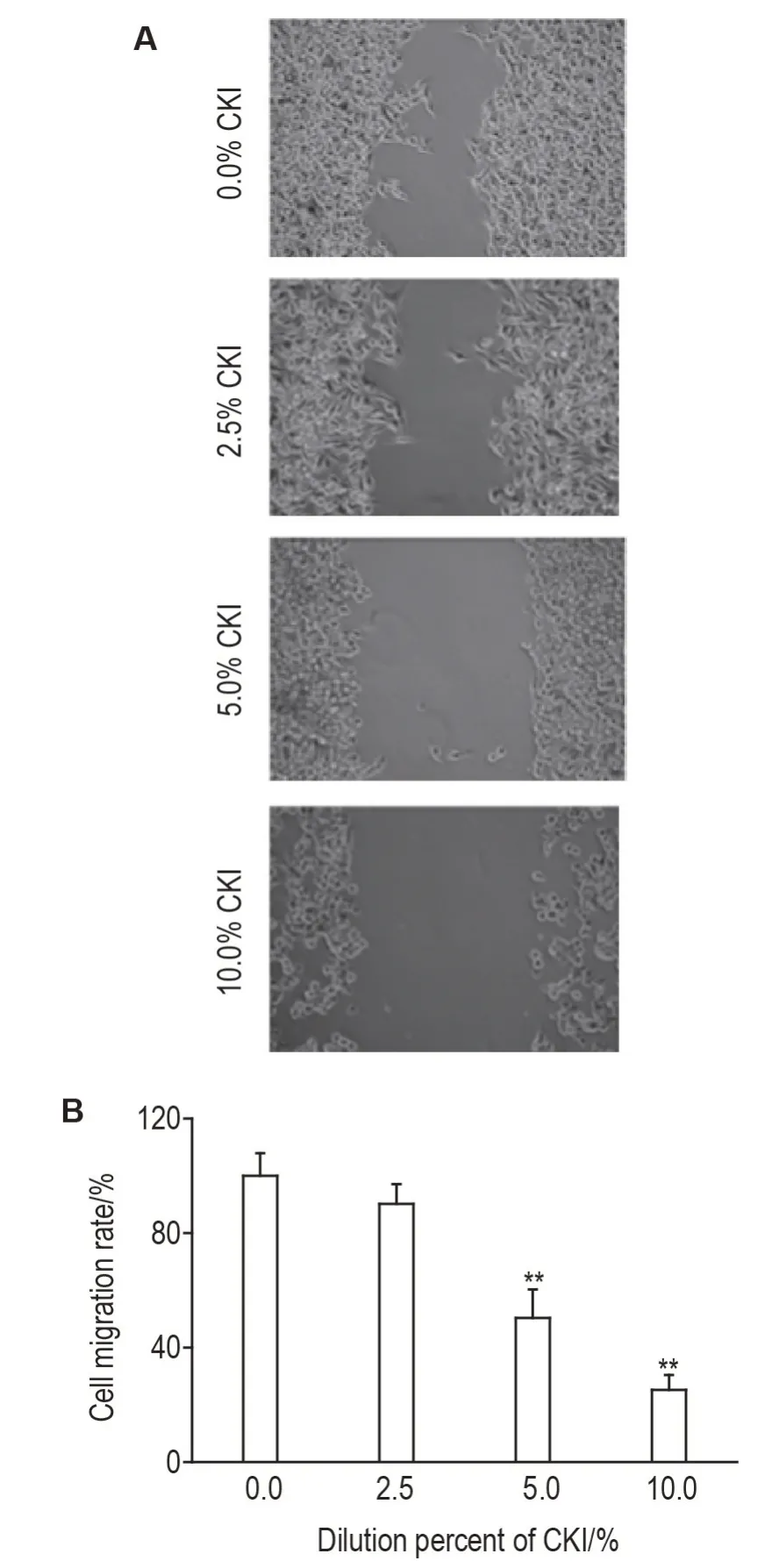
Fig.2 Effect of CKI on migration of SMMC-7221 cells in vitro by wound healing assay(×100).See Fig.1 for the cell treatment.B was the semi-quantitative result of A.Cell migration rate(%)=Experimental group wound area/control group wound area×100%.±s,n=3.**P<0.01,compared with 0.0%CKI group.
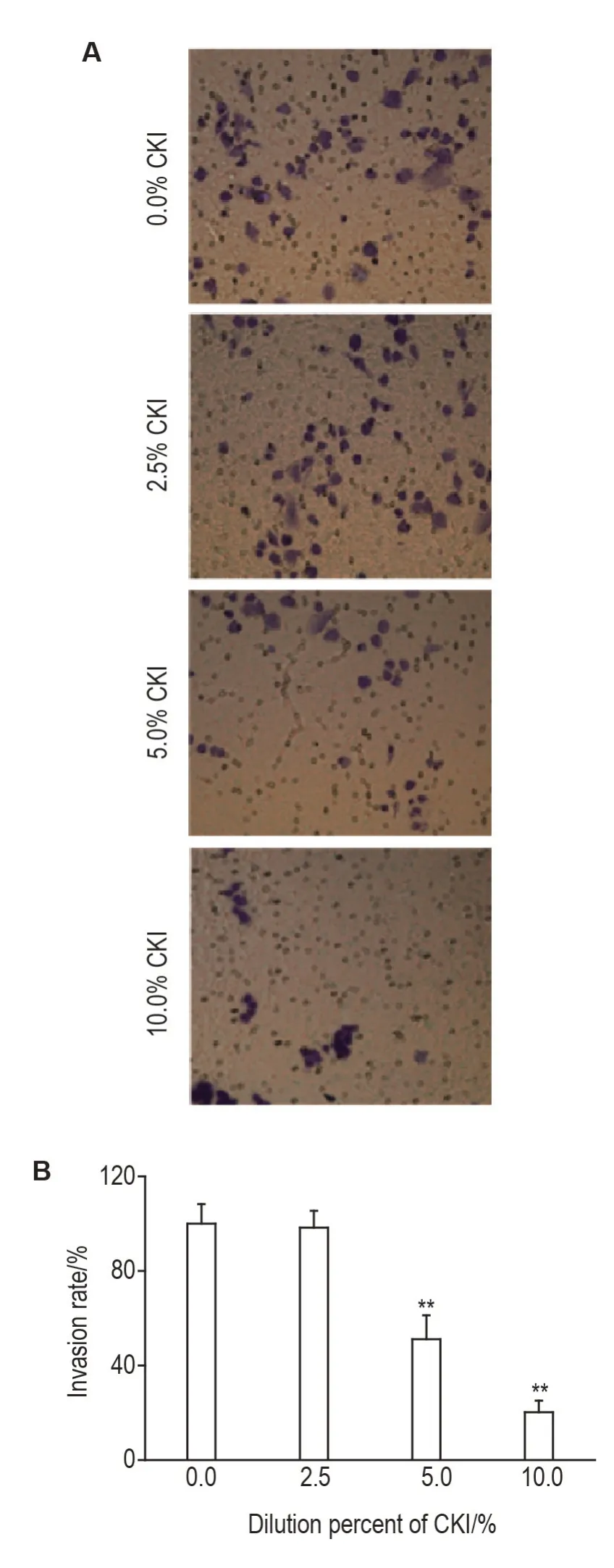
Fig.3 Effect of CKI on invasion of SMMC-7221 cells in vitro by transwell chamber assay(Giemsa staining,×100).See Fig.1 for the cell treatment.B was the semi-quantitative result of A.Invasion rate(%)=Experimental group invasion cell number/control group invasion cell number×100%.±s,n=3.**P<0.01,compared with 0.0%CKI group.
2.3 CKI对SMMC-7221细胞体外侵袭能力的影响
Transwell 实验结果显示(图3),SMMC-7221细胞经2.5%,5.0%和10.0%CKI处理24 h后,细胞侵袭率分别为(98±7)%,(51±10)%和(20±5)%。与细胞对照组(100±8)%相比,5.0%和10.0%CKI 组SMMC-7221 细胞体外侵袭能力显著降低(P<0.01)。
2.4 CKI 对SMMC-7221 细胞NF-κB mRNA 水平的影响
RT-PCR 结果(图4)表明,5.0%和10.0%CKI处理SMMC-7221细胞12 h后,细胞NF-κB mRNA水平分别降低至细胞对照组的(42±9)%和(46±10)%,差异均具有统计学意义(P<0.01)。
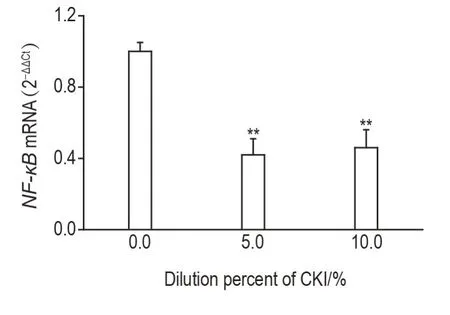
Fig.4 Effect of CKI on levels of NF-κB mRNA in SMMC-7221 cells by RT-PCR.SMMC-7221 cells were treated with CKI for 12 h.±s,n=3.**P<0.01,compared with 0.0%CKI group.
2.5 CKI 对SMMC-7221 细胞NF-κB 蛋白表达的影响
Western 印迹实验结果(图5)显示,与细胞对照组比,5.0%和10.0%CKI处理组SMMC-7221细胞NF-κB 蛋白表达分别降低至(67±16)%和(27±11)%,差异具有统计学意义(P<0.01)。
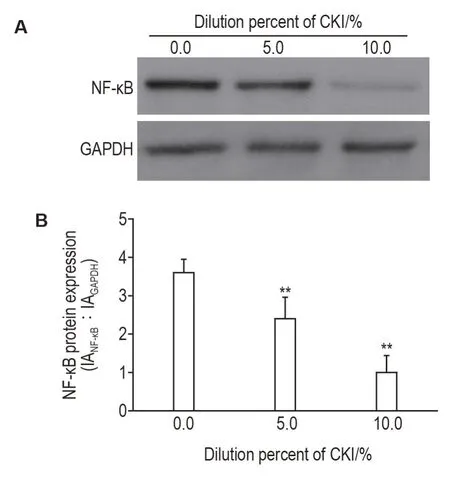
Fig.5 Effect of CKI on levels of NF-κB protein in SMMC-7221 cells by Western blotting.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.IA:integrated absorbance.±s,n=3.**P<0.01,compared with 0.0%CKI group.
3 讨论
本研究MTT 检测发现,CKI 对SMMC-7221 细胞存活率具有显著的抑制作用,且随CKI浓度增高,其对细胞存活的抑制作用增强。此结果与文献报道一致[4]。
肝癌细胞可发生血液和淋巴系统转移,而迁移和(或)侵袭是其导致患者死亡和预后不良的主要因素[11]。本研究中,细胞划痕修复实验和Transwell 实验结果发现,随着浓度的增加,CKI 显著抑制SMMC-7221细胞迁移和侵袭。提示CKI如果用于肝癌患者,可能会抑制肝癌细胞的迁移或侵袭。
CKI 中含有多种生物碱,已经分离出来的生物碱多达36 种,其中以苦参碱、氧化苦参碱、槐果碱、氧化槐果碱和槐定碱5种含量为高,本批次CKI中,含苦参碱2.579 g·L-1,氧化苦参碱8.515 g·L-1,槐果碱0.767 g·L-1,氧化槐果碱2.655 g·L-1,槐定碱1.094 g·L-1。苦参碱单体在U87神经胶质瘤细胞上发挥抗迁移和侵袭作用所需的浓度是0.1 g·L-1[12],氧化苦参碱单体在肝癌细胞上发挥抗迁移和侵袭作用需要的剂量是1.0 g·L-1[13]。目前研究认为,氧化槐果碱、槐果碱和槐定碱具有抑制肿瘤作用,但其是否具有抑制肿瘤转移的作用尚未见文献报道。由于苦参碱和氧化苦参碱能够在体内发生相互转化,因此推测,CKI发挥抑制SMMC-7221细胞迁移和侵袭能力的作用是苦参碱和氧化苦参碱的综合作用。
进一步机制研究表明,CKI 能够抑制SMMC-7221 细胞NF-κB mRNA 和蛋白表达水平。NF-κB是肝癌发生、生长和转移等的重要调控因子[14-15]。在人类肿瘤尤其是淋巴系统恶性肿瘤中常见NF-κB家族基因突变[16]。
综上所述,CKI具有明显的抑制SMMC-7221细胞增殖、迁移和侵袭能力,其机制可能与抑制NF-κB信号通路有关。本研究中体外实验所用CKI浓度较高,注射至动物体内后浓度会相应下降,可能难以达到起效所需的暴露浓度,后续我们将在荷瘤动物模型上进行药效实验的同时考察其瘤体内的暴露。本研究探讨了CKI体外抗肿瘤活性,其体内抗肿瘤效果是否与体外结果一致,还有待进一步研究。
