1,10-邻二氮杂菲双过氧钒酸钾对HT22细胞增殖和周期的影响
2019-10-09巴德仁贵田小莉鲍牧兰张晓璐崔钧贺许文强
巴德仁贵*,田小莉*,鲍牧兰,张晓璐,崔钧贺,许文强,苏 娇,邵 国,3
(1.包头医学院中心实验室生物医学研究中心,内蒙古 包头014010;2.内蒙古自治区低氧转化医学重点实验室,内蒙古包头014010;3.首都医科大学宣武医院低氧适应转化医学北京重点实验室,北京100053)
钒是自然界中分布极广的元素,其原子结构外层有未填充满的外电子层,所以性质极其活泼,常见化合物中有-3,-1,0,+1,+2,+3,+4和+5等不同的价态[1]。不同钒化合物因其具有多种生物活性而成为抗糖尿病、抗肿瘤、促进糖和脂类代谢等的潜在药物[2-3]。1,10-邻二氮杂菲双过氧钒酸钾〔potassium bisperoxo(1,10-phenanthroline)oxovanadate,BPV(phen)〕化合物中以V5+形式存在,是一种比较稳定的过氧钒酸盐,具有广泛的生物学活性,可作为一种特定的蛋白质酪氨酸磷酸酶(protein tyrosine phosphatase,PTP)抑制剂,抑制细胞周期以及改变神经递质释放[4-5],也可调节细胞增殖和分化,以及细胞内的信号转导。
研究报道,钒能够改变一些基因的DNA甲基化水平[6]。DNA 甲基化是在不改变DNA 序列的情况下进行基因的外部修饰,进而改变遗传表现,而DNA 甲基化主要是由DNA 甲基转移酶(DNA methyltransferases,DNMT)进行调节,DNA 甲基化能够改变基因构象和稳定性[7],又是基因表达的重要形式,由DNMT进行催化,而这类酶在大脑中含量非常丰富[8]。DNA 甲基化主要由DNMT 催化胞嘧啶残基5-C 位点,由于在高等脊椎动物中,胞嘧啶-磷酸-鸟嘌呤(5‘-C-phosphate-G-3’,CpG)不是随机分布,而是成簇分布,这种分布称为CpG 岛。DNMT 家 族含有3 个成员:DNMT1,DNMT3A 和DNMT3B,在配子形成、胚胎形成及体细胞组织发育过程中催化形成特异的基因组DNA 甲基化形式[9]。DNMT在调节细胞周期过程中也发挥重要的作用。研究发现,抑制DNMT表达可诱导细胞周期调节因子P21 的表达上调[10],P21 的增加可能是转化细胞诱导生长阻滞的关键因素[11]。
本研究采用小鼠海马神经元细胞系HT22细胞系探讨BPV(phen)对DNMT 表达和其下游基因的DNA甲基化水平的影响,阐明BPV(phen)对HT22细胞增殖影响的作用机制。
1 材料与方法
1.1 试剂和主要仪器
BPV(phen)(美国Alexis 公司),DMEM(美国Gibco公司),新生牛血清,胎牛血清(浙江天杭生物科技有限公司),CellTiter 96®AQueous细胞增殖试剂盒(美国Promega 公司),EpiQuik Nuclear Extraction试剂盒(美国Epigentek公司),青、链霉素(上海江莱生物科技有限公司),脱脂奶粉(内蒙古伊利乳业股份有限公司),二甲亚砜(DMSO)(上海阿拉丁生物科技有限公司),总RNA提取Trizol试剂盒,逆转录RT-PCR 试剂盒(美国Invitrogen 公司),实时荧光定量PCR试剂盒(南京博尔迪生物科技有限公司),RIPA 裂解液(强)(上海碧云天生物技术有限公司),BCA蛋白分析试剂盒(美国PIERCE 公司),免疫印迹法相关试剂(美国Sigma 公司),一抗:兔抗小鼠DNMT3A 和DNMT3B 多克隆抗体(美国Novus Biologicals公司),小鼠抗人肌动蛋白,DNMT1和P21 单克隆抗体(美国Sigma 公司),山羊抗小鼠、驴抗兔和辣根酶标记山羊抗兔IgG二抗(中杉金桥生物技术有限公司)。ABI 7900 real-time PCR仪(美国ABI公司),流式细胞仪(美国BD公司),激光共聚焦(日本Nikon 公司),倒置荧光显微镜(日本Nikon公司),电泳电转印设备(美国Bio-Rad公司),CO2培养箱(美国Thermo公司)。
1.2 细胞培养、分组处理和形态观察
HT22细胞购于中国协和医科大学分子肿瘤学国家重点实验室,培养于含10%胎牛血清、1%青霉素(100 kU·L-1)和链霉素(100 g·L-1)的DMEM 培养基,细胞置于CO2培养箱中培养。HT22细胞中分别加入BPV(phen)0.3 和3.0 μmol·L-1,另设溶剂(0.1%DMSO)对照组。37℃条件下5%CO2培养24 h后,应用倒置显微镜观察细胞形态变化。细胞培养基的pH 值为7,因为BPV(phen)在中性水溶液中比较稳定[1,12]。
1.3 MTS法检测细胞存活
HT22 细 胞 接 种 于96 孔 板,每 孔2000 细 胞,BPV(phen)0.3 和3.0 μmol·L-1或DMSO 处 理24 h。吸出培养基,每孔中加入含有MTS底物的新鲜培养基。37℃,5%CO2细胞培养箱中孵育3 h。每30 min检测1次。使用酶标仪检测490 nm的吸光度值(A490nm),计算细胞存活率。细胞存活率(%)=(处理组A490nm-空白孔A490nm)/(溶剂对照组A490nm-空白孔A490nm)×100%。
1.4 流式细胞术检测细胞周期
将细胞接种于6孔板中,当细胞长约80%时,用BPV(phen)0.3 和3.0 μmol·L-1或用0.1%DMSO(溶剂对照组)培养24 h,PBS 洗涤2 次,用0.5 mL的PBS 悬浮,再加入4.5 mL 70%乙醇固定过夜。800×g 离心5 min并收集细胞,加入0.5 mL 碘化丙啶(propidium iodide,PI)0.2 g·L-1、0.5 mL 0.1%TritonX-100 和2 μL(0.25 g·L-1)RNA 酶A,室温避光处理30 min。用FACScan流式细胞仪分析DNA含量,每个样本计数1×104个细胞,测量3 个复孔。使用ModFit 3.0程序分析细胞周期。
1.5 ELlSA法检测HT22细胞DNMT活力
HT22 细胞接种于6 孔板,每孔2000 细胞,BPV(phen)0.3 和3.0 μmol·L-1或0.1%DMSO 处理24 h。按照EpiQuik Nuclear Extraction 试剂盒说明提取HT22 细胞核蛋白。利用EpiQuik DNMT Activity/Inhibition Assay Ultra试剂盒检测总DNMT活力。甲基化DNA被5-甲基胞嘧啶抗体所识别,甲基化DNA 的数量与酶活力成正比,吸收波长为450 nm,比色法测定DNMT的活力。
1.6 实时荧光定量PCR 检测HT22 细胞p21 和DNMT mRNA的表达
将HT22 细胞接种于6 孔细胞培养板中进行培养,分为3 组,每组3 个重复孔,分别为DMSO 对照组、BPV(phen)0.3 和3.0 μmol·L-1组,处理24 h。取细胞进行胰酶消化,用PBS 溶液洗脱,800×g 离心5 min,去上清,收集细胞。用Trizol 法提取HT22细胞中总RNA,紫外分光光度计检测RNA纯度和含量,按照cDNA 合成试剂盒,逆转录总RNA合成cDNA。使用ABI 7900 系统中进行PCR 扩增反应。β 肌动蛋白基因作为内参,引物序列见表1。采用2-ΔΔCT表示基因的相对表达水平。
1.7 Western 印迹法检测HT22 细胞中P21 和DNMT蛋白表达
将HT22 细胞接种于6 孔细胞培养板中进行培养,分为3 组,每组3 个重复孔,分别为DMSO 对照组、BPV(phen)0.3和3.0 μmol·L-1组,处理24 h,细胞用PBS清洗,然后将放射免疫沉淀缓冲液(RIPA)加入细胞中置于冰上裂解10 min,采用BCA法测定蛋白含量,蛋白质通过10%SDS-PAGE 进行电泳分离并电转印到硝化纤维素膜上,用5%脱脂牛奶封闭液进行封闭室温孵育1 h,再用1×TBST 洗膜。分别加入目的蛋白对应的一抗〔DNMT3A(1∶1000)、DNMT3B(1∶1000)及β 肌动蛋白(1∶2000)、DNMT1(1∶1000)和P21(1∶1000)〕4℃摇床孵育过夜。去除一抗并清洗,加入山羊抗小鼠(1∶1000)和驴抗兔(1∶1000)二抗室温振荡孵育2 h。用电化学发光检测系统检测蛋白信号,利用Image J 软件测定蛋白条带积分吸光度值,用目标蛋白与内标蛋白条带积分吸光度值比值表示蛋白的相对表达量。

Tab.1 Sequence of primers
1.8 统计学分析
2 结果
2.1 BPV(phen)对HT22细胞形态的影响
DMSO对照组HT22细胞体积较大,折射效果较好,并且细胞膜边界清晰明亮(图1)。BPV(phen)0.3 μmol·L-1组细胞数量和形态学外观与对照组相比均无可见改变;3.0 μmol·L-1组细胞体积变大,核质浓缩,胞膜有小状形成。
2.2 BPV(phen)对HT22细胞存活的影响
MTS 实验结果显示,与DMSO 对照组相比,BPV(phen)0.3 μmol·L-1组细胞存活率无显著减少,3.0 μmol·L-1组细胞存活率显著降低(P<0.05)(图2)。
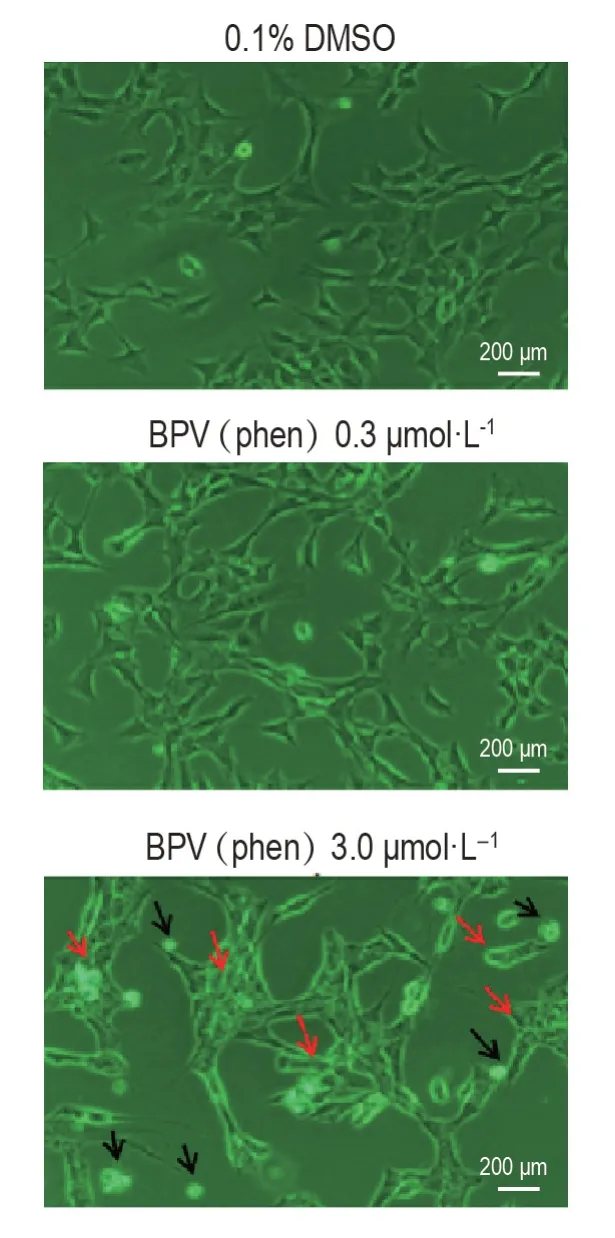
Fig.1 Effect of potassium bisperoxo(1,10-phenanthroline)oxovanadate〔BPV(phen)〕on morpholog of HT22 cells.Cells were treated with BPV(phen)0.3 and 3.0 μmol·L-1 for 24 h.Red arrows represent cells with altered morphology,black arrows refer to cell debris.
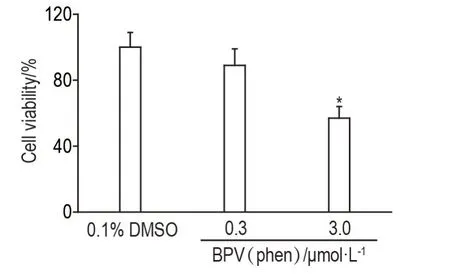
Fig.2 Effect of BPV(phen)on survival of HT22 cells.See Fig.1 for the cell treatment.±s,n=3.*P<0.05,compared with DMSO control group.
2.3 BPV(phen)对HT22 细胞周期的影响
如图3显示,与DMSO对照组相比,BPV(phen)0.3 μmol·L-1对细胞周期影响不显著,BPV(phen)3.0 μmol·L-1组S期细胞比例为(76.0±1.6)%,显著高于DMSO对照组(47.9±1.9)%(P<0.05),细胞阻滞在S期。
2.4 BPV(phen)对HT22 细胞DNMT活力的影响
与DMSO对照组相比,BPV(phen)0.3 μmol·L-1组细胞DNMT 活力变化无显著差异,3.0 μmol·L-1组细胞DNMT的活性显著增加(P<0.05)(表3)。
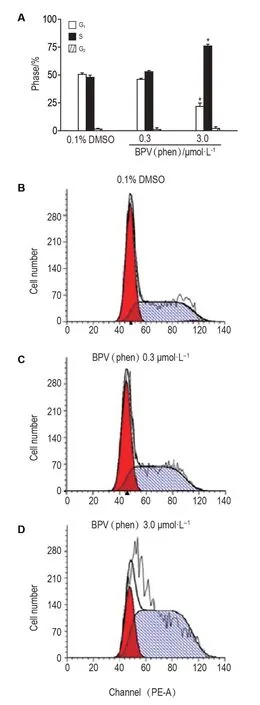
Fig.3 Effect of BPV(phen)on HT22 cell cycle observed by flow cytometry. See Fig.1 for the cell treatment.±s,n=3.*P<0.05,compared with DMSO control group.
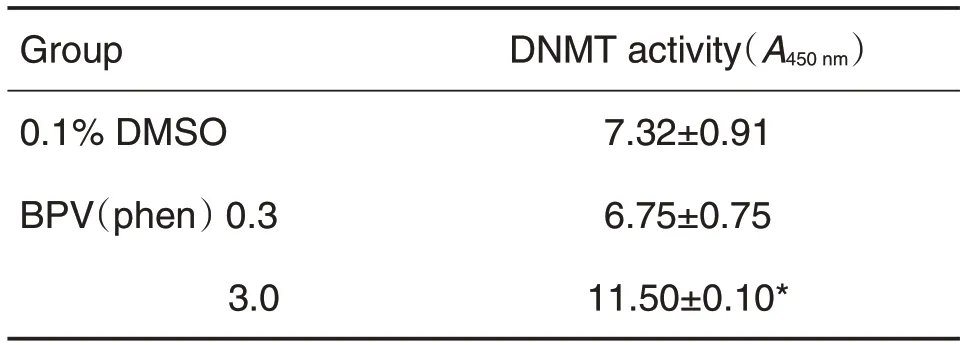
Tab.3 Effect of BPV(phen)on DNMT activity in HT22 cells
2.5 BPV(phen)对HT22细胞p21和DNMT mRNA表达水平的影响
HT22 细 胞 分 别 加 入BPV(phen)0.3 和3.0 μmol·L-1孵育24 h,检测结果显示,与DMSO对照相比,BPV(phen)0.3 μmol·L-1处理后,HT22 细胞内DNMT1,DNMT3A,DNMT3B和p21 mRNA表达无显著差异。BPV(phen)3.0 μmol·L-1组上述基因mRNA表达量显著增加(P<0.01,P<0.05;表4)。
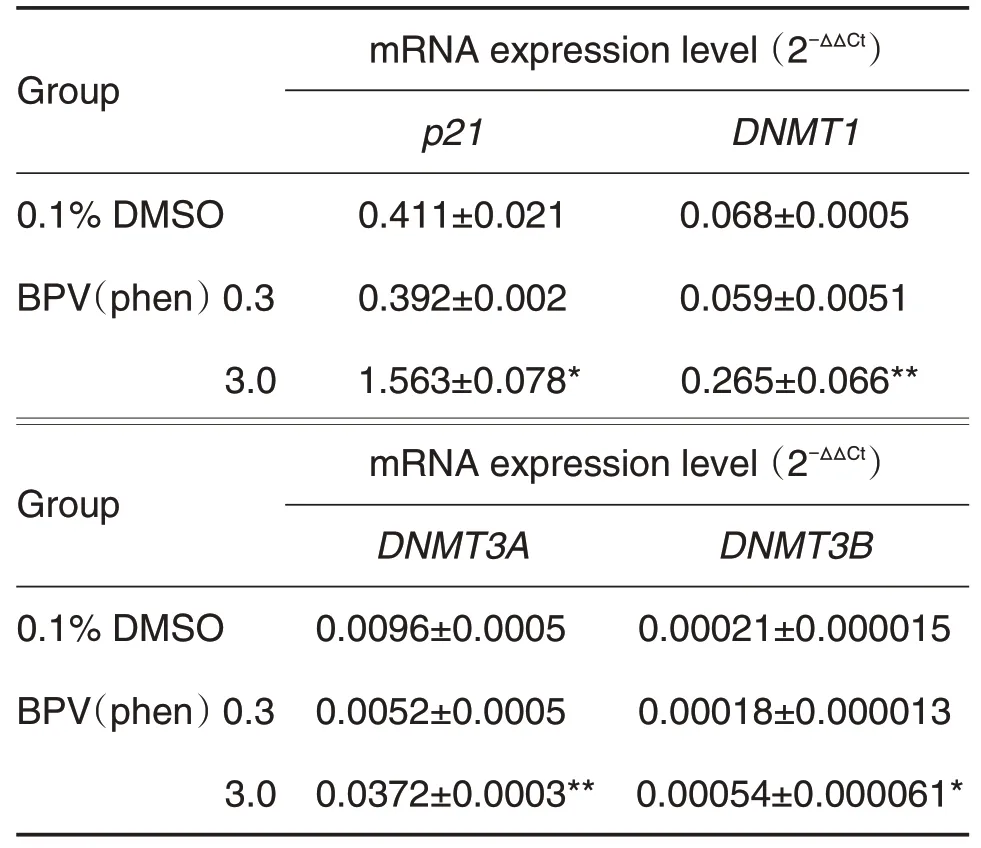
Tab.4 Effect of BPV(phen)on mRNA expressions of p21 and DNA methyltranserases(DNMTs)in HT22 cells
2.6 BPV(phen)对HT22 细胞P21 和DNMT 蛋白表达水平的影响
Western 印迹结果显示,与DMSO 对照组相比,BPV(phen)0.3 μmol·L-1对DNMT 和P21蛋白表达水平无显著影响,BPV(phen)3.0 μmol·L-1组DNMT3B 和P21 蛋白表达水平显著增加(P<0.05)(图4D~4E)。
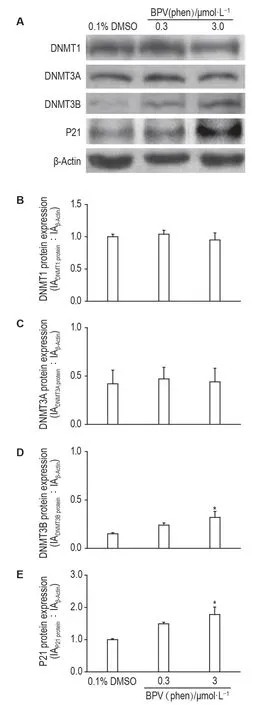
Fig.4 Effect of BPV(phen)on protein expressions of P21,DNMT1,DNMT3A and DNMT3B in HT22 cell observed by Western blotting.See Fig.1 for the cell treatment.±s,n=3.*P<0.05,compared with DMSO group.
3 讨论
本研究中,利用不同浓度的BPV(phen)处理HT22 细胞系,观察其对HT22细胞增殖的影响。结果发现,BPV(phen)0.3 μmol·L-1处理HT22细胞并不敏感,当浓度增加到3.0 μmol·L-1时,明显抑制细胞的增殖,细胞周期被阻滞在S 期。Cerovac 等[13]研究发现,BPV(phen)0.1 μmol·L-1对大鼠PC12细胞没有毒性作用,当BPV(phen)浓度低于10 μmol·L-1时,亦未导致PC12细胞的大量死亡,而浓度高于100 μmol·L-1时,PC12 细胞大量死亡,说明高浓度的BPV(phen)对PC12 细胞有毒性作用。本研究BPV(phen)3.0 μmol·L-1已经对HT22细胞产生了毒性作用,而PC12细胞对BPV(phen)10 μmol·L-1具有一定的耐受性,表明HT22 细胞相比PC12 细胞对BPV(phen)耐受性较弱。Faure等[4]研究发现,神经胶质瘤细胞经BPV(phen)处理后被阻滞在G2/M 期。P21 是细胞周期蛋白依赖性激酶抑制剂家族中的重要成员,P21 的表达在细胞生长阻滞中起重要作用[14]。
本研究发现,经BPV(phen)处理的TH22 细胞中P21 的mRNA 和蛋白质表达量均上调。有研究发现,P21基因启动子区域富含CpG岛,当DNMT蛋白水平下降时,p21基因启动子区甲基化水平降低,导致P21 基因和蛋白的表达增加[11]。BPV(phen)可能是通过改变DNMT 活力改变p21 基因CpG 岛区域的甲基化水平进而影响其表达。有研究报道称,经氧钒复合物处理后的细胞内会产生大量的活性氧(reactive oxygen species,ROS),ROS 引起DNA 的损伤,同时而ROS 能够诱导DNMT 的上调表达[15-16],DNMT 在调节细胞周期过程中发挥重要的作用,经纳米银粒子处理HT22细胞,发现细胞内的DNMT 的表达量升高,此时细胞被阻滞在G2/M期[17]。BPV(phen)可通过增加DNMT1,DNMT3A和DNMT3B基因和蛋白的表达水平进而影响HT22细胞的表观遗传。BPV(phen)通过影响DNMT的表达和活性调控细胞周期相关基因的表达进而调节细胞周期。而本研究中,经BPV(phen)3.0 μmol·L-1处理的HT22 中DNMT 基因表达量上升,P21 基因和蛋白的表达量均上调,由此推断,可能存在一种潜在的机制,P21 基因和蛋白表达量的上调可能受到BPV(phen)影响,而不是依赖DNMT表达下调引起。
综上所述,BPV(phen)0.3 μmol·L-1对细胞的增殖无显著影响,而BPV(phen)3.0 μmol·L-1调控DNMT 和p21 基因的表达,p21 的表达上调不受DNMT 表达影响,而是间接受BPV(phen)的影响。
