慢病毒携带增强型绿色荧光蛋白基因标记大鼠脂肪干细胞及体内示踪研究
2019-09-28张瑶瑶吴国民张潇毅肖艳菊王祥伸
张瑶瑶 吴国民 张潇毅 王 琳 肖艳菊 王祥伸 陈 楷
自2001年Zuk[1~3]首次在成体脂肪组织中分离培养出具有多向分化潜能的间充质干细胞以来,脂肪组织来源的间充质干细胞成为研究热点。脂肪干细胞取材方便、来源广泛,成为组织工程研究中较为理想的种子细胞[4]。在组织缺损修复研究中,脂肪干细胞广为应用,但脂肪干细胞在组织内的存活、迁移、分布、转归及生物学作用的发挥尚不清楚。因此,脂肪干细胞的示踪性研究逐渐成为干细胞研究的重点,找到一种稳定且不影响脂肪干细胞生物学特性的标记方法是本文研究的主要内容。
资料和方法
1.实验动物、试剂及仪器:健康雄性SD 大鼠,清洁级,体质量120~140g,实验动物许可证号:scXK-辽 -2015~0001。DMEM 培养液(Hyclone)、Ⅰ型胶原酶、0.25%胰蛋白酶、双抗、PBS、胎牛血清(BI)、病毒感染剂、携带EGFP 的慢病毒(上海吉凯基因有限公司)。地塞米松、吲哚美辛、IBMX、胰岛素、β-甘油磷酸、抗坏血酸、维甲酸(Sigma),转化生长因子βl(TGF-βl)(Peprotech),油红O 染色液、阿尔新蓝染色液(索莱宝生物试剂公司)、ALP 显色试剂盒、cck8 试剂盒(上海碧云天生物技术有限公司),CD90、CD34单抗,FITC标记抗体,EGFP一抗(Invitrogen),二抗试剂盒,DAB 显色试剂盒(中杉金桥)。生物安全柜(Thermo Scientific),荧光显微镜(Nikon,Japan),流式细胞仪(BD,USA)。
2.ADSCs 的分离和培养:大鼠脱颈处死,无菌条件下取腹股沟脂肪,剔除血管和筋膜。将脂肪组织剪碎,0.1% Ⅰ型胶原酶37℃水浴消化1h,每10min震荡一次。1500r/min 离心5min,弃上清,重悬,移入培养瓶内,于37℃,5% CO2饱和湿度条件下培养。24h 后首次换液,细胞生长至75%~90%融合时传代,每3d 更换培养液。
3.ADSCs 表面标志物检测:取第 3 代 ADSCs,用0.25%的胰蛋白酶消化,PBS 冲洗3 遍,100μL PBS重悬,分别加入CD90、CD34 单抗,4℃孵育30min,PBS 漂洗,加入 FITC 标记抗体,4℃避光孵育30min,1000r/min 离心 5min,PBS 漂洗。流式细胞仪检测细胞表面标记物的表达。
4.ADSCs 成骨、成脂、成软骨诱导:ADSCs 以 105个/孔接种于6 孔板中。24h 细胞贴壁后,换为成骨诱导液(DMEM、10%FBS、1%双抗、抗坏血酸50ug/ml、β-甘油磷酸钠10mM、地塞米松100nM)、成脂诱导液(DMEM、10%FBS、1%双抗、地塞米松1uM、吲哚美100uM、异丁基甲基黄嘌呤(IBMX)500uM、胰岛素辛 10ug/ml)、成软骨诱导液(DMEM、10%FBS、1%双抗、地塞米松 1uM、抗坏血酸50ug/ml、维甲酸 10-4uM、TGF-B110ug/L)诱导 14 天行碱性磷酸酶染色,21 天行油红O 染色,14 天行阿尔新蓝染色。
5.携带EGFP 基因的慢病毒转染ADSCs:取P3代脂肪干细胞以105/孔铺于6 孔板内,将EGFP 重组慢病毒颗粒按照 MOI=0、1、10、25、50、100 加入孔板内,每孔加入40ul 病毒感染试剂并用培养液定容至 1ml,MOI=0 为空白对照。感染 16h 后,PBS 洗3 次,加入完全培养液,每3d 更换培养液。
6.流式细胞仪分析阳性转染率:各转染组用0.25%胰蛋白酶消化,收集细胞,PBS 清洗离心2 次,重悬,200 目细胞筛过滤,调整细胞浓度为5×105/ml,取200ul 细胞悬液放入流式管内,测EGFP的表达率。
7.EGFP-ADSCs 增殖能力检测:以2000/孔的密度将细胞接种于孔内,每孔加入100ul 培养液,培养箱中培养。于 1、2、3、4、5、6、7 天测 OD 值。每孔加入10ul cck8 试剂,培养箱中培养 1h,450nm 酶标仪测吸光度值(A 值),绘制生长曲线。
8.EGFP-ADSCs 成骨、成脂、成软骨诱导:GFPADSCs 以 105个 /孔接种于 6 孔板中。24h 细胞贴壁后,换为成骨、成脂、成软骨诱导液,分别于14 天、21天、14 天行碱性磷酸酶、油红O、阿尔新蓝染色。
9.将标记细胞移植到大鼠体内:30 只SD 大鼠,随机分为实验组和对照组,每组15 只。0.25%胰蛋白酶消化EGFP-ADSCs,调整细胞悬液浓度为5×108/ml,将20ul 细胞悬液注入实验组大鼠皮下。对照组注射相同剂量的生理盐水。移植后1w,2w,4w 随机取实验组、对照组各5 只大鼠,取注射部位组织行冰冻切片荧光观察及EGFP 免疫组化染色。
结 果
1.ADSCs 分离培养及细胞形态观察:原代培养24h 见少量细胞贴壁,细胞呈多角形,大小不一。传代后细胞生长速度明显加快,2~3d 即可融合80%,细胞体积增大,长梭形,生长具有方向性(图1)。
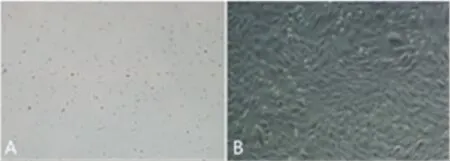
图1 A:P0 代脂肪干细胞;B:P3 代脂肪干细胞(× 10)
2.ADSCs 表面标志物检测结果:流式细胞术结果可见,ADSCs 表面标志显示CD90 呈阳性,CD34呈阴性(图2)。
3.ADSCs 成骨、成脂、成软骨多向诱导:成骨诱导2 周,细胞形态由长梭形变成多角形,碱性磷酸酶染色结果为阳性。成脂诱导21 天,细胞呈圆形,油红O 染色可见大量红染脂滴。成软骨诱导14 天,细胞形态不规则,大小不一。阿尔新蓝染色阳性,细胞和周围的基质染成蓝色(图3)。

图2 CD90 阳性表达,CD34 阴性表达
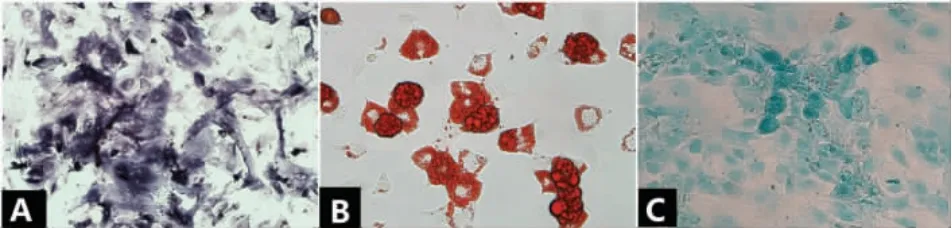
图3 ADSCs A1 碱性磷酸酶染色阳性( ×10),B1 油红o 染色阳性,C1 阿尔辛蓝染色阳性( ×40)
4.EGFP 转染率分析:EGFP 转染 96h 后可见明显绿色荧光。ADSCs 表达荧光的数量和强度与MOI呈正相关(图4)。经流式细胞仪检测,MOI 为 0、1、5、10、25、50 的转染效率为 0.12%、3.62%、42.4%、66.6%、90.4%、98.0%(图5)。

图4 EGFP 荧光表达

图5 流式细胞仪测转染组的转染率:MOI 为 0、1、5、10、25、50 的转染效率分别为0.12%、3.62%、42.4%、66.6%、90.4%、98.0%。
5.EGFP-ADSCs 增殖能力检测:转染组(MOI=25)与未转染组细胞生长情况无显著差别,呈典型的“S”形生长曲线,第1~2 天处于潜伏期,细胞生长缓慢,第3 天开始进入对数生长期,第7 天生长速度减慢(图6)。
6.EGFP-ADSCs 诱导分化能力:成骨诱导14天,成脂诱导21 天,成软骨诱导14 天,相应化学染色结果均为阳性。经多向诱导后,标记细胞依然有绿色荧光蛋白表达(图7)。
7.EGFP-ADSCs 体内观察:第 1w,2w,4w 观察到EGFP 发出的绿色荧光及EGFP 免疫组化阳性细胞,主要集中于移植部位(图8)。

图6 转染组(MOI=25)与未转染组(MOI=0)的生长曲线

图7 EGFP-ADSCs A1 碱性磷酸酶染色阳性( ×10),B1 油红o染色阳性,C1 阿尔辛蓝染色阳性( ×40).A2,B2,C2:成骨、成脂、成软骨诱导后EGFP 荧光表达。

图8 A:HE 染色( ×4),B:EGFP 荧光( ×10),C:EGFP 免疫组化( ×40),1:1w,2:2w,3:4w,4:空白对照。
讨 论
间充质干细胞是具有自我复制能力和多向分化潜能的成体干细胞,这种干细胞能够诱导分化成骨、软骨、脂肪和其他类型的细胞[5~7]。相比其他来源的干细胞,脂肪干细胞具有获取方式简单,相对容易分离,体外扩增能力强,跨胚层分化等优点[8~10]。体外培养的ADSCs 植入机体后能够向特定的组织分化,在损伤组织修复中发挥重要作用。ADSCs 在植入体内的存活、迁移、分布、转归等情况是损伤组织修复涉及到的关键问题。因此建立一种有效、稳定的标记ADSCs 的方法显得尤为重要。
经过大量实验研究证实,慢病毒携带增强型绿色荧光蛋白基因标记干细胞是一种较稳定且对干细胞生物学特性影响较小的标记方法。绿色荧光蛋白(GFP)是一种新型报告基因,不需要辅助因子,在蓝光激发下发出绿色荧光,对细胞无毒害,可直接用于活细胞测定[11]。EGFP 是优化突变型GFP,荧光强度是野生GFP 的几十倍,如果标记细胞死亡,胞质内的EGFP 会迅速扩展到周围组织并被降解掉,不会出现假阳性[12]。目前,常用的绿色荧光蛋白标记干细胞的方式有3 种:①质粒转染,操作简单,但是不能实现稳定转染[13]。②病毒转染,表达高效稳定,但可能存在致癌等隐患[14]。③绿色荧光蛋白转基因动物,虽然没有上述缺点,但是应用范围较局限,在小鼠中较为成熟[15],在稍大动物模型中应用较少。本实验应用慢病毒作为转染载体,慢病毒可将外源基因有效整合到宿主染色体中,以持久表达[16]。MOI 与细胞毒性成正比,因此需要优化MOI。为产生高效率表达EGFP 的标记细胞,追踪细胞在体内的存活、迁移、分化能力,我们采用携带EGFP 基因慢病毒载体以不同的MOI 转染大鼠ADSCs,挑选最适感染复数,并将标记后的细胞植入大鼠皮下,对标记细胞进行追踪分析,为探讨干细胞移植治疗作用提供依据。
通过本研究笔者认为携带增强型绿色荧光蛋白基因的慢病毒在体外能够长期有效的标记大鼠脂肪干细胞。
通过对EGFP 标记细胞体内追踪研究发现同种异体大鼠EGFP-ADSCs 注入皮下后,移植细胞主要分布于注射部位,EGFP 表达随时间逐渐减弱。本研究发现移植1w 移植处有炎症细胞浸润,提示局部有炎症反应,随着移植时间延长局部炎症反应有所减轻。虽有大量文献报道ADSCs 具有低免疫原性且有免疫调节作用,但并不能完全排除在同种异体大鼠体内植入ADSCs 不会发生免疫排异反应。笔者认为提高移植细胞体内存活率是干细胞移植治疗的关键,笔者将采用同种同体细胞植入进行下一步研究。
