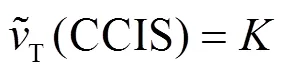HPO42–和H2PO4–对蒙脱石-胡敏酸胶体凝聚的影响
2019-09-26徐英德汪景宽李双异高晓丹
徐英德,汪景宽,李双异,高晓丹,2*
HPO42–和H2PO4–对蒙脱石-胡敏酸胶体凝聚的影响
徐英德1,汪景宽1,李双异1,高晓丹1,2*
(1.沈阳农业大学土地与环境学院,辽宁 沈阳 110866;2.西南大学资源与环境学院,重庆 400715)
为探究HPO42–和H2PO4–界面行为对土壤胶体凝聚的影响,以蒙脱石和胡敏酸胶体为研究对象,采用动态光散射技术比较研究HPO42–和H2PO4–引发胶体颗粒凝聚过程的差异.结果表明,随着电解质离子强度的升高,HPO42–和H2PO4–体系蒙脱石-胡敏酸混合悬液从慢速凝聚(线性增长)转化为快速凝聚(幂函数增长),但胶体凝聚过程对H2PO4–体系离子强度的变化更敏感.HPO42–和H2PO4–作用下凝聚体有效粒径增长、总体平均凝聚速率(TAA)、临界聚沉离子强度(CCIS)和活化能均存在明显差异;其中,与HPO42–相比,H2PO4–体系中拥有更高的TAA、更低的CCIS和活化能,说明H2PO4–离子引发蒙脱石-胡敏酸混合胶体凝聚的作用更强,HPO42–体系中CCIS是H2PO4–中的2.43倍.HPO42–和H2PO4–体系中离子特异性效应的差异(活化能差值)随离子强度的降低而增大,主要由强电场中离子非经典极化作用引发.胡敏酸的添加明显增加了HPO42–体系中胶体的CCIS和活化能,而对H2PO4–体系未产生明显影响;HPO42–和H2PO4–离子特异性效应的强弱在不同比例蒙脱石/胡敏酸体系中表现为96%蒙脱石+4%胡敏酸>>99%蒙脱石+1%胡敏酸>100%蒙脱石.以上结果表明HPO42–和H2PO4–对蒙脱石-胡敏酸混合胶体的凝聚存在强烈的离子特异性效应,胶体表面附近电场强度直接影响该效应的强弱.
土壤胶体;蒙脱石;胡敏酸;离子特异性效应;活化能;阴离子
土壤胶体是土壤的肥力和生态功能实现的基础[1-2],其凝聚过程能够保蓄养分、降低土壤颗粒随水迁移,控制土壤侵蚀和农业面源污染的发生,具有深刻的环境学意义[3-7].磷是植物生长必需的养分元素,但磷肥的过量投入造成了磷的入渗、迁移和水体富营养化等环境问题[8-9].据报道,磷酸盐在被土壤胶体颗粒吸附后可使土壤组分的表面性质发生变化,从而影响磷素的可利用性、污染物的迁移和毒性[10].因此,从介观尺度明确土壤中不同磷酸根离子对土壤胶体凝聚动力学的影响对提高磷的有效性、防止水土流失和减少磷肥的环境风险意义重大.
土壤胶体带有净负电荷,通常认为阴离子会受到土壤胶体较大的排斥作用,无法依靠静电作用而吸附到土壤胶体表面.但事实证明,即使是带负电的土壤胶体,表面也具有一定的阴离子吸附位点[11-12].对于带有强烈肥力和环境属性的HPO42–和H2PO4–,二者离子半径较大,外层电子存在强烈的量子涨落效应[13].那么,在具有强大电场的土壤矿物(蒙脱石)和有机质(胡敏酸)体系中,阴离子是否能借助热运动等外力穿过双电层到达胶体颗粒表面从而影响土壤胶体的凝聚过程?不同阴离子对凝聚过程影响的差异及产生的原因是什么?这些问题均亟待解决.
基于以上考虑,本研究以蒙脱石和不同胡敏酸添加量的蒙脱石-胡敏酸混合胶体为研究对象,采用动态光散射技术,动态监测不同离子强度的K2HPO4和KH2PO4电解质添加后胶体颗粒的凝聚动力学过程,明晰两种伴随阴离子界面行为对蒙脱石-胡敏酸混合胶体颗粒凝聚过程的影响机制,为土壤改良、培肥地力和防治面源污染提供理论依据.
1 材料与方法
1.1 供试材料
蒙脱石胶体制备采用静水沉降虹吸法[14].主要过程如下:称取50.0g蒙脱石粉末(物华天宝矿物有限公司,内蒙古)于500mL烧杯中,加入500mL超纯水,搅拌均匀,并用0.5mol/L的KOH溶液将悬液的pH值调至(7.5±0.1),同时可将蒙脱石表面阳离子全部替换为K+.用探针型超声波细胞破碎仪对样品进行处理,超声分散15min后转移到5000mL的沉降桶中并加超纯水直至刻度线.根据Stokes定律计算出<200nm粒径的胶体颗粒沉降10cm所需要的时间,根据此时间,反复提取出样品中所有的该粒径范围的胶体,直至悬液清亮.收集吸出的胶体悬液,测定体系pH=6.89,近中性;烘干法测其颗粒密度为1.88g/L.蒙脱石表面性质通过Low[15]和Liu[16]提出的物质表面参数联合测定法测得,阳离子交换量(CEC)为84.80cmol+/kg,比表面积()为716m2/g,表面电荷密度()为0.11C/m2.

图1 不同胶体颗粒的初始粒径分布
按照国际胡敏酸协会(IHSS)的标准方法[17]和Pollo法[18]分离提取土壤胡敏酸样品.主要步骤如下:将采集的土壤样品风干后过1mm筛,称取500g风干土于5000mL烧杯中,按土水比1:5加入超纯水,充分搅拌浮出细根,弃上清液.加入0.1mol/L NaOH与0.1mol/L Na4P2O7的混合溶液2.5L,用强力电动搅拌机搅拌4h,静置20h后虹吸出上部黑棕色悬液置于烧杯中备用.再加入NaOH和Na4P2O7混合溶液1L,搅拌,静置,重复提取3次,虹吸出的黑棕色悬液收集于上述的大烧杯中.将全部浸提出的黑棕色悬液以2000r/min的速度离心10min,去除细小土粒等杂质后,加入1:1盐酸调节溶液的pH值在1.0~1.5之间,60~70ºC恒温培养箱保温1~2h,静置过夜.次日会出现胡敏酸凝胶层,弃去上清液.然后将胡敏酸沉淀重新溶解于少量体积0.1mol/L KOH和0.3mol/L KCl的混合溶液中,并在氮气的保护下以7000r/min的速度离心20min,以去除其中含有的杂质.用HCl和KOH酸碱反复溶解沉淀4次,并收集所有的胡敏酸沉淀.用超纯水洗3次后移入1L容量瓶中定容.用烘干法[20]测定其颗粒密度为7.10g/L.探针型超声波处理器20kHz振动分散15min,室温下平衡24h.稀释5倍备用.在室温下用0.1mol/L KOH调节pH=7,用探针型超声波处理器在20kHz频率下振动分散15min,备用.此时胡敏酸胶体表面可交换离子均被K+替换,为K+饱和表面.胡敏酸胶体CEC为434cmol/ kg,=644m2/g,计算得=0.65C/m2.
通过上述提取、纯化和表面处理,确保蒙脱石和胡敏酸表面被K+饱和.本试验研究对象包括100%蒙脱石体系以及质量比为99:1和96:4的蒙脱石+胡敏酸混合胶体体系.不同处理初始粒径分布情况如图1所示.其中100%蒙脱石体系有效水力直径分布为87.81~507.36nm,集中分布于178.85~249.11nm,平均有效粒径为211.08nm;99%蒙脱石+1%胡敏酸体系有效水力直径分布为86.00~515.31nm,集中分布于177.75~249.30nm,平均有效粒径为210.51nm;96%蒙脱石+4%胡敏酸体系有效水力直径分布为76.41~ 489.12nm,集中分布于162.22~230.37nm,平均有效粒径为199.40nm.
1.2 蒙脱石-胡敏酸胶体凝聚实验
分别取不同配比的混合胶体悬液200μL于散射瓶中,加超纯水和不同体积的K2HPO4、KH2PO4溶液使得体系总体积为10mL.供试的蒙脱石-胡敏酸胶体经过K+纯化表面处理,并选取2种磷酸根的钾盐可确保体系中的阳离子均为K+,以便研究不同的阴离子对胶体凝聚过程的影响.由于HPO42–和H2PO4–两种离子的电离、水解程度不同,通常K2HPO4溶液呈碱性,KH2PO4溶液呈酸性.设置的K2HPO4电解质离子强度为30~600mmol/L范围内不同梯度;设置的KH2PO4离子强度为50~ 275mmol/L范围内不同梯度.离子强度(,mmol/L)计算公式如下:
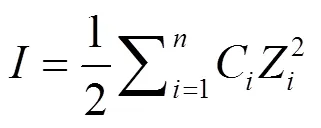
式中:C是离子的物质的量浓度,mmol/L;Z是离子所带的电荷数.具体所设置的浓度梯度和体系pH值见表1.
蒙脱石-胡敏酸胶体待测悬液配置完成后,通过广角度激光光散射仪(BI-200SM, Brookhaven,美国)进行胶体凝聚动力学试验.主要操作步骤如下[11]:打开激光器预热25min,并用温控器将体系温度控制在25ºC.将激光光散射仪的散射角度设置为90°.实验前将电解质、胶体样品和超纯水均平衡至25ºC.将充分摇匀后的散射瓶放入样品池30s后开始记录数据,每隔30s记录一次有效水力直径的大小.每次检测时间为60min.此外,每24h检测一次原始样品粒径分布情况,确保样品在开展实验期间体系处于分散的稳定状态.
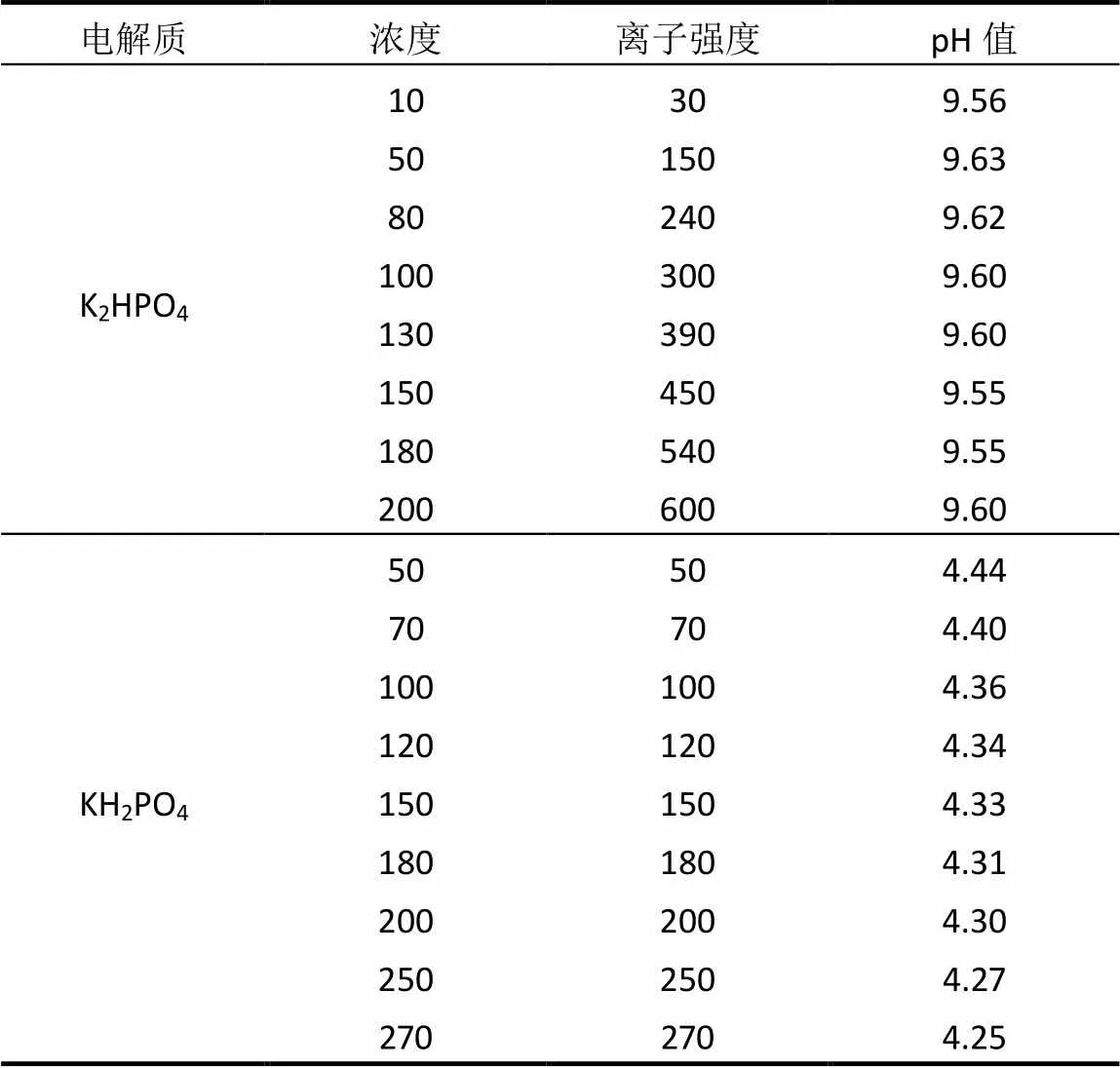
表1 凝聚实验所设置的不同电解质的浓度梯度及对应的pH值
1.3 临界聚沉离子强度的计算
临界聚沉离子强度(CCIS)为发生慢速凝聚向快速凝聚转折的最低电解质离子强度.根据Jia等[19]建立的方法获得各体系的总体平均凝聚速率(TAA)和CCIS.
TAA的计算方法:将动态光散射所测得的有效粒径大小随时间的变化关系做散点图,并得出拟合方程.将复合体的有效直径大小对凝聚时间求导,即可得到凝聚速率随时间的变化[()~],进而可以求得一定时间段内其粒径增长的平均速率.计算公式如下:

1.4 颗粒间相互作用活化能的测定方法
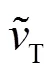
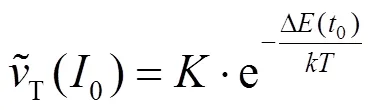
式中:Δ(0)为活化能,J/mol;是Botzmann常数, (J/K);为绝对温度,K;为常数.由于0=CCIS时Δ(0)=0,所以有: