低管电压CT血管成像技术对颅内微小动脉瘤的诊断价值研究*
2019-09-26王延岗张翠兰王俊义张书芹贠红雨
王延岗 张翠兰 王俊义 张书芹 贠红雨
颅内动脉瘤是指脑动脉壁的异常膨出部分,也是导致蛛网膜下腔自发出血的首要因素之一[1].颅内动脉瘤大部分为先天性动脉瘤,高发年龄为30~60岁,其中约有80%的颅内动脉瘤发生于颅底动脉环前半部.一般直径<0.5 cm者为小动脉瘤,而<0.3 cm者为微小动脉瘤.动脉瘤破裂可引发蛛网膜下腔出血,且起病急,可出现脑膜刺激征、精神失常、意识障碍、剧烈头痛和恶心呕吐[2].
目前,CT血管造影(computed tomography angiography,CTA)因其准确、快捷、方便、无创等优越性,已成为颅内动脉瘤破裂的首选检查方式,但CT检查具有一定的辐射性,而CT血管造影检查的应用剂量及是否对图像质量产生影响已成为医学热点研究课题.本研究探析最大径(≤3 mm)的颅内微小动脉瘤进行低管电压CT血管成像技术检查的诊断价值.
1 资料与方法
1.1 一般资料
选取2016年4月至2018年6月在邯郸明仁医院就诊的130例颅内微小动脉瘤患者,其中男性76例,女性54例;年龄34~56岁,平均年龄(46.3±1.5)岁;动脉瘤最大径均≤3 mm;吸烟史60例,合并高血压96例.所有入组患者均进行CTA检查,根据CTA管电压不同将其分为常规管电压组(64例)和低管电压组(66例).常规管电压组中男性40例,女性24例;年龄34~56岁,平均年龄(46.4±1.6)岁;吸烟史32例,合并高血压50例.低管电压组中男性36例,女性30例;年龄34~56岁,平均年龄(46.7±1.4)岁;吸烟史28例,合并高血压46例.本研究经医院医学伦理委员会审核通过,所有患者均签署知情同意书.两组的平均年龄、性别、吸烟史、合并高血压等基本资料比较无差异,具有可比性.
1.2 纳入与排除标准
(1)纳入标准:①符合世界卫生组织制定的颅内动脉瘤的诊断标准[3];②经急诊CTA检查确诊;③经旋转采集三维数字减影血管造影(3-dimension digital subtraction angiography,3D-DSA)检查证实为直径<3 mm的微小动脉瘤患者.
(2)排除标准:①不愿参加本次研究;②同时参与其他研究.
1.3 仪器与药物
采用Optima 680型CT扫描仪(美国GE公司);IGS 330型血管造影机(DSA)(美国GE公司).碘帕醇注射液(上海博莱科信谊药业有限责任公司;国药准字:H20053388).
1.4 检查方法
(1)患者取仰卧位,予以20 G留置针穿刺肘前静脉穿刺埋置.高压注射非离子型对比剂碘帕醇(370 mg I/ml),4.5 ml/s速率,80~90 ml剂量,对比剂注射后22~24 s开始扫描,检查范围为颅顶至枕大孔.常规管电压组的管电压为120 kV,低管电压组的管电压为100 kV,其他扫描参数设置相同,层间距5.0 mm,层厚5.0 mm,旋转时间0.6 s,准直器64 mmX0.625 mm,管电流380 mA,矩阵512X512,视野25 cm,螺距0.98,重建间隔0.625 mm,重建层厚0.625 mm.在AW4.6工作站传输CTA数据,予以最大密度投影(maximal intensity projection,MIP)、多平面重建(multi-planar-reformatting,MPR)、容积再现(volume rendering,VR)等处理.
(2)3D-DSA检查方法.局麻下对股动脉进行穿刺、插管,予以常规正侧位椎动脉和颈内动脉2D-DSA,予以注射370 mg I/ml非离子型对比剂碘帕醇,椎动脉总量为7 ml,速率为4 ml/s,颈总动脉总量为8 ml,速率为l5 ml/s.
(3)以长轴为中心予以旋转采集数字血管造影(digital Angiography,DA).设置参数:旋转速度为550°/s,旋转角度为0~240°,采集速度为30帧/s,采集图像矩阵为1024X1024;重建图像矩阵为256X256,曝光延迟为2 s;注射对比剂量:椎动脉总量为12 ml,速率为3 ml/s;颈总动脉总量为25 ml,速率为5 ml/s.旋转采集DA图像数据传输至工作站重建,获得表面遮盖显示(surface shaded display,SSD)、容积再现显示(volume rendered display,VRD).
(4)测量CT值.横断面图像测量大脑后动脉(posterior cerebral artery,PCA)、大脑中动脉(middle cerebral artery,MCA)、大脑前动脉(anterior cerebral artery,ACA)、颈内动脉颅内段(internal carotid artery,ICA)、基底动脉(basilar artery,BA),均检测3次,血管CT值为3次测量的平均值.测量3次左右枕叶脑实质(occipital lobe parenchyma,OLP)CT值,取平均值.计算CT辐射剂量,剂量长度乘积(dose length product,DLP)、CT剂量容积指数(volume CT dose index,CTDIvol),有效剂量(effective dose,ED),ED=DLPXk,k值为组织权重因子.计算图像信号噪声比(signal to noise ratio,SNR)及图像对比噪声比(contrast to noise ratio,CNR).
1.5 观察指标
比较两组ED、DLP、扫描长度等CTA辐射剂量指标;比较两组不同部位动脉的CT值和脑实质、血管的CT差值;比较两组不同部位动脉的图像信号SNR和CNR.
1.6 统计学方法
采用SPSS20.0软件系统处理分析,计量资料呈正态分布,采用均值±标准差(±s))表示,组间比较采用独立样本t检验,以P<0.05为差异有统计学意义.
2 结果
2.1 两组辐射剂量评估比较
低管电压组ED和DLP的CTA辐射剂量指标显著低于常规管电压组,差异有统计学意义(t=9.024,t=17.846;P<0.05),两组的扫描长度比较差异无统计学意义(t=0.765,P>0.05),见表1.
表1 两组CTA检查患者辐射剂量的评估比较(±s))
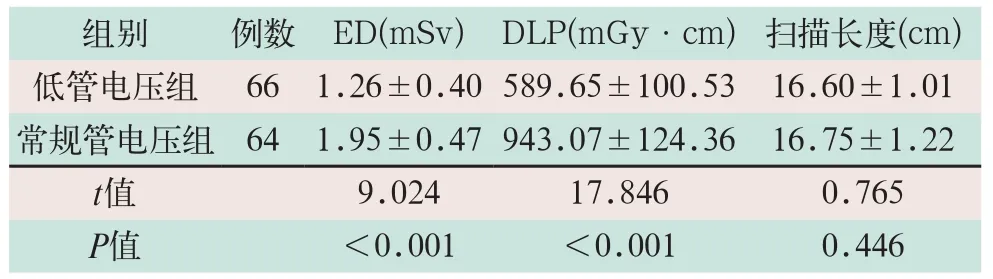
表1 两组CTA检查患者辐射剂量的评估比较(±s))
注:表中ED为有效剂量;DLP为剂量长度乘积
组别 例数 ED(mSv)DLP(mGy.cm)扫描长度(cm)低管电压组 66 1.26±0.40 589.65±100.53 16.60±1.01常规管电压组 64 1.95±0.47 943.07±124.36 16.75±1.22 t值 9.024 17.846 0.765 P值 <0.001 <0.001 0.446
2.2 两组不同部位血管及脑实质CT值比较
两组不同部位血管、脑实质CT值比较中,低管电压组的PCA、MCA、ACA、ICA及BA部位的CT值、脑实质和血管的CT差值显著高于常规管电压组,差异有统计学意义(t=5.812,t=4.928,t=5.628,t=5.918,t=5.219;P<0.05),见表2.
表2 两组CTA检查患者不同部位的血管及脑实质CT值比较(HU,±s))
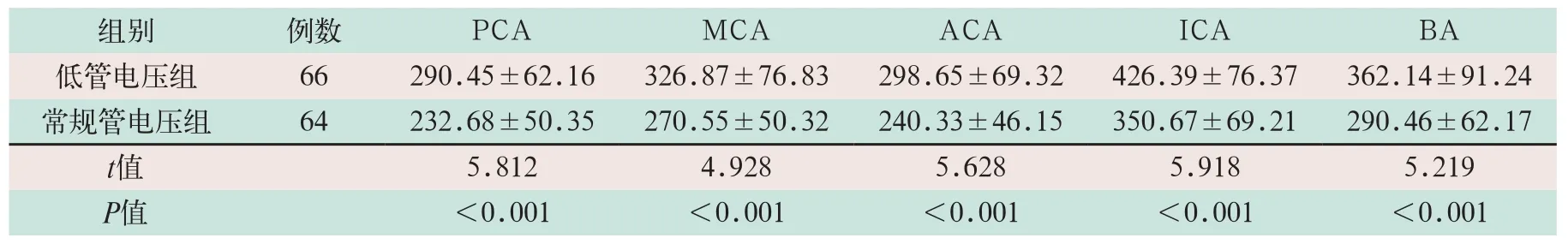
表2 两组CTA检查患者不同部位的血管及脑实质CT值比较(HU,±s))
注:表中PCA为大脑后动脉;MCA为大脑中动脉;ACA为大脑前动脉;ICA为颈内动脉颅内段;BA为基底动脉
组别 例数 PCA MCA ACA ICA BA低管电压组 66 290.45±62.16 326.87±76.83 298.65±69.32 426.39±76.37 362.14±91.24常规管电压组 64 232.68±50.35 270.55±50.32 240.33±46.15 350.67±69.21 290.46±62.17 t值 5.812 4.928 5.628 5.918 5.219 P值 <0.001 <0.001 <0.001 <0.001 <0.001
2.3 两组不同部位血管及脑实质CT差值比较
两组不同部位血管、脑实质CT值比较中,低管电压组的PCA、MCA、ACA、ICA及BA部位的脑实质和血管CT差值显著高于常规管电压组,差异有统计学意义(t=4.920,t=4.850,t=5.203,t=6.929,t=3.647;P<0.05),见表3.
表3 两组CTA检查患者不同部位的血管及脑实质CT差值的评估比较(HU,±s))
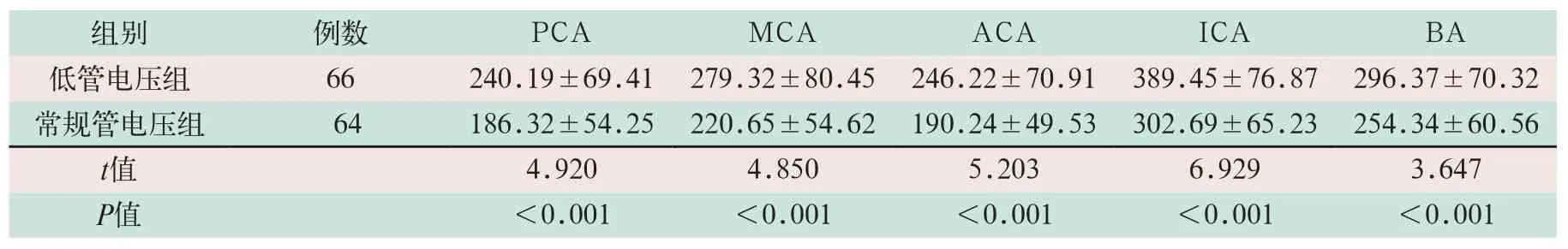
表3 两组CTA检查患者不同部位的血管及脑实质CT差值的评估比较(HU,±s))
注:表中PCA为大脑后动脉;MCA为大脑中动脉;ACA为大脑前动脉;ICA为颈内动脉颅内段;BA为基底动脉
组别 例数 PCA MCA ACA ICA BA低管电压组 66 240.19±69.41 279.32±80.45 246.22±70.91 389.45±76.87 296.37±70.32常规管电压组 64 186.32±54.25 220.65±54.62 190.24±49.53 302.69±65.23 254.34±60.56 t值 4.920 4.850 5.203 6.929 3.647 P值 <0.001 <0.001 <0.001 <0.001 <0.001
2.4 两组不同部位动脉图像信号SNR及CNR比较
两组不同部位动脉的图像信号SNR及CNR比较,差异均无统计学意义,见表4、表5.
表4 两组CTA检查患者不同部位的动脉图像信号SNR比较(±s))
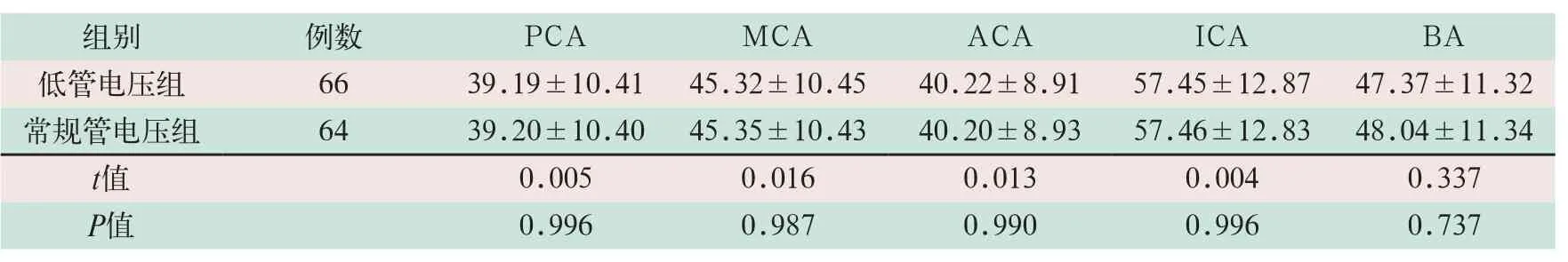
表4 两组CTA检查患者不同部位的动脉图像信号SNR比较(±s))
注:表中PCA为大脑后动脉;MCA为大脑中动脉;ACA为大脑前动脉;ICA为颈内动脉颅内段;BA为基底动脉
组别 例数 PCA MCA ACA ICA BA低管电压组 66 39.19±10.41 45.32±10.45 40.22±8.91 57.45±12.87 47.37±11.32常规管电压组 64 39.20±10.40 45.35±10.43 40.20±8.93 57.46±12.83 48.04±11.34 t值 0.005 0.016 0.013 0.004 0.337 P值 0.996 0.987 0.990 0.996 0.737
表5 两组CTA检查患者不同部位的图像信号CNR比较(±s))
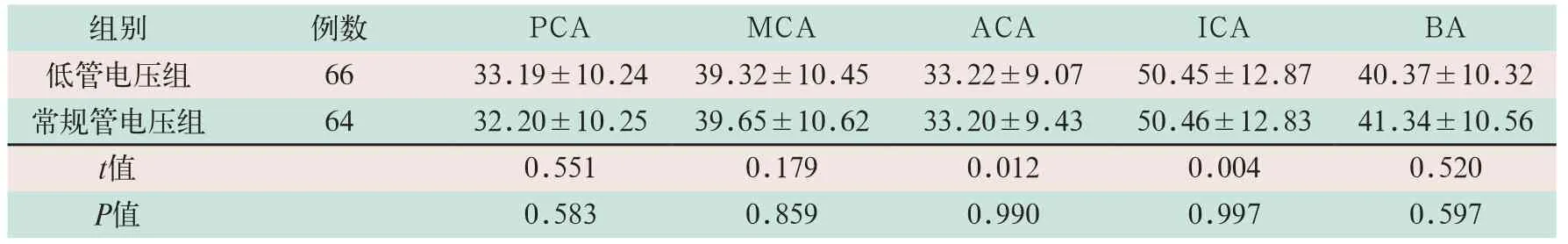
表5 两组CTA检查患者不同部位的图像信号CNR比较(±s))
注:表中PCA为大脑后动脉;MCA为大脑中动脉;ACA为大脑前动脉;ICA为颈内动脉颅内段;BA为基底动脉
组别 例数 PCA MCA ACA ICA BA低管电压组 66 33.19±10.24 39.32±10.45 33.22±9.07 50.45±12.87 40.37±10.32常规管电压组 64 32.20±10.25 39.65±10.62 33.20±9.43 50.46±12.83 41.34±10.56 t值 0.551 0.179 0.012 0.004 0.520 P值 0.583 0.859 0.990 0.997 0.597
3 讨论
颅内动脉瘤破裂是蛛网膜下腔出血最常见的原因,破裂后的出血、迟发性脑血管痉挛以及再破裂出血是导致患者死亡和致残的主要因素[4].对于动脉瘤的早期确诊及破裂风险预测评估,针对高风险动脉瘤给予预防性治疗,对于挽救患者生命安全,减少动脉瘤患者死亡及致残率具有重要价值[5].DSA被认为是诊断颅内动脉瘤的"金标准",但属于有创检查,且费用较高耗时较长,用于颅内动脉瘤的初查或随访患者及家属的接受度较差,因此,无创性影像检查越来越受到临床的关注[6-7].
近年来,快速的CTA及无创性的磁共振血管成像在颅内动脉瘤诊断中的价值逐渐被认可,在临床上得到广泛应用.但国内尚未见有关CTA与MRA用于不同部位颅内动脉瘤的报道[8].颅内动脉瘤CT检查可见蛛网膜下腔、脑池或脑室内出血,前交通动脉瘤,在鞍上池积血较多;后交通动脉瘤与大脑中动脉侧裂段动脉瘤则侧裂池积血较多,某些可伴有血肿.同时随着手术和介入治疗技术的进步,动脉瘤的治疗效果也得到了明显提高,但是对于直径≤3 mm的动脉瘤应用CTA检查的管电压的减低对图像质量是否产生影响,颅内微小动脉瘤是否需要进行预防性治疗还存在很多争议[9-10].
本研究探析最大径(≤3 mm)的颅内微小动脉瘤,进行低管电压CT血管成像技术检查的诊断价值,结果显示,低管电压组的ED、DLP等CTA辐射剂量指标显著低于常规管电压组,差异有统计学意义,两组的扫描长度比较无统计学差异;低管电压组的PCA、MCA、ACA、ICA、BA等部位的CT值、脑实质和血管的CT差值显著高于常规管电压组,差异有统计学意义.两组不同部位动脉的图像信号SNR、CNR比较差异无统计学意义,与齐星亮等[11]的研究结果基本一致.颅内动脉瘤进行CTA检查快捷简便,灵敏度型更高,可对颅脑血管的三维结构清晰监测,同时可清晰显示瘤体钙化、动脉瘤的体积和临近组织的关系及形态等,对于瘤体直径<3 mm者可清晰显示[12-13].
本研究发现,管电压等幅度降低可极大降低辐射剂量,在管电流相同的情况下,100 kV低管电压扫描获得图像信号SNR、CNR等差异不显著,予以单纯降低管电压的方法可显著降低辐射剂量值,对图像质量不产生影响[14-15].本研究结果显示,低管电压组的辐射剂量参数ED、DLP均显著下降,差异显著.瘤体直径<3 mm则无法清晰显示,CTA的三维结构、血管精准度、显示清晰度更高,空间分辨率较高,敏感性也较高.
本研究结果表明,低管电压组的动脉不同部位的主观图像质量和客观图像质量均无显著差异,因低管电压脑CTA扫描在增加了血管强化值的同时弥补了噪声增加对图像质量的影响[16-17].最大径(≤3 mm)的颅内微小动脉瘤进行低管电压CTA检查可有效降低辐射剂量,同时并不影响微小动脉瘤的诊断和图像质量.
