血清碱性磷酸酶、Ca2+水平在肺癌早期骨转移诊断中的临床意义
2019-09-26麦家杰张金山李志钊符立辉
麦家杰,张金山,李志钊,王 浩,符立辉
(广州医科大学附属第三医院①核医学科,②放射科,广东 广州 510150)
肺癌骨转移是肺癌常见并发症之一,有无骨转移对肿瘤分期及治疗方案的选择非常重要。《肺癌骨转移诊疗专家共识(2014版)》已将ECT列入筛查骨转移的首选方法[1]。既往研究[2]显示,ECT、X线、CT、MRI在检查肺癌骨转移中各有优劣,ECT敏感性最高,但特异性最低;对于早期小病灶的骨转移,SPECT比DR、CT可提前3~6个月检出[3]。由于SPECT存在一定的假阳性,对骨转移可疑患者,PET-CT具有SPECT类似的敏感性,还能显示骨破坏情况,可减少假阳性[4],但其价格昂贵,且仅部分医院或影像中心配备。因此,反映骨代谢标志物的生化指标逐渐在临床中得到应用,在肺癌发生骨转移过程中,溶骨和(或)成骨现象均可发生,血清Ca2+反映溶骨情况,ALP反映成骨情况,对骨转移的判断具有重要临床价值。本研究旨在分析血清ALP、Ca2+水平对早期骨转移患者的鉴别意义。
1 资料与方法
1.1 一般资料 选择我院2014年1月至2016年12月首次确诊的肺癌患者206例,均行SPECT-CT骨扫描,其中男137例,女69例;年龄36~72岁。所有患者均经病理诊断为原发性肺癌,SPECT阳性。
1.2 诊断标准与排除标准 诊断标准:参照周前[5]的骨转移诊断标准,全身SPECT骨扫描提示有转移病灶,特征性表现为多发的无规则放射性浓集区。由2位高年资医师共同诊断得出。针对最可能存在骨转移的区域同时再行CT骨扫描,分析有无骨质破坏;对无骨质破坏者,6个月后再次复查CT,观察有无骨质破坏。排除标准:①已明确诊断骨转移且接受磷酸钠盐治疗或放疗的患者;②原发性骨肿瘤患者;③患有影响骨代谢的疾病,如风湿性关节炎、甲状旁腺功能亢进等;④老年和更年期女性骨质疏松患者。
1.3 SPECT-CT融合成像SPECT扫描仪为Philips公司生产的MPR型,配备Philips公司16层螺旋CT。检查前静脉注射示踪剂99mTc-MDP(20 mCi),饮水1 000 mL后2~4 h行全身显像,人工设置探头位置,使探头尽量贴近受检者。显像参数:低能高分辨力准直器,窗宽20%,能峰140 keV,120 kV,矩阵256×512,扫查速度20 cm/min,选择7100A/DI分别行前位和后位的全身骨显像SPECT扫查。扫描完成后使用Xeleris系统进行图像后处理,调整本底与图像对比,达到最佳诊断图像效果。选择高度怀疑骨转移的病灶,定位后行断层显像,观察骨质破坏情况,然后应用机器自带的软件实现SPECT与CT同机图像的融合。
1.4 CT检查 复查时,应用Philips 256层螺旋CT进行断层扫描,扫描区域不限于SPECT-CT怀疑骨转移病灶。溶骨性病灶以骨质破坏为主,影像学表现为骨皮质上出现空洞;成骨性病灶以新骨形成为特征,影像表现为骨密度增加,呈斑点状、斑片及小片状密度增高改变;混合型病灶则2种现象均存在。
1.5 分组206例CT显示骨质破坏138例,为A组(图1,2);第一次CT未见骨质破坏,6个月后复查出现骨质破坏33例(即骨转移伴早期无骨质破坏),为B组;6个月后复查无骨质破坏者35例,为C组。
1.6 血清ALP、Ca2+水平检测 SPECT扫描前空腹采集静脉血3~4 mL,血清钙检测采用偶氮砷Ⅲ法,ALP检测采用酶法,均采用Olympus AU5400全自动生化分析仪。
1.7 统计学方法 采用SPSS 22.0统计软件进行统计分析,多组间比较采用单因素方差分析;绘制ROC曲线图,计算曲线下面积(area under curve,AUC),应用约登指数筛选临界值,计算诊断的敏感度、特异度和准确率;率之间的比较,频次>5时采用Pearson卡方检验,频次≤5时采用Fisher精确检验,以P<0.05为差异有统计学意义。
2 结果
2.1 3组血清ALP和Ca2+水平的比较(表1) 血清ALP水平比较,A组与B组、A组与C组差异均有统计学意义(均P<0.05),B组与C组间差异无统计学意义(P>0.05)。血清Ca2+水平比较,A组高于B组,B组高于C组(均P<0.05),B组与C组间差异无统计学意义(P>0.05)。
表1 3组血清ALP和Ca2+水平的比较()
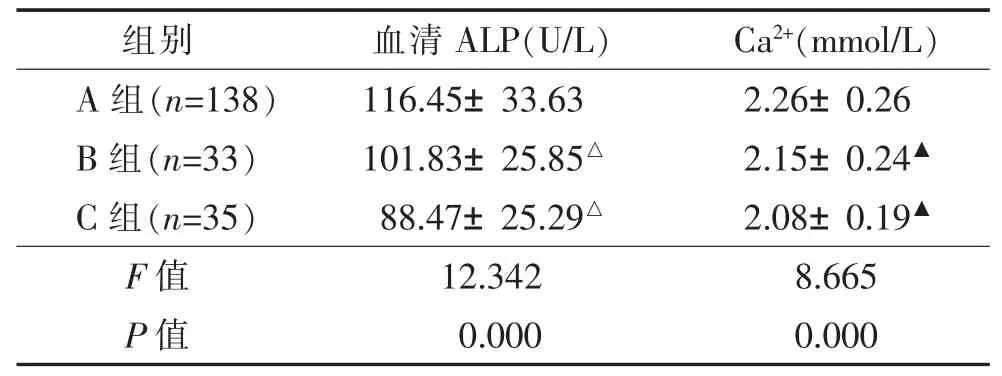
表1 3组血清ALP和Ca2+水平的比较()
注:A组,骨转移伴早期骨质破坏;B组,骨转移伴早期无骨质破坏;C组,无骨转移。与A组相比,△P<0.05,▲P<0.05。
2.2 绘制血清ALP、Ca2+水平诊断肺癌骨转移的ROC曲线(图3) ROC曲线显示,血凊ALP、Ca2+的AUC分别为0.725、0.688,血凊ALP诊断肺癌骨转移的敏感度为71.3%,特异度为68.6%;血凊Ca2+的诊断敏感度为42.7%,特异度为88.6%;血凊ALP的95%CI为(0.637,0.814),血凊Ca2+的95%CI为(0.603,0.774)。
2.3 ALP、Ca2+水平对早期骨转移的诊断价值(表2) 以ALP、Ca2+的正常参考值和ROC曲线临界值分别诊断B组早期骨转移患者,与正常参考值的诊断结果相比,ALP的ROC曲线临界值(93.85 U/L)诊断骨转移的阳性率提高(P=0.001),特异度和准确率差异均无统计学意义(均P>0.05);与正常参考值的诊断结果相比,Ca2+的ROC曲线临界值(2.315 mmol/L)诊断骨转移的敏感度、特异度和准确率差异均无统计学意义(均P>0.05)。
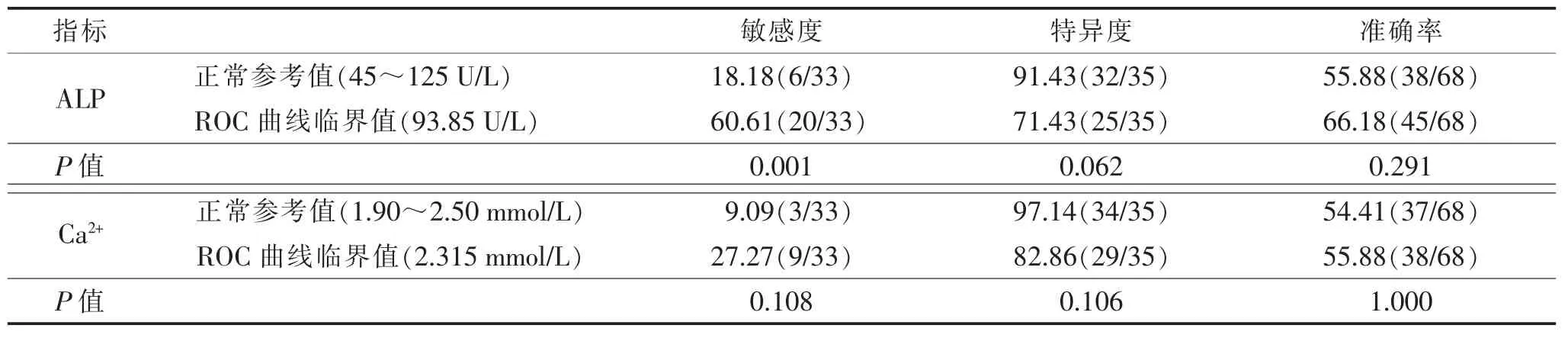
表2 血清ALP和Ca2+水平诊断肺癌早期骨转移的价值 %(例/例)
2.4 血清ALP、Ca2+水平在不同类型肺癌骨转移中的表达水平(表3)171例肺癌骨转移中,溶骨型多见,占78.36%(134/171);成骨型较少,占15.20%(26/171);溶骨与成骨并存仅11例,占6.43%。溶骨型血清Ca2+水平明显高于成骨型(P=0.000),但与混合型差异无统计学意义(P=0.966),成骨型与混合型差异亦无统计学意义(P=0.207);成骨型血清ALP水平明显高于溶骨型(P=0.000),但与混合型骨转移组间差异无统计学意义(P=0.578),溶骨型与混合型差异有统计学意义(P=0.000)。
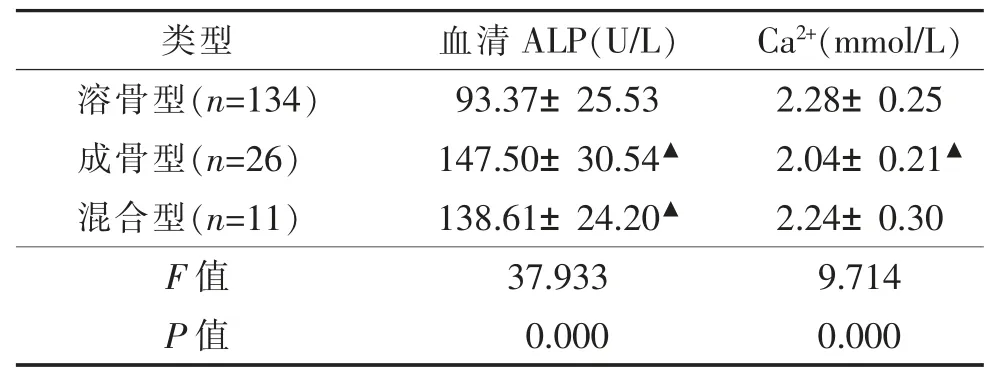
表3 不同类型肺癌骨转移患者血清ALP、Ca2+水平的表达
3 讨论
《肺癌骨转移诊疗专家共识2014版》[1]认为肺癌发病隐匿,确诊时约50%已发生远处转移,而骨转移是主要的血行转移部位之一;骨转移大多以溶骨性破坏为主,主要分布于脊椎、骨盆和肋骨,严重影响患者生活质量。肺癌骨转移的诊断应满足以下2个条件之一:①临床或病理诊断肺癌,骨病变活检符合肺癌转移;②肺癌病理诊断明确,具有典型的骨转移影像学表现。影像学诊断是最常用的方法,骨SPECT扫描是首选的全身筛查方法,其敏感性高,在X线、CT尚未发现骨质破坏时,其能提前3~6个月检出骨转移,X线仅在骨质发生50%脱钙后才能发现病灶;甚至有研究[6]认为,SPECT可提前18个月发现骨转移灶。但SPECT诊断骨转移的特异度不高,文献报道[7]微小病灶的假阳性率可达40%~50%,局部外伤或炎症、关节退行性变、代谢性骨病等导致磷酸盐异常沉积是主要原因;骨转移瘤高度侵袭导致病灶局部血运障碍时,SPECT则表现为阴性,而CT则呈明显的骨质破坏,此为晚期骨转移的表现[8]。对早期骨转移患者SPECT阳性而CT无骨质破坏时随访3~6个月有助于明确诊断,但文献[9]显示确诊肺癌后出现骨转移的时间平均为3.9个月,因此随访期间极可能出现新的骨转移灶。
由于影像学对肺癌早期骨转移的诊断存在一定的局限,近年来骨活动相关的血清标志物在肺癌骨转移中的应用研究受到重视。ALP和血清Ca2+是反映成骨活动和溶骨活动的重要标志物,在肺癌骨转移患者中溶骨现象和成骨现象常同时存在。癌细胞会分泌蛋白分解酶,破骨细胞刺激因子,溶解和破坏骨基质,并促使破骨细胞增生,破坏大量骨质;而肺癌患者分泌过多的前列腺素E会促进骨吸收增加,超过机体清除能力时则血清Ca2+水平升高[10]。文献[11-12]认为,血清ALP也是判断肺癌骨转移的重要指标。ALP主要由成骨细胞分泌,促进磷酸盐沉积,加速骨骼修复,是反映成骨活动的重要标志物,在成骨型骨转移中升高更为明显。血清ALP升高是影响患者预后的重要危险因素之一,提示患者生存时间缩短[13];也有报道[14]肺癌骨转移治疗后ALP水平明显降低,骨破坏程度减轻。正常状态下骨骼动态重塑包括骨质溶解和骨质形成,骨转移瘤病灶则可打破这种平衡,出现溶骨过度和(或)成骨过剩,表现为溶骨型和(或)成骨型转移瘤[15]。
肺癌骨转移患者,一般认为溶骨型多见。杨永峰等[16]报道的76例肺癌骨转移中60例发生溶骨性破坏,腺癌占53.9%(41/76),鳞癌占43.4%(33/76)。但也有研究认为成骨型多见,王颖[17]分析51例肺癌骨转移患者的CT表现,其中溶骨型占31.4%(16/51),成骨型占49.0%(25/51),2种类型并存占19.6%(10/51)。本研究显示,肺癌骨转移溶骨型多见,但因本研究仅针对转移可能性最大的区域进行骨扫描,可能会遗漏部分存在的转移灶。据相关文献[18]报道,恶性肿瘤骨转移患者高钙血症的比例为10%~20%,肺癌骨转移并发高钙血症比例为10.31%;刘志武等[19]报道肺癌骨转移组高钙血症发生率为9.62%(10/104),非转移组为5.77%(6/104);肺癌骨转移组ALP升高发生率为36.54%,非转移组仅为8.54%。本研究显示,骨转移伴骨质破坏者(A组)Ca2+升高(正常值1.90~2.50 mmol/L)比例为17.39%(24/138),ALP升高(正常值45~125 U/L)发生率为38.41%(53/138);骨转移伴早期无骨质破坏者(B组)血Ca2+升高比例为9.09%(3/33),ALP升高发生率为18.18%(6/33),提示ALP升高对骨转移的诊断价值较高。其原因可能为血Ca2+升高主要来源于溶骨释放,且Ca2+可被肾脏和胃肠道排出,因此也有研究[19]认为血Ca2+水平对肺癌骨转移诊断意义不大;而ALP主要由肝脏和成骨细胞合成,肿瘤源性的TGF-β、Wnts、内皮素1等均参与诱导成骨细胞成骨,且ALP主要以游离形式存在,极少量与脂蛋白和免疫球蛋白结合,通过肝脏经胆汁排出,因此升高比例高于血Ca2+。
由于肺癌骨转移患者血清Ca2+、ALP升高比例不高,应用ROC曲线模型对诊断肺癌骨转移具有重要价值[20]。应用Ca2+的ROC曲线临界值(2.315 mmol/L)诊断,可将A组和B组的血Ca2+升高患者比例提升至46.38%(64/138)、27.27%(9/33),但与正常参考值结果相比,其敏感度、特异度均差异无统计学意义。应用ALP的ROC曲线临界值(93.85 U/L)诊断肺癌早期骨转移(B组)的敏感度则提升至60.61%,与正常参考值的诊断敏感度(18.18%)相比,差异有统计学意义(P=0.001),诊断效能得到明显提升。
综上所述,应用血清ALP的ROC曲线模型对诊断肺癌骨转移有重要价值,ALP>93.85 U/L有助于提高肺癌早期骨转移的诊断敏感度。
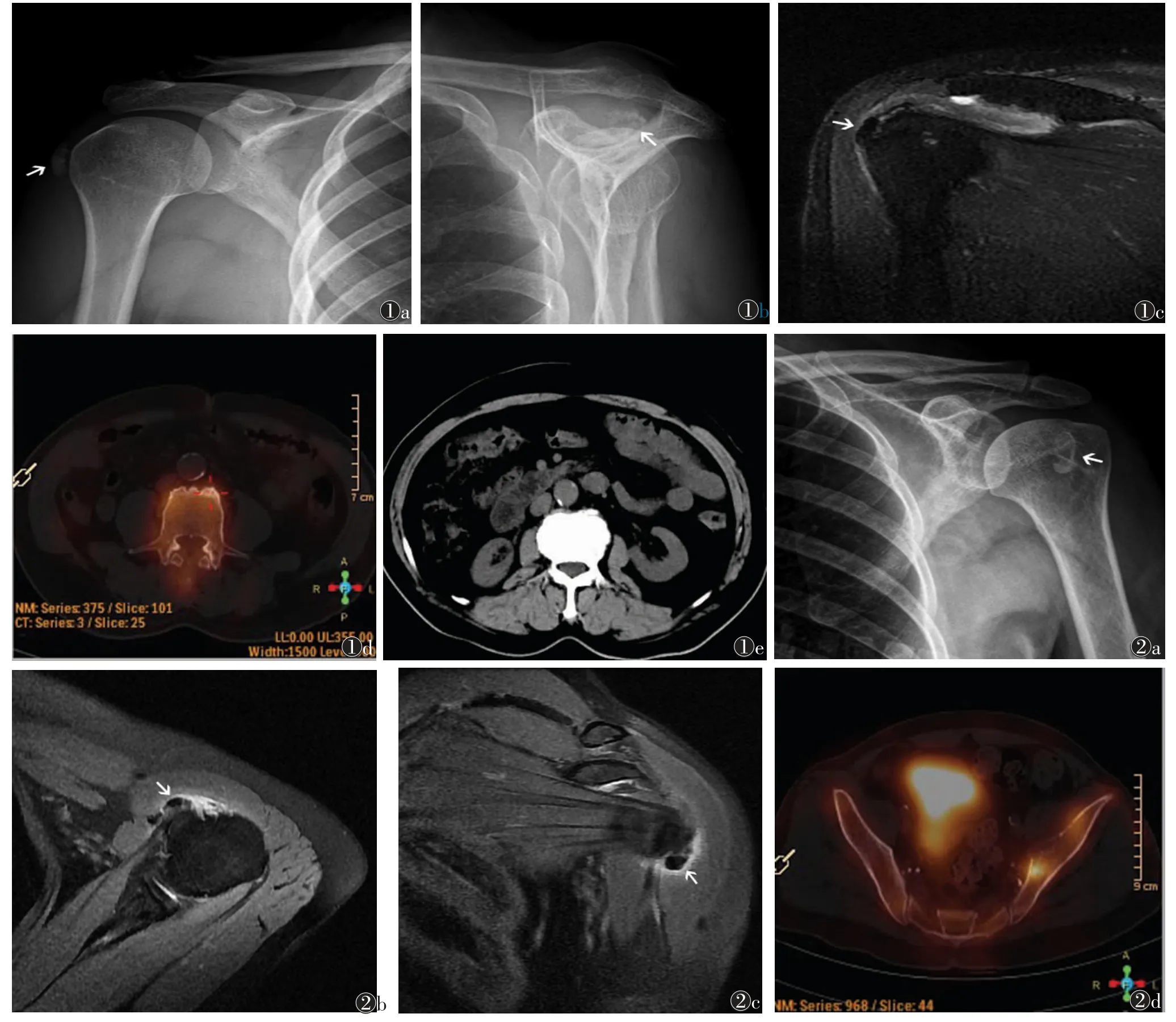
图1 男,79岁,2014年12月首次诊断肺癌,血清ALP和Ca2+水平分别为78.6 U/L和1.95 mmol/L图1a CT怀疑右肺肺癌 图1b SPECT提示L4椎体局部高聚集 图1c CT提示骨质增生 图1d SPECT与CT融合成像,阳性处为骨质破坏 图1e 6个月后复查腰椎CT,仍提示骨质增生,排除骨转移 图2 男,68岁,2015年12月首次诊断肺癌,血清ALP和Ca2+水平分别为118.5 U/L和2.25 mmol/L图2a CT诊断肺癌并肺内多发转移 图2b SPECT提示左侧髂骨高聚集 图2c CT提示溶骨性骨转移 图2d SPECT与CT融合成像,阳性处骨质破坏,为转移性病灶
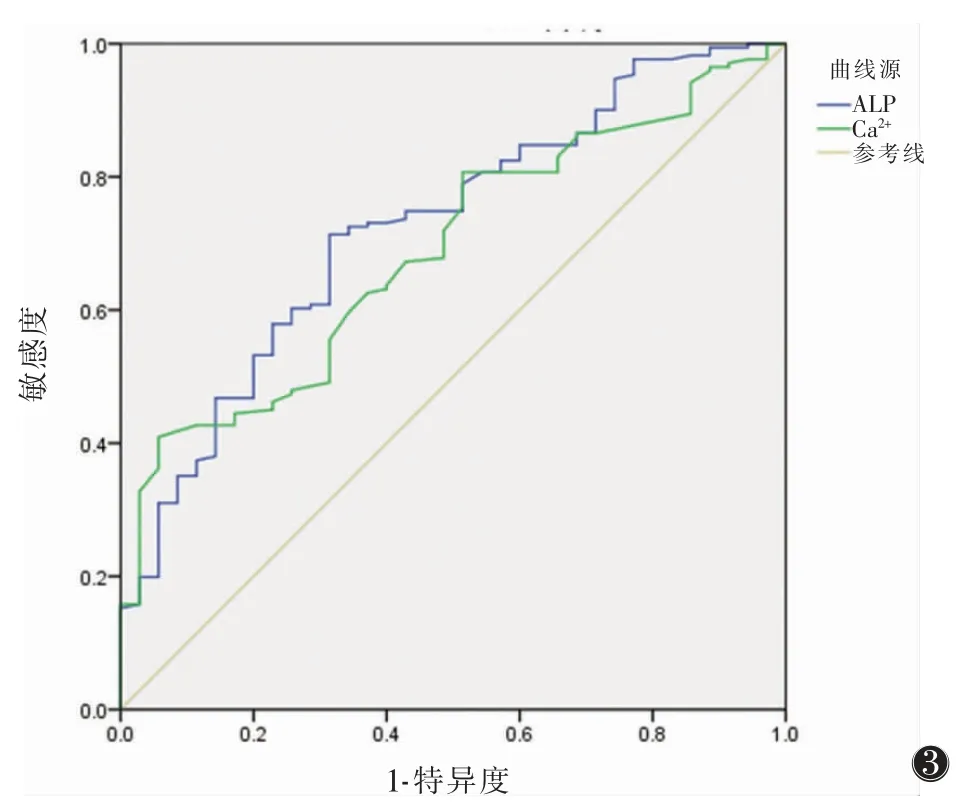
图3 血清ALP、Ca2+水平诊断肺癌骨转移的ROC曲线
