茶枝柑叶总黄酮纯化工艺研究
2019-09-25汪金玉张秋霞陶晨璐武慧雯
汪金玉,张秋霞,陈 康,陶晨璐,武慧雯
(广州中医药大学 中药学院,广东 广州 510006)
茶枝柑(Citrusreticulata‘Chachi’)隶属芸香科柑橘属,其多个部位如果皮、籽等都有一定的药用价值。其中,茶枝柑的干燥成熟果皮具有悠久的药食两用历史,也是广东道地药材“广陈皮”的原材料[1]。目前国内外对于茶枝柑的研究主要集中在果皮的化学成分[2-3]、药理药效[4-6]及种质资源[7-8]等方面,亦有茶枝柑籽的相关报道[9],但尚未见有关茶枝柑叶中化学成分分析及开发利用的研究报道。茶枝柑四季常青,每年会在休果期裁剪掉部分枝叶,这些被裁剪的树叶除少量被用于制茶外多被丢弃,造成了资源的浪费,因此研究茶枝柑叶的利用具有重要的实际意义。
黄酮类化合物在抗炎镇痛、免疫调节、抗氧化[10-13]等方面均有较优异的应用价值。研究表明,广陈皮主含黄酮类成分和挥发油,从中可分离得到10余种黄酮类化合物,其中以橙皮苷含量最高,达3.0%~7.9%,其次为川陈皮素、橘皮素[14]。茶枝柑同属植物橘叶中总黄酮含量为4.34%~6.59%,其中橙皮苷、川陈皮素、橘皮素3种黄酮类化合物含量为1.26%~2.18%[15-16]。从植物基原学角度分析认为,茶枝柑叶也可能含有较丰富的黄酮类化合物。
目前用于黄酮类化合物纯化的材料主要有聚酰胺、大孔树脂[17-18]等,聚酰胺的工作原理是其分子中的酰胺基可与黄酮类化合物分子中的酚羟基形成氢键缔合产生吸附,将黄酮类物质与其他成分分离,从而达到优化黄酮的效果[19-20]。本试验利用聚酰胺树脂探究了茶枝柑叶提取物中总黄酮的静态、动态吸附与解吸过程,应用星点设计优化[22-25]聚酰胺分离纯化茶枝柑叶总黄酮的工艺,以期为茶枝柑叶总黄酮的纯化制备及其综合开发利用提供依据。
1 材料与方法
1.1 材 料
茶枝柑叶于2017年3月采摘于广东省新会市,经广州中医药大学中药学院陈康教授鉴定,其基原植物为茶枝柑(Citrusreticulate‘Chachi’),该凭证标本保存于广州中医药大学中药学院中药炮制实验室。
橙皮苷购于广东省食品药品检验所,批号:150912;不同粒径聚酰胺树脂,浙江四甲;氢氧化钠、亚硝酸钠、硝酸铝、无水乙醇等化学试剂均为分析纯。
1.2 仪器与设备
紫外可见分光光度计(上海元析仪器有限公司,UV-5500PC型),分析天平(赛多利斯科学仪器北京有限公司,BT125D,精度0.01 mg),恒温水浴锅(北京市永光明医疗仪器厂,DZWK-S-5),SHA-B 型水浴恒温振荡器(金坛市科析仪器有限公司),pH计(上海盛磁仪器有限公司,Model PHS-3C),电子天平(广州湘仪机电设备有限公司,AUY 120),SHZ-DⅢ循环水式多用真空泵(巩义市英峪予华仪器厂),层析柱(直径2 cm,长30 cm,1 BV=94 mL)。
1.3 方 法
1.3.1 对照品溶液的制备 精密称取干燥至恒质量的橙皮苷对照品5.82 mg,置50 mL容量瓶中,用体积分数50%乙醇加至刻度,摇匀即得对照品溶液(0.114 6 mg/mL)。
1.3.2 供试品溶液的制备 称取茶枝柑叶50 g,切宽丝,置于圆底烧瓶中,以1∶10的料液比加入体积分数50% 乙醇回流提取2次,每次1 h,合并2次滤液。放在水浴锅上挥至无醇味,用蒸馏水定容至500 mL,即得茶枝柑叶提取液,冷藏保存,备用。
1.3.3 总黄酮含量检测波长的确定与标准曲线的绘制 借鉴同属植物橘叶中总黄酮含量测定方法[11],取待测茶枝柑叶提取液1 mL,置于25 mL容量瓶中,加质量分数5% NaNO2溶液1 mL,摇匀,放置6 min;再加入质量分数10% Al(NO3)3溶液1 mL,摇匀,放置6 min;加质量分数10%NaOH溶液10 mL,用体积分数50%乙醇定容,摇匀,放置15 min后,在200~800 nm进行全波长扫描,确定检测波长。
梯度量取橙皮苷对照品溶液2,3,4,5,6 mL,按上述显色方法和检测波长测定吸光度。以质量浓度为横坐标,吸光度为纵坐标,构建标准曲线方程。
1.3.4 聚酰胺树脂的预处理 将聚酰胺树脂用体积分数95%乙醇浸泡过夜,使其充分溶胀,倾去乙醇漂浮物后湿法装柱,加体积分数95%乙醇洗脱,至流出液经水浴蒸干后无固体残渣为止,用蒸馏水洗脱至无醇味,备用。
1.3.5 聚酰胺树脂对茶枝柑叶总黄酮的静态吸附与解吸 分别称取处理过的粒径分别为30~60目(250~550 μm)、60~100目(150~250 μm)、100~200目(75~150 μm)、200~300目(48~75 μm)的聚酰胺树脂2.0 g,置250 mL具塞锥形瓶中,加入50 mL茶枝柑叶提取液(上样液);置于25 ℃转速140 r/min的恒温振荡器上,振荡吸附12 h,取出,抽滤,抽滤液(吸附液)保存待测。用蒸馏水清洗树脂,过滤,倒回锥形瓶内;向锥形瓶中加入50 mL体积分数 75%乙醇液,于25 ℃转速140 r/min的恒温振荡器上,振荡解吸24 h,取出,抽滤,保存抽滤液(解吸液)待测。按1.3.3节方法测定上样液、吸附液和解吸液的吸光度,按标准曲线回归方程计算各溶液中的总黄酮质量浓度,并以此计算静态吸附量Q(mg/g)和解吸率J(%)。重复测试3次,取平均值,以筛选适用于吸附茶枝柑叶总黄酮的聚酰胺树脂。
Q=(C0-C1)×V/M。
(1)
J=C2/(C0-C1)×100%。
(2)
式中:V为溶液体积(mL),C0为提取液质量浓度(mg/mL),C1为吸附液质量浓度(mg/mL),C2为解吸液质量浓度(mg/mL),M为树脂质量(g)。
1.4 聚酰胺树脂对茶枝柑叶总黄酮的动态吸附单因素试验
1.4.1 上样液质量浓度 称取适宜粒径的聚酰胺树脂5.0 g(湿质量),湿法上柱。将13.0,14.0,15.0,16.0,17.0,18.0 mg/mL,pH为4的茶枝柑叶提取液各150 mL分别上柱,以1 BV/h的流速流过树脂柱,收集流出液,均用蒸馏水定容至适宜体积,测定总黄酮质量浓度,计算树脂的动态吸附率Q1。重复测定3次,取平均值,分析上样液质量浓度对聚酰胺树脂吸附茶枝柑叶总黄酮的影响。
Q1=(C3V3-C4V4)/C3V3×100%。
(3)
式中:C3为样品液质量浓度(mg/mL),V3为上样液体积(mL),C4为流出液质量浓度(mg/mL),V4为流出液体积(mL)。
1.4.2 上样液pH值 称取适宜粒径的聚酰胺树脂5.0 g(湿质量),湿法上柱。将15 mg/mL的茶枝柑叶提取液,用NaOH或HCl将pH调至3,4,5,6,7,各取150 mL,分别以1 BV/h流速流过树脂柱,收集流出液。蒸馏水定容至适宜体积,测定黄酮质量浓度,计算吸附率Q1。重复测定3次,取平均值,分析上样液pH值对聚酰胺树脂吸附茶枝柑叶总黄酮的影响。
1.4.3 上样液流速 称取适宜粒径的聚酰胺树脂5.0 g(湿质量),湿法上柱。取5份质量浓度为15 mg/mL、pH为4的茶枝柑叶提取液150 mL,分别以1.25,1.5,1.75,2,2.25,2.5 BV/h的流速流过树脂柱,收集流出液。蒸馏水定容至适宜体积,测定黄酮质量浓度,计算吸附率Q1。重复测定3次,取平均值,分析上样液流速对聚酰胺树脂吸附茶枝柑叶总黄酮的影响。
1.5 聚酰胺树脂对茶枝柑叶总黄酮动态吸附工艺的响应面法优化
根据Box-Benhnken试验设计原理,综合茶枝柑叶动态吸附单因素试验结果,对上样液质量浓度、上样液pH、上样液流速3个因素进行响应面试验设计,方案如表1所示。
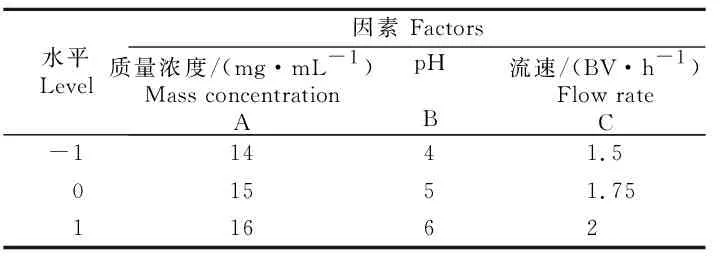
表1 茶枝柑叶总黄酮动态吸附工艺响应面优化试验方案Table 1 Scheme in response surface test of Citrus reticulata ‘Chachi’ leaves
1.6 上样液泄漏曲线考察
称取经预处理的聚酰胺树脂5.0 g(湿质量),湿法上柱,取15 mg/mL、pH为5的茶枝柑叶提取液上样,以1.75 BV/h的流速通过树脂柱,分段收集流出液,每10 mL为一流份,测定各流份中总黄酮的质量浓度,以流份体积为横坐标,总黄酮质量浓度为纵坐标,绘制动态吸附曲线。以流出液中总黄酮质量浓度达到上样液质量浓度的10%时为泄漏点,总黄酮质量浓度为上样液质量浓度的100%时为饱和点,从而确定适宜的最大上样体积。
1.7 茶枝柑叶总黄酮的动态解吸工艺优化
1.7.1 洗脱剂体积分数 称取处理过的聚酰胺树脂5.0 g(湿质量),湿法上柱。取15 mg/mL、pH为5的茶枝柑叶提取液30 mL上样,以1.75 BV/h的流速流过树脂柱,吸附30 min。先用蒸馏水洗去水溶性物质,再分别用体积分数25%,50%,75%,95%乙醇溶液2 BV洗脱,收集洗脱液,定容至相同体积,测定吸光度,计算总黄酮质量浓度。重复测定3次,取平均值,分析洗脱剂体积分数对茶枝柑叶总黄酮解吸效果的影响。
1.7.2 洗脱剂用量 称取处理过的聚酰胺树脂 5.0 g(湿质量),湿法上柱。取15 mg/mL、pH为5的茶枝柑叶提取液30 mL上样,吸附30 min。先用蒸馏水洗去水溶性物质,再用体积分数75%乙醇洗脱,以30 mL为1个单位收集流出液,测其吸光度,计算总黄酮质量浓度。重复测定3次,取平均值,分析洗脱剂用量对茶枝柑叶总黄酮解吸效果的影响。
1.8 最佳工艺和纯化效果验证
利用Design-Expert软件对响应面试验结果进行多元回归拟合,根据模型极值求解结合等高线得到最佳吸附工艺参数。综合单因素结果和实际操作的便利,对工艺参数进行修正并重复试验3次,验证工艺的稳定性。分别量取一定体积的纯化前、纯化后溶液进行干燥,结合溶液质量浓度,计算总黄酮在干燥物中的含量,判断纯化效果。
2 结果与分析
2.1 茶枝柑叶总黄酮含量测定标准曲线的建立
按1.3.3节方法处理后,橙皮苷和茶枝柑叶提取液在326 nm处均有最大吸收,因此选择326 nm为茶枝柑叶总黄酮含量测定波长。橙皮苷测定标准曲线回归方程为Y=32.47X-0.04,相关系数R2= 0.999 2。式中,Y为吸光度,X为溶液质量浓度。
2.2 聚酰胺树脂对茶枝柑叶总黄酮的静态吸附与解吸效果
4种粒径聚酰胺树脂对茶枝柑叶黄酮的静态吸附量和解吸结果如表2所示。

表2 不同粒径聚酰胺树脂对茶枝柑叶总黄酮的静态吸附及解吸效果Table 2 Static adsorption capacity and desorption rate of polyamide resins with different diameters
由表2可见,不同粒径树脂的静态吸附量和解吸率存在较大差异,综合考虑认为, 200~300目(48~75 μm)聚酰胺树脂效果较好,可用于下一步动态吸附试验。
2.3 聚酰胺树脂对茶枝柑叶总黄酮动态吸附的单因素试验结果
2.3.1 上样液质量浓度的影响 图1-A显示,茶枝柑叶提取液质量浓度在13~15 mg/mL时,聚酰胺树脂对茶枝柑叶总黄酮的吸附率不断增大;但超过15 mg/mL后,吸附率呈下降趋势,可能是因为质量浓度增大后黏度增加,不利于树脂的吸附,因此选择14,15,16 mg/mL 作为上样液质量浓度的3个水平进行优化试验。
2.3.2 上样液pH值的影响 图1-B显示,pH为3时聚酰胺树脂对茶枝柑叶提取液中总黄酮的吸附率最大,但同时溶液出现浑浊。可能是因为偏酸性的黄酮在酸性环境下析出所致,而其吸附率高可能是因为析出的黄酮类物质被拦截在树脂柱上方。综合考虑,选择pH值4,5,6进行优化试验。
2.3.3 上样液流速的影响 图1-C显示,上样液流速为1.75 BV/h时,聚酰胺树脂对茶枝柑叶提取液中总黄酮的吸附率最大,此后随着上样液流速的增大,吸附率呈下降趋势,这表明流速过快使得黄酮类物质来不及吸附,已被冲洗下来。因此选择流速为1.5,1.75,2 BV/h进行优化试验。
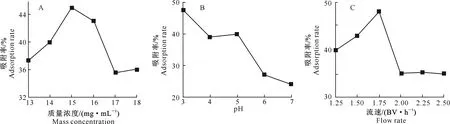
图1 聚酰胺吸附茶枝柑叶总黄酮的单因素试验结果Fig.1 Single factor test of adsorption of total flavonoids by polyamide
2.4 聚酰胺树脂对茶枝柑叶总黄酮动态吸附工艺的响应面优化结果
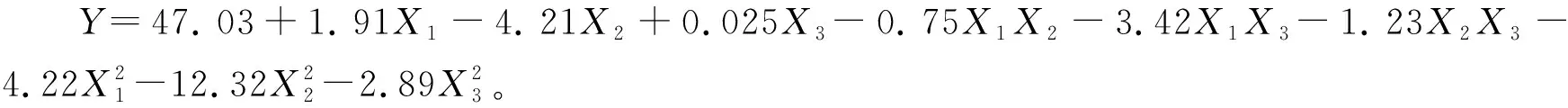
对回归方程的方差分析结果见表4。由表4可知,该模型P<0.000 1,失拟项P>0.05,表明模型具有较好的拟合性,可用于分析和预测。方程中A、B因素的一次项、二次项和C因素的二次项,以及交互项AC具有极显著(P<0.01)差异;交互项BC具有显著性(P<0.05)差异;C因素的一次项和交互项AB差异不显著,表明各因素之间不是简单的线性关系。同时,由3个因素一次项的F值可以推断,其对聚酰胺树脂吸附茶枝柑叶总黄酮的影响排序为:B(上样液pH)>A(上样液质量浓度)>C(上样液流速)。
从图2等高线图亦可以直观看出,上样液质量浓度和pH等高线图形较圆,说明两项之间的交互效应较弱,而上样液质量浓度和上样液流速与pH和上样液流速的等高线图形则呈椭圆形,说明其交互效应较强;此外,从等高线图曲面倾斜度可知,上样液质量浓度和上样液pH交互作用对聚酰胺树脂吸附茶枝柑叶总黄酮的影响最大,其次为上样液pH和上样液流速,最小为上样液质量浓度和上样液流速。
综上可知,该回归模型是可靠的。结合模型极值和等高线得到最佳工艺为:上样液质量浓度15.26 mg/mL,上样液流速1.72 BV/h,上样液pH 4.83,最大吸附率理论值为48.27%。综合考虑单因素试验结果和实际操作的便利,将最佳工艺条件修正为:上样液质量浓度15 mg/mL,上样液流速1.75 BV/h,上样液pH 5。

表3 聚酰胺树脂对茶枝柑叶总黄酮动态吸附工艺的响应面优化结果(n=3)Table 3 Design and results of RSM test of total flavonoids from Citrus reticulata ‘Chachi’ leaves
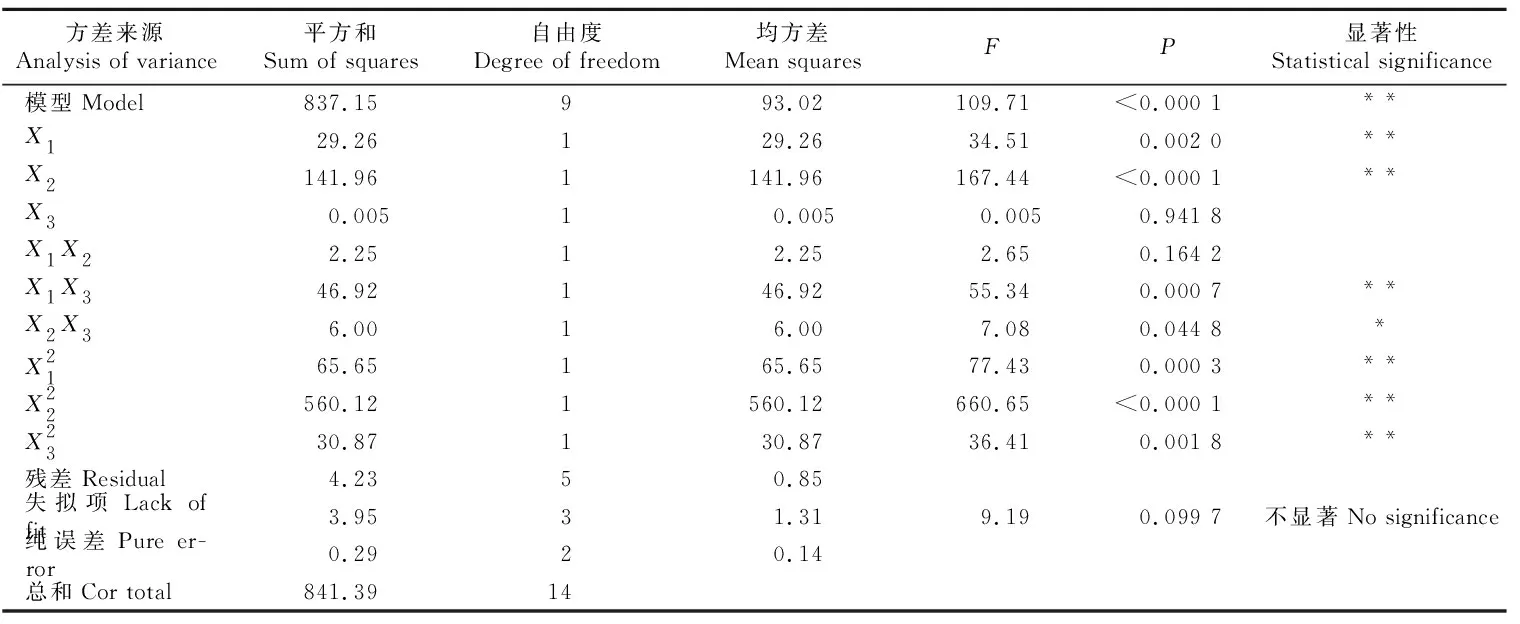
表4 茶枝柑叶总黄酮纯化工艺回归模型的方差分析Table 4 ANOVA for response surface quadratic model of total flavonoids extraction from Citrus reticulata ‘Chachi’ leaves
注:*显著P<0.05;**极显著P<0.01。
Note:*.Significant atP<0.05;**.Very significant atP<0.01.

图2 各因素交互作用对聚酰胺树脂吸附茶枝柑叶总黄酮的影响Fig.2 Effect of factors interaction on adsorption rate of total flavonoids from Citrus reticulata ‘Chachi’ leaves
2.5 聚酰胺树脂吸附茶枝柑叶总黄酮的泄漏曲线
图3显示,当流出液体积为30 mL时黄酮开始泄漏,至流出液体积为170 mL时基本不再发生变化,树脂柱达到吸附饱和,即加入170 mL质量浓度为15 mg/mL的茶枝柑叶提取液,可使5 g(湿质量)聚酰胺树脂吸附饱和。故确定该条件下最大上样体积为30 mL,约为树脂湿质量的6倍。
2.6 茶枝柑叶总黄酮的动态解吸
2.6.1 洗脱剂体积分数 图4-A显示,随着乙醇体积分数的增大,洗脱液对茶枝柑叶总黄酮的解吸率逐渐增大。当乙醇体积分数大于75%后,洗脱效果变化不大,综合考虑纯化效果和成本,选用体积分数75%乙醇进行洗脱。
2.6.2 洗脱剂用量 图4-B显示,当洗脱剂用量约为1 BV时,流出的总黄酮质量浓度基本不再发生变化,综合考虑洗脱率和成本,确定洗脱至总黄酮质量浓度基本不再变化,再增加1个洗脱单位(30 mL),即洗脱剂用量约为1.3 BV。
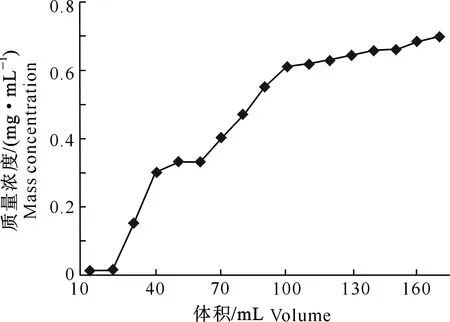
图3 聚酰胺树脂吸附茶枝柑叶总黄酮的泄漏曲线Fig.3 Leakage curve of total flavonoids by polyamide from Citrus reticulata ‘Chachi’ leaves

图4 洗脱剂对茶枝柑叶总黄酮解吸率的影响Fig.4 Effect of eluent on desorption rate of total flavonoids from Citrus reticulata ‘Chachi’ leaves
2.7 最佳工艺验证
对所得最佳工艺条件的3次平行验证试验,以及总黄酮含量检测结果显示,纯化前溶液干燥物中总黄酮含量为6.50%,纯化后溶液干燥物中总黄酮含量为64.17%±0.93%(n=3),说明上述最佳工艺稳定,且能有效纯化茶枝柑叶中的总黄酮。
3 讨论与结论
目前,大孔树脂被广泛应用于黄酮类化合物的纯化,本研究前期就2种常用树脂D101和AB-8对茶枝柑叶总黄酮的纯化效果进行了初步考察,结果显示,两者虽然对色素类物质均有较好的吸附,但上柱后以水液洗脱时即大量流出,难以与其他大极性物质分离,说明D101和AB-8大孔树脂不适用于茶枝柑叶总黄酮的纯化。
预试验结果显示,本研究所用茶枝柑叶样品总黄酮含量达5.69%,与同属植物橘叶总黄酮含量(4.34%~6.59%)[11]较为接近,提示茶枝柑叶具有良好的研究开发价值。关于茶枝柑叶中黄酮类成分的组分、含量、功效等有待进一步研究。
通过静态吸附和解吸试验发现,纯化茶枝柑叶总黄酮的最适聚酰胺树脂粒径为200~300目(48~75 μm),该树脂对茶枝柑叶总黄酮具有较好的吸附和解吸性能,其纯化茶枝柑叶总黄酮的最佳工艺为:取树脂湿质量6倍量,质量浓度(生药量)15 mg/mL、pH为5的上样液,以1.75 BV/h的流速流过树脂柱,吸附30 min后,以1.3 BV、体积分数75%的乙醇洗脱。在此条件下,茶枝柑叶醇提物中的总黄酮含量可提升至64.17%。
