栀子苷抑制高糖诱导的乳鼠心脏成纤维细胞向肌成纤维细胞的表型转化
2019-09-24向家培雷玉华
向家培,雷玉华
(恩施土家族苗族自治州中心医院心血管内科,恩施 445000)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是独立于糖尿病的并发症之一,同时也是晚期造成糖尿病患者死亡的主要原因。心肌间质纤维化是DCM的主要病理表现之一[1]。心肌纤维化能增加心室壁僵硬度,降低心室顺应性,导致心脏舒缩功能障碍,最终导致心力衰竭[2]。心脏成纤维细胞(cardiac fibroblasts,CF)是调节细胞外基质(extracellular matrix,ECM)合成和降解的主要细胞,在心肌纤维化的发生发展过程中发挥着至关重要的作用[3]。研究表明,高糖刺激一方面能够促进CF增殖,加速胶原合成;另一方面,能够直接激活转化生长因子β(transforming growth factor-beta,TGF-β)/Smads信号通路,促进CF细胞中Ⅰ型胶原(collagen Ⅰ,Col Ⅰ)、Col Ⅲ及结缔组织生长因子(connective tissue growth factor,CTGF)的合成,最终增加心肌组织ECM的合成[4]。沉默信息调节因子(silent information regulator,SIRT)1是哺乳动物体内与酵母SIRT2同源性最高的同系物,与机体氧化应激、基因转录调控及细胞衰老等多种生命活动密切相关[5]。在DCM中,SIRT1能够通过抑制内质网应激减少心肌细胞凋亡,从而发挥保护作用[6]。此外,SIRT1还能够通过抑制乙酰化的Smad3(acetylated-Smad3,ac-Smad3)信号通路减轻肾脏纤维化[7]。
栀子苷(geniposide,GE),又名京尼平苷,属于环烯醚萜苷类化合物[8]。目前,GE已被证实具有抗炎症、抗肿瘤、抗凋亡及抗血管生成等多种药理作用[9]。在心血管疾病中,GE能够抑制胸主动脉缩窄(thoracic aortic constriction,TAC)诱导的心肌肥厚,其机制与GE对心肌细胞中腺苷酸活化蛋白激酶α(adenosine monophosphate activated protein kinase α,AMPKα)的抑制有关[10]。而GE在DCM中的作用尚未见报到。本文将主要探讨GE对高糖诱导的大鼠CF的转化及胶原合成的作用,以及可能涉及的分子机制。
1 材料与方法
1.1 实验材料
GE购自上海融禾医药科技发展有限公司,纯度大于98%。将GE溶解在磷酸盐缓冲液(phosphate buffer solution,PBS)中配置成不同浓度的GE溶液待使用。出生1~3 d的Sprague-Dawley大鼠,雌雄不限,由湖北省疾病预防控制中心提供。氧化应激检测试剂盒包括超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)和还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NAPDH),购自碧云天生物技术有限公司;胎牛血清购自美国Gibco公司;低糖DMEM培养基购自赛默飞世尔(苏州)仪器有限公司;甘露醇、葡萄糖、Trizol Reagen购自美国Invitrogen公司;引物由武汉谷歌生物公司合成和纯化。
1.2 方法
1.2.1 大鼠CF的分离和培养 无菌条件下剪取乳鼠心脏前1/3的心室部分,用0.25%胰蛋白酶消化心肌组织,差速贴壁1 h去除未贴壁的心肌细胞。采用DMEM + 10%胎牛血清 + 双抗培养基传代培养乳鼠CF,选用第2~3代传代细胞,用0.25%的胰酶消化CF。
1.2.2 实验分组 预实验确定GE的最佳保护浓度为100 μmol/L。实验分为4组:(1)正常对照(normal control,NC)组;(2)NC+GE组;(3)高糖(葡萄糖,浓度为33.3 mmol/L)模型组;(4)高糖 + GE组。每组设置 5个复孔,并接受相应处理。
1.2.3 逆转录聚合酶链反应检测胶原mRNA的表达 (1)Trizol法提取CF中RNA,利用紫外分光光度计检测RNA的浓度及纯度,A260/A280=1.8~2.0方可使用;(2)通过逆转录,将mRNA合成为cDNA,并放入-80℃冰箱保存;(3)逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)体系包括:10×Buffer 2.5 μl、cDNA 2 μl、正向引物(20 μmol/L)0.25 μl、反向引物(20 μmol/L)0.25 μl、去氧核苷酸(deoxynucleotide polymerases,dNTPs;10 mmol/L)0.5 μl、Taq酶(2×106U/L)0.5 μl和双蒸水19 μl。引物序列见表1。

表1 RT-PCR中各指标引物序列
GAPDH: glyceraldehyde-3-phosphate dehydrogenase; CTGF: connective tissue growth factor.
1.2.4 Western blot检测 在直径为100 mm的细胞培养皿中接种6 ml CF悬液,细胞密度约107/皿。CF长至70%汇合时,饥饿处理12 h,使其同步化生长。随后按照分组给予高糖和GE刺激,24 h后提取细胞中总蛋白。具体过程如下:(1)首先弃去培养基中的培养液,PBS洗3次;(2)每皿加入1 000 μl裂解液,充分震荡20 min;(3)用毛刷将皿底的细胞充分刮下,放入准备好的EP管中;(4)将收集的细胞,用超声裂解仪裂解15 s左右;(5)静置15 min后,离心0.5 h(12 000转/min);(6)取上清分装至EP管,采用紫外分光光度法测量蛋白浓度后,将所有样本的蛋白定容至等浓度;(7)分装后放入-80℃冰箱。CF总蛋白提取后,进行SDS-PAGE电泳,电泳后将凝胶中的蛋白转入PVDF膜中,一抗4℃孵育过夜,随后于羊抗兔二抗中避光孵育1 h,利用Odyssey扫膜仪对蛋白条带扫描并定量,GAPDH校正待测蛋白水平。
1.2.5 免疫荧光染色 (1)4%多聚甲醛固定;(2)0.2%的Triton破膜;(3)8%山羊血清封闭1 h;(4)一抗[包括抗SIRT1抗体和抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体]封闭过夜;(5)羊抗鼠和羊抗兔二抗共同孵育1 h;(6)DAPI染核;(7)荧光显微镜观察。
1.3 统计学处理

2 结 果
2.1 大鼠CF的鉴定
原代分离及纯化后的大鼠CF经培养12 h后,基本贴壁。倒置显微镜下可见CF呈梭形,多角型。CF细胞在培养基中呈放射状、网状及漩涡状分布。CF细胞核为圆形,胞浆透明(图1A)。波形蛋白免疫荧光显示,阳性染色细胞占比超过全视野所有细胞的95%(图1B)。
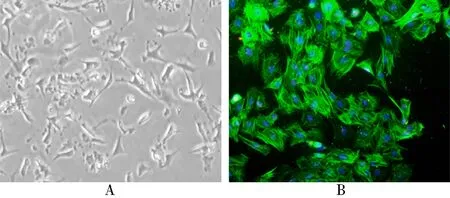
图1 大鼠左室心脏成纤维细胞鉴定
A: light mcroscope (×40); B: immunofluorescent staining of vimentin (×100)
2.2 高糖和GE对CF纤维化标志物mRNA表达的影响
RT-PCR结果显示,高糖刺激下,大鼠CF的ColⅠ、Ⅲ及CTGF mRNA表达显著升高,证明高糖能够诱导大鼠CF细胞胶原增多;不同浓度的GE处理高糖刺激后的大鼠CF 24 h后,ColⅠ、Ⅲ及CTGFmRNA表达有所降低,且随GE浓度的增加,抑制作用增强,在1~100 μmol/L之间呈现浓度依赖性(均P<0.05;图2)。
2.3 各组氧化应激标志物水平比较
使用氧化应激试剂盒对CF中氧化应激标志物进行检测,结果显示,与NC组相比,高糖模型组的SOD活性显著降低,NADPH活性和MDA产量均显著增高;而GE能够显著抑制高糖诱导的氧化应激(均P<0.05;图3)。
2.4 各组心肌纤维化信号通路相关蛋白检测
高糖刺激后,非经典的促纤维化信号通路TGF-β/ac-Smad3和α-SMA蛋白的表达水平均明显升高(P<0.05);使用GE干预后,上述促纤维化信号通路相关蛋白的表达水平明显受到抑制(P<0.05)。同时,我们检测了CF中SIRT1蛋白水平的表达,结果显示,高糖刺激后,SIRT1表达水平明显受抑制;而GE干预后,SIRT1表达水平显著上升(均P<0.05;图4)。
2.5 EX-527对GE药理作用的影响
EX-527为SIRT1抑制剂,我们用免疫荧光共染了CF中的SIRT1及α-SMA,结果表明,CF中SIRT1被GE或EX-527激活后,α-SMA表达水平明显下降(图5A)。同时利用氧化应激试剂盒再次检测了CF氧化应激水平,结果表明,在加入EX-527后,GE对高糖刺激下CF表型转化的抑制作用消失;且EX-527也可以使GE对高糖刺激下氧化应激及ac-Smad3信号通路的抑制作用消失(图5B-H)。证明了GE对高糖刺激下CF转化及胶原合成的抑制作用依赖于SIRT1。
3 讨 论
心肌纤维化是DCM主要的病理改变,极大地增加了糖尿病患者心力衰竭的发病风险[1]。CF作为心脏中主要的细胞类型之一,一旦被各组刺激因素(高糖、异丙肾上腺素、TGF-β等)激活便可合成并分泌胶原,导致心肌中ECM的沉积。此外,CF转化为表达α-SMA的肌成纤维细胞也是合成ECM的一个重要来源[2]。研究发现,高糖可通过促进心脏间质胶原沉积诱发心肌纤维化。一方面,高糖可以抑制间质内胶原的降解;另一方面,高糖又可促进胶原蛋白的糖基化,增加心脏间质中胶原的合成。因此,阻断CF的表型转化及胶原合成对干预DCM具有重要意义[11]。本研究发现,GE可以通过抑制SIRT1的表达进而阻断高糖诱导的CF表型转化及胶原合成。

图2 不同浓度GE对高糖刺激下纤维化标志物mRNA表达的影响
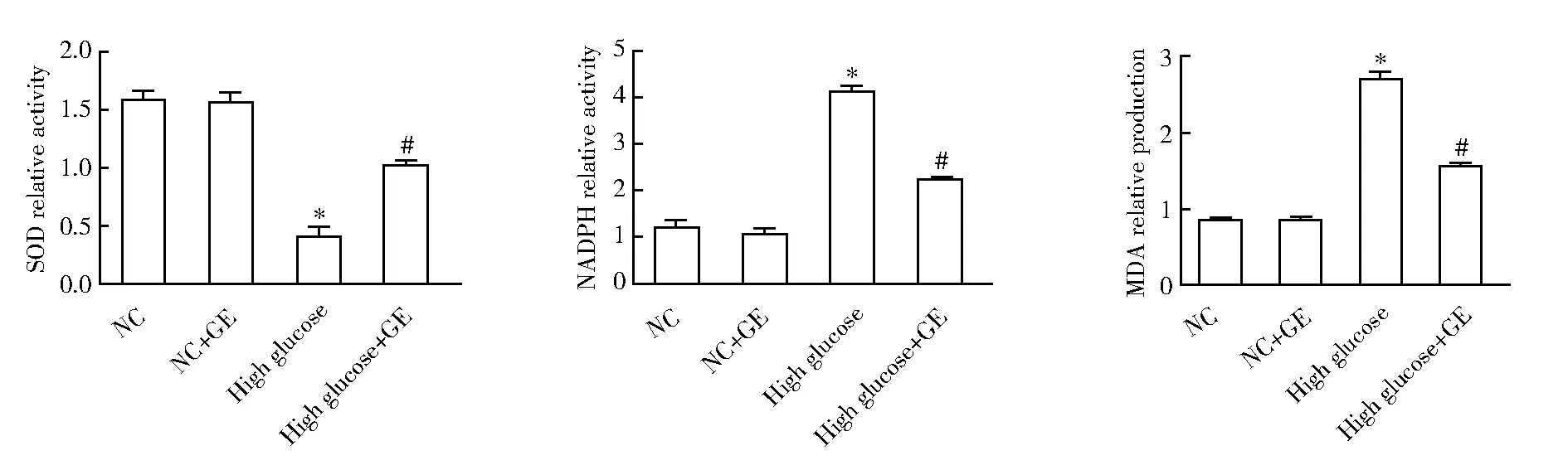
图3 各组氧化应激标志物水平比较
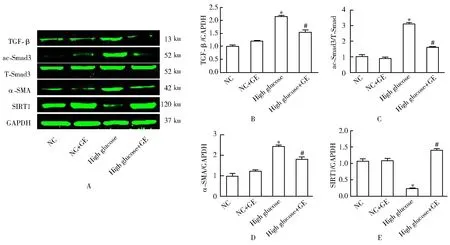
图4 GE对高糖刺激下CF中TGF-β/ac-Smad3信号通路及SIRT1蛋白表达的影响

图5 EX-527对GE药理作用的影响
传统观点认为,TGF-β/磷酸化的Smad3(phosphorylated-Smad3,P-Smad3)信号通路是经典的促心肌纤维化信号通路,在心肌纤维化的发生发展中有着至关重要的作用。此信号通路激活的基本过程如下:TGF-β与TGF-β受体Ⅱ结合后,可激活TGF-β受体Ⅰ。随后,活化的TGF-β受体Ⅰ可磷酸化Smad3。磷酸化的Smad3再与Smad4结合后入核,直接或间接地激活促纤维化相关基因[12]。最近研究发现,TGF-β刺激能够激活细胞内乙酰化酶p300的催化活性,将乙酰辅酶A的乙酰基转移到Smad3的赖氨酸氨基残端,进而对Smad3进行乙酰化修饰,调节Smad3的DNA连接酶活性或转录活性[13,14]。因此,抑制Smad3的乙酰化也是治疗心肌纤维化的关键策略之一。
在糖尿病状态下,心肌胶原代谢氧化失衡,氧化应激通过促进TGF-β的表达增加CF向肌成纤维细胞的表型转化,从而加强胶原合成、促进DCM患者心脏纤维化。因此,抑制CF氧化应激是治疗DCM的重要靶点之一[1]。Gu等[15]研究发现,上调CF中乙醛脱氢酶2(acetaldehyde dehydrogenase 2,ALDH2)的表达能明显抑制高糖诱导的CF胶原产生,其机制可能与CF中氧化应激的降低有关。
近年来,组蛋白去乙酰化酶SIRT1在纤维化疾病中的作用日益受到关注。据报道,SIRT1可通过激活TGF-β/ac-Smad3信号通路和抑制氧化应激,改善肾间质纤维化[7]。此外,SIRT1还能够降低ac-Smad4和β-catenin蛋白的表达,抑制内皮间质转化,最终抑制肿瘤转移及器官纤维化[16]。体外实验证明,虾青素可以通过激活SIRT1进而抑制Smad3的乙酰化,最终减轻压力负荷过载所致的心肌纤维化和心功能不全[2]。SIRT1在抗氧化应激中也发挥着至关重要的作用,例如SIRT1可以通过将P53的第382位的赖氨酸残基去乙酰化,抑制P53的生理活性,最终抑制细胞氧化应激所致的病理损伤[5]。这些研究结果提示,SIRT1对纤维化的发生发展及细胞的氧化应激发挥着重要的调控作用。在本研究中,我们利用高糖在体外对乳鼠CF细胞进行刺激,同时利用GE进行干预,结果发现,GE能够明显降低高糖环境中CF的氧化应激水平及各种胶原的合成,抑制Smad3的乙酰化,同时GE能够激活CF细胞中SIRT1蛋白的表达。SIRT1一旦被抑制,GE的抑纤维化作用消失,表明GE的抑纤维化作用依赖于CF细胞中SIRT1的激活。
总之,我们的研究首次证实GE能够降低高糖诱导的大鼠心肌成纤维细胞表型转化及胶原合成,这种保护作用可能与GE对CF中氧化应激及Smad3乙酰化的抑制有关,且这种抑制作用依赖于SIRT1的激活。
