大孔吸附树脂分离核桃青皮萘醌类成分及其抑菌性研究
2019-09-23刘迪宋晓宇李婧尚华杨建民
刘迪,宋晓宇,李婧,尚华,杨建民
1.陕西工业职业技术学院,陕西 咸阳 712000 2.陕西海升果业发展股份有限公司,陕西 西安 710100
核桃青皮(walnut green husk)又称青龙衣,在我国古代就因其具有镇痛、抗菌、消炎、抗肿瘤等多种功效而被入药[1-9]。核桃的果实可食用或被加工成各种核桃产品,食用或加工后的核桃会产生大量的核桃青皮废物,甚至还会污染环境。
为了对核桃青皮再次利用,本研究以核桃青皮中代表性有效成分萘醌为分离对象,采用大孔分离树脂分离响应面试验优化分离参数,同时考察核桃青皮萘醌提取物的抑菌性,为核桃青皮变废为宝提供技术参考。
1 材料与方法
1.1 材料与试剂
核桃青皮粉,购于陕西省宝鸡市,50 ℃烘箱内烘干,粉碎,经0.15 mm孔径的筛孔过滤,装袋封口,0~4 ℃冰箱保存;1,8-二羟基蒽醌标准品(含量>98%),Sigma-Aldrich公司;乙醇、甲醇、醋酸镁、二氯甲烷三氯化铁、氯化钙、氯化钠、氯化锌、双氧水、亚硫酸钠,均为分析纯;D101树脂,西安蓝晓科技新材料股份有限公司;营养琼脂培养基、蛋白胨、牛肉浸膏、氯化钠、蒸馏水、磷酸盐,均为国产生化试剂或化学试剂;大肠杆菌、金黄色葡萄球菌,由陕西科技大学生命科学与工程学院微生物试验室提供。
1.2 仪器与设备
UV-5300PC型紫外/可见分光光度计:上海元析仪器有限公司; RV8旋转蒸发仪:德国IKA公司;BT100-1L恒流泵:兰格恒流泵有限公司;AL204型电子天平:上海梅特勒-托利多仪器有限公司;无菌工作台:上海瑞宏检测技术有限公司;培养箱,上海立德泰勀科学仪器有限公司;电热手提高压蒸汽消毒锅,成都志能实验仪器有限公司。
1.3 方法
1.3.1 标准曲线的制备[10]
将1,8-二羟基蒽醌标准品在105 ℃烘箱内干燥,准确称取0.002 g标准品,用少量60%乙醇溶解,转移至10 mL容量瓶,用60%乙醇定容至10 mL,摇匀,作为标准储备液备用。准确移取标准储备液1.0、2.0、3.0、4.0、5.0 mL至25 mL比色管中,准确加入1 mL浓度为5%KOH溶液,再用60%乙醇溶液定容至25 mL;准确移取1 mL浓度为5%KOH溶液,用60%乙醇溶液定容至25 mL,作为空白对照。在530 nm下,测定不同浓度溶液的吸光度值,利用线性拟合,得到吸光度(y)与标准品浓度(x)的标准曲线,并得到回归方程。
1.3.2 粗提液的制备
称取一定量核桃青皮粉,按照1∶40(g∶mL)的料液比与60%乙醇混合,放入60 ℃水浴锅中浸提6 h,取出抽滤两次,将滤液合并在50 ℃条件下旋转蒸发浓缩,制备不同浓度的粗提液,作为树脂上柱液使用。
1.3.3 单因素试验和响应面试验
考察吸附液浓度(0.05、0.10、0.15、0.20、0.25%)、吸附液pH值(1、2、3、4、5)和吸附液流速(0.5、1.0、1.5、2.0、2.5 mL/min)对核桃青皮萘醌类成分的提取率影响;考察洗脱液浓度(10、85、90、95、100%)、洗脱液pH值(1、2、3、4、5)和洗脱液流速(0.1、0.3、0.5、0.7、0.9 mL/min)对核桃青皮萘醌类成分的洗脱率影响。选用3因素3水平,利用Box-Behnken中心组合设计原理,设计响应面试验。
1.3.4 萘醌提取物抑菌试验
1.3.4.1 供试液的制备
将核桃青皮粗提液和树脂分离提取物旋转蒸发至浸膏,分别称取0.5 g,用20 mL50%的无菌水丙酮溶液进行溶解,得到浓度为25 mg/mL的原始供试液,将原始供试液依次进行两次梯度稀释,并标记为1#、2#和3#供试液,其浓度分别为25 mg/mL,12.5 mg/mL和6.25 mg/mL。将无菌水丙酮溶液编为0#,作为空白液。
1.3.4.2 抑菌试验
分别吸取大肠杆菌供试菌液和金黄色葡萄球菌供试菌液(细菌浓度>107个/mL)0.1 mL于冷凝好的两个培养基上,用无菌刮铲涂布,平放于无菌台上20~30 min。在培养基平板后面,用记号笔划“+”,将皿底等分成四等分。在涂有大肠杆菌的培养基后面将各区标记D0#、D1#、D2#和D3#,在涂有金黄色葡萄球菌的培养基后面将各区标记P0#、P1#、P2#和P3#。剪取直径为5 mm的圆形滤纸片,分别浸入0#、1#、2#和3#供试液中,将各滤纸片按照编号分别放入各培养皿的4个区内,滤纸片应按照浓度由低到高的顺序放置。每个平板做3个平行。将培养基倒置,置于28 ℃培养箱中培养24 h,记录抑菌圈的大小。抑菌圈大小按照下式计算:
抑菌圈直径=样品菌落直径-空白菌落直径。
1.3.5 数据处理
单因素试验和体外抗氧化性试验数据均用均数±标准差(mean±S.D.)表示;响应面试验数据采用Design-Expert 8.0软件处理和分析;数据显著性分析用t-检验法检验,P<0.05被视为显著性差异,P<0.01被视为极显著性差异。
2 结果与分析
2.1 标准曲线
根据1.3.1方法,得到萘醌标准曲线如图1所示,标准曲线方程为y=124.38x-1.019,回归系数R2= 0.992 4,能够满足检测需要。
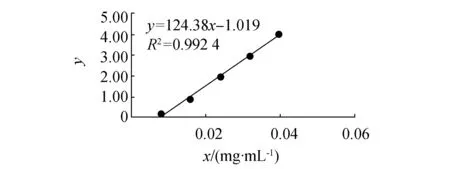
图1 萘醌标准曲线
2.2 核桃青皮萘醌提取工艺优化
2.2.1 树脂吸附单因素试验结果
树脂吸附单因素试验结果如图2所示。结果显示最优吸附条件为吸附液浓度0.10 mg/mL、吸附pH值2、吸附液流速0.5 mL/min。其中,吸附液浓度和吸附液pH值对吸附率影响,均随着单因素数值的增大而呈现先增大后减小的趋势;吸附液流速大,吸附率反而下降。吸附液浓度过小,树脂吸附不饱和,吸附率不高;浓度过大,树脂过饱和,吸附率几乎不再变化。吸附液pH值大小影响树脂吸附效果,过小或过大,均使吸附效果不能达到最大化。吸附液流速变大,树脂来不及及时吸附,从而使吸附率降低。
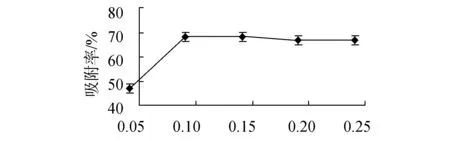
吸附液浓度 / (mg·mL-1)(a)吸附液浓度对吸附率的影响
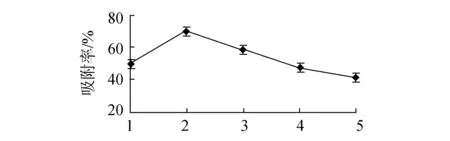
吸附液pH值(b)吸附液pH值对吸附率的影响
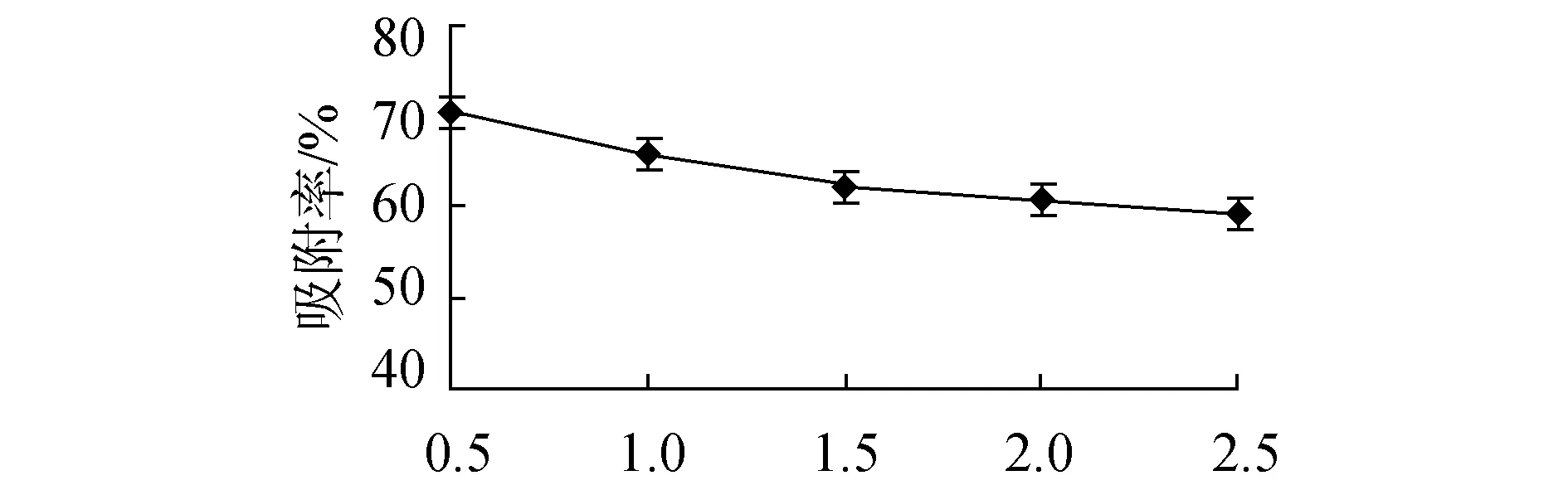
吸附液流速/ (mL·min-1)(c)吸附液流速对吸附率的影响图2 各因素对吸附率影响
2.2.2 树脂吸附响应面试验结果
响应面试验因素水平设计如表1所示,试验结果如表2、3所示。
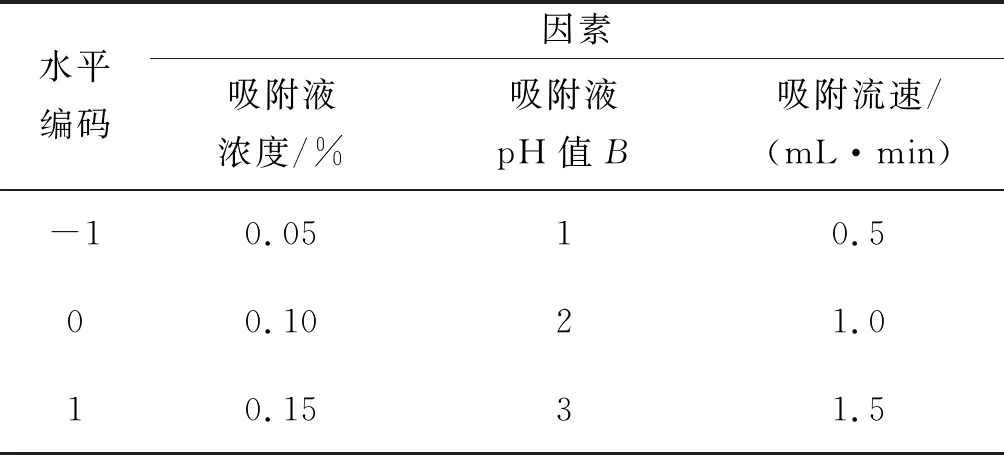
表1 树脂吸附响应面试验因素水平
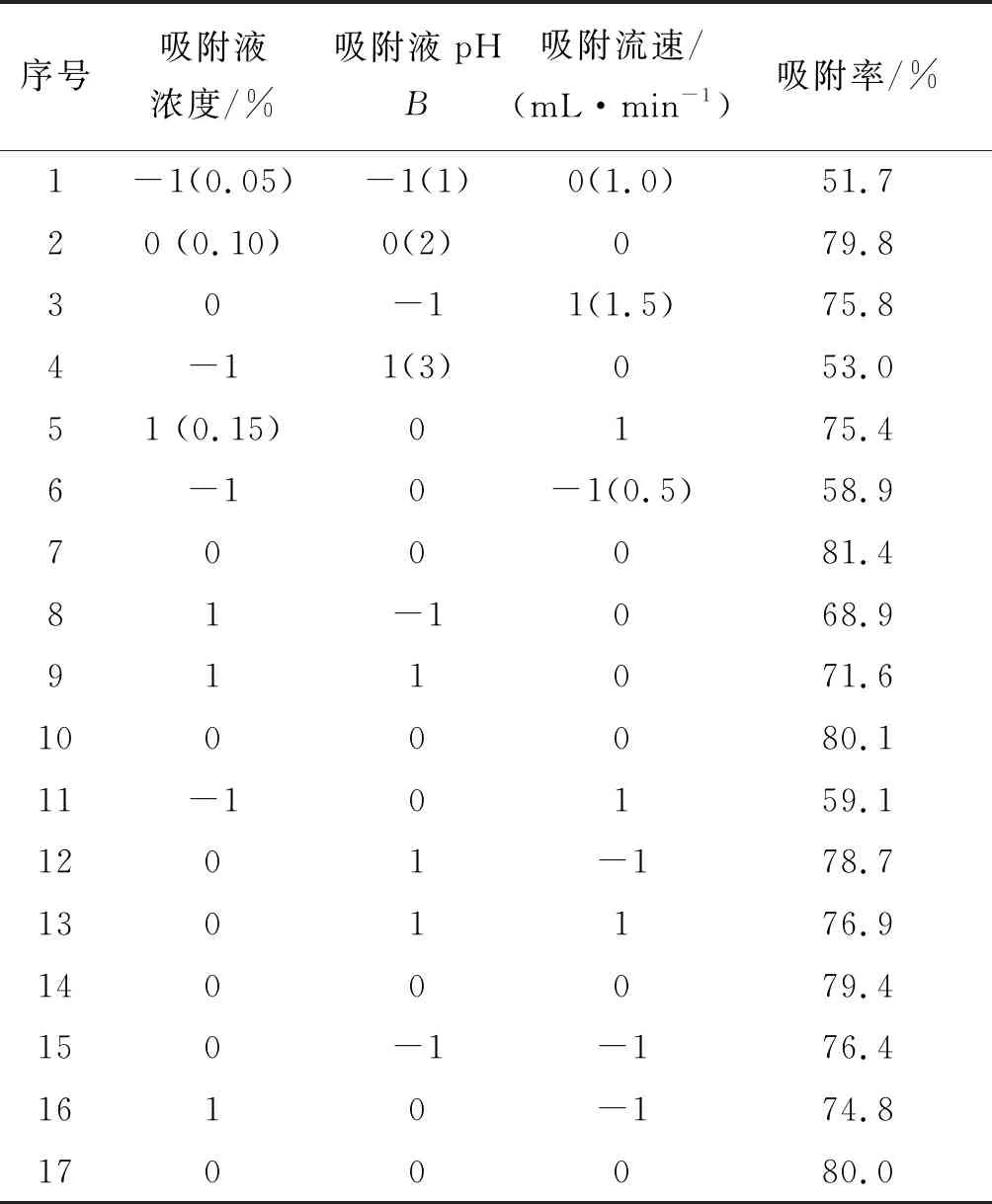
表2 树脂吸附响应面试验结果
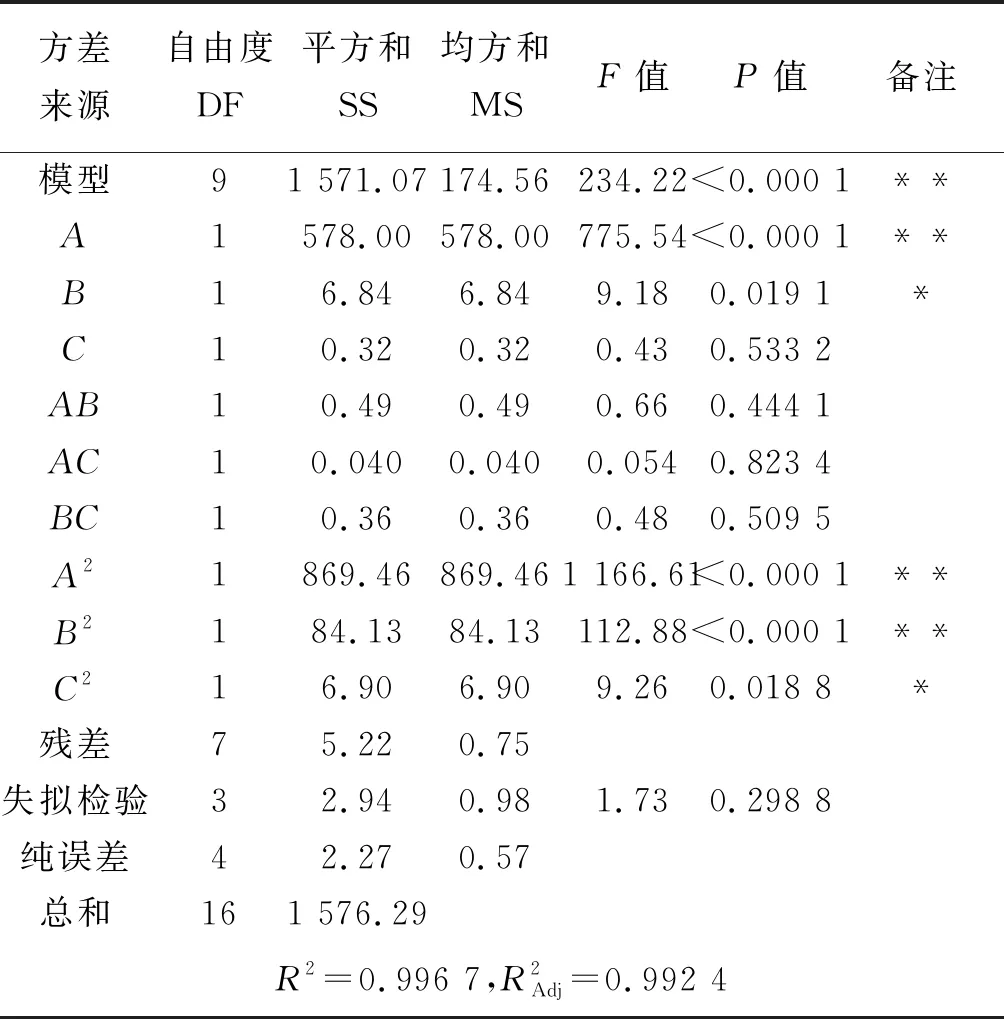
表3 树脂吸附响应面试验结果方差分析
注:*表示显著水平(P<0.05);**表示极显著水平(P<0.01)
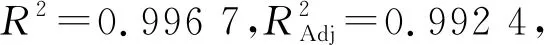
各因素的P值大小表明其对结果影响的显著性,P值数据显示,吸附液浓度的影响极显著(P<0.01),吸附液pH的影响显著(P<0.05),吸附液浓度二次方的影响极显著(P<0.01),吸附液pH二次方的影响显著(P<0.05),各因素之间吸附液浓度和吸附液pH之间的交互作用P值最小。F值显示各因素对结果影响顺序为:吸附液浓度>吸附液pH>吸附流速。
回归分析给出模型的二次回归方程为:
R=-7.95+1 301.6A+18.705B-9.84C+7.00AB+4.00AC-0.60BC-5 748.00A2-4.47B2+5.12C2
此方程对应的最佳提取条件:吸附液浓度0.11 mg/mL,吸附液pH为1.89,吸附流速0.54 mL/min,预测最大吸附率为82.11%。对最佳条件取整为:吸附液浓度0.10 mg/mL,吸附液pH为2,吸附流速0.5 mL/min,确定该条件为最佳实际操作条件,以便于工业化生产。在确定的最佳实际操作条件下平行试验3次,测得到平均吸附率为81.89%。
2.2.3 树脂洗脱单因素试验结果
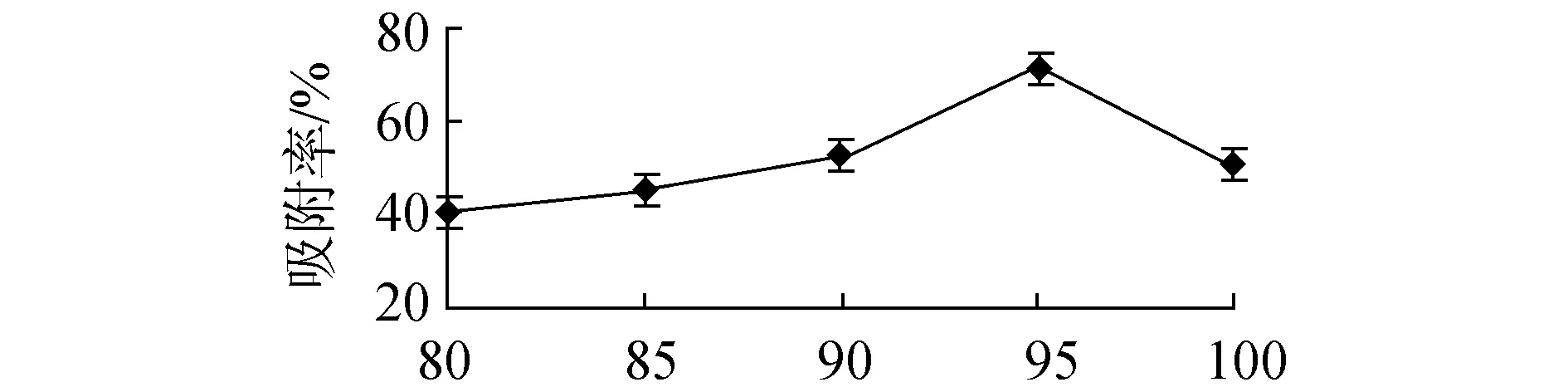
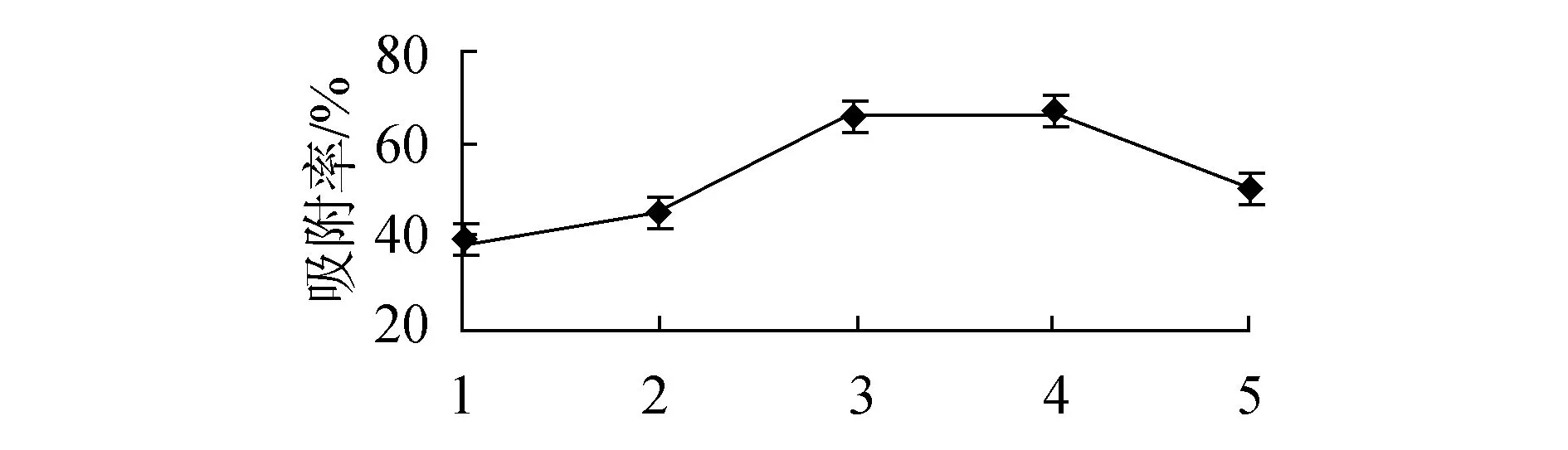
树脂洗脱单因素试验结果如图3所示。单因素试验结果显示最优洗脱条件为洗脱液浓度96%、洗脱pH值3、洗脱液流速0.5 mL/min。各因素对洗脱率影响,均随着单因素数值增大而呈现先增大后减小趋势。洗脱液浓度和pH 值大小直接影响洗脱液的极性,从而影响洗脱效果。洗脱液流速过小,洗脱液总量小,洗脱效果不佳;洗脱液流速过大,被吸附成分来不及完全被洗脱液带走,洗脱率降低。
洗脱液浓度/%(a)洗脱液浓度对洗脱率的影响
洗脱液pH值(b)洗脱液pH值对洗脱率的影响
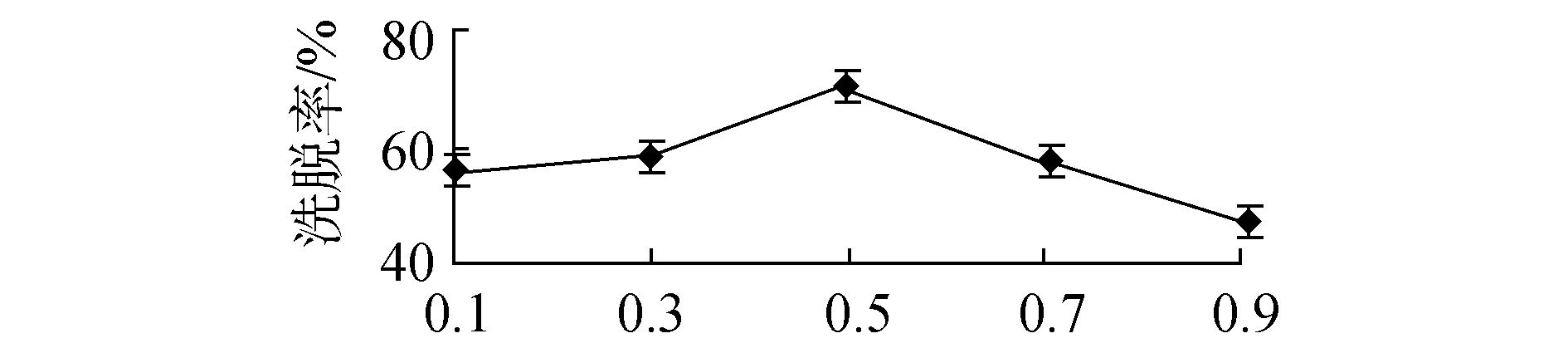
洗脱流速/(mL·min-1)(c)洗脱液流速对洗脱率的影响图3 各因素对洗脱率影响
2.2.4 树脂洗脱试验结果
响应面试验因素水平设计如表4所示,试验结果如表5、6所示。

表4 树脂洗脱响应面试验因素水平
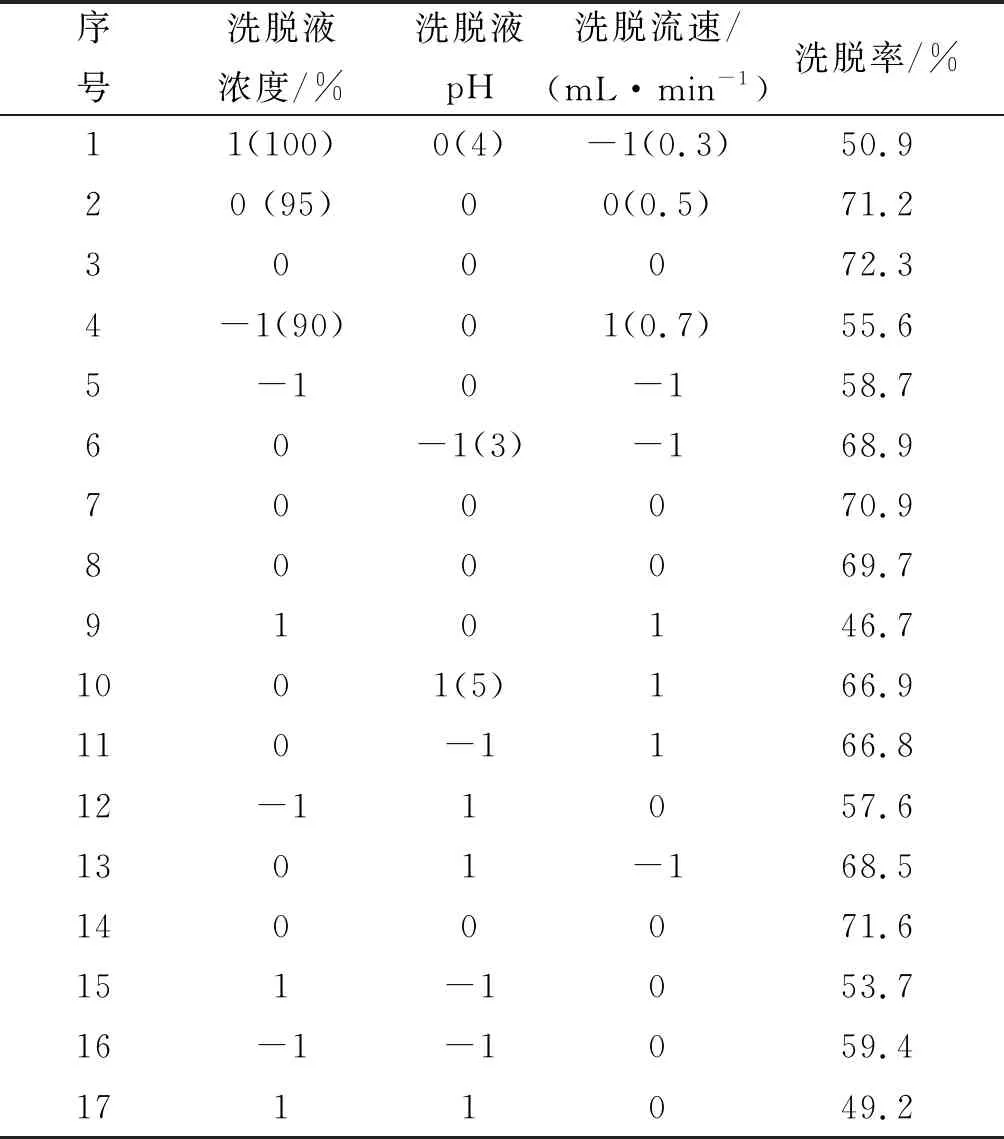
表5 树脂洗脱响应面试验结果方差分析
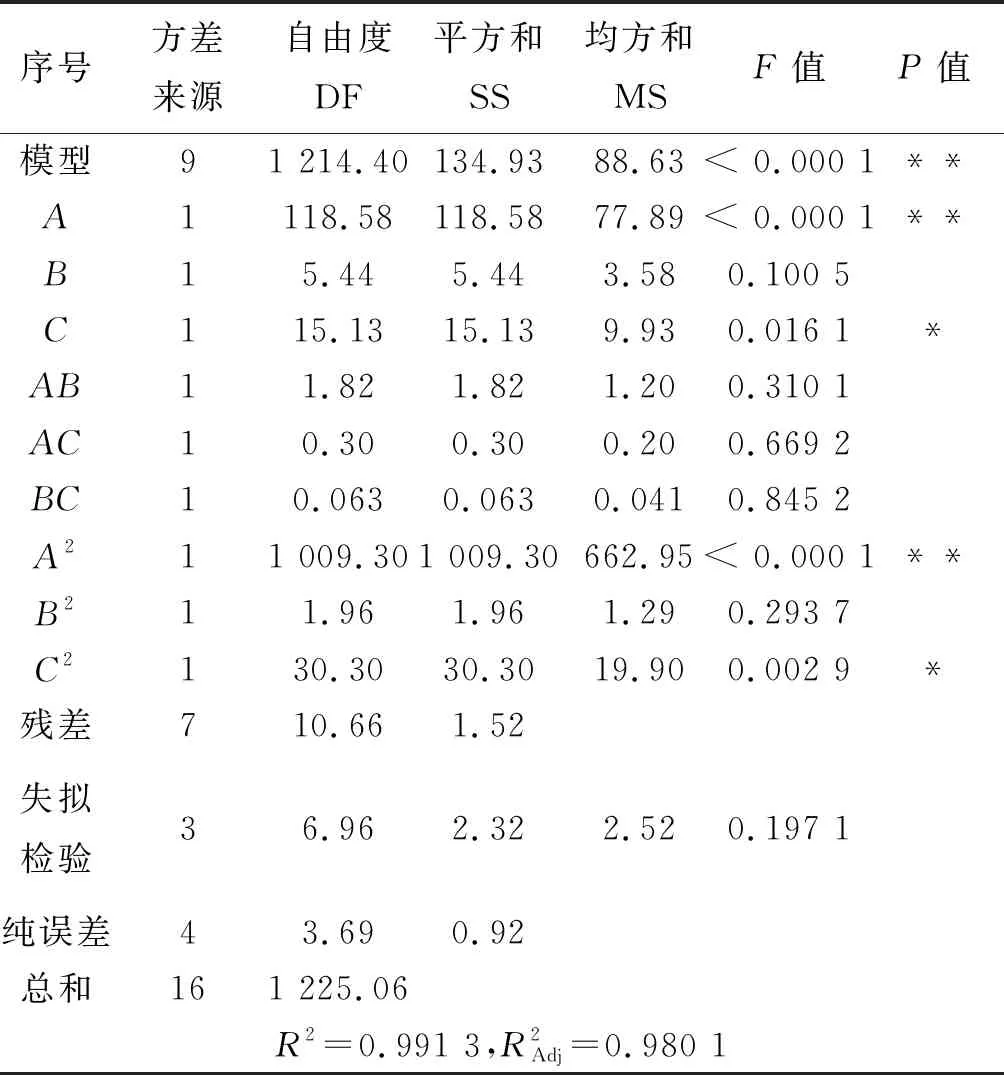
表6 树脂洗脱响应面试验结果
注:*表示显著水平(P<0.05);**表示极显著水平(P<0.01)。
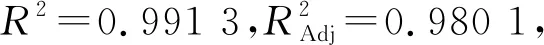
各因素的P值大小表明其对结果影响的显著性,P值数据显示,洗脱液浓度的影响极显著(P<0.01),洗脱流速的影响显著(P<0.05),洗脱液浓度二次方的影响极显著(P<0.01),洗脱流速二次方的影响显著(P<0.05),各因素之间洗脱液浓度和洗脱液pH之间的交互作用P值最小。F值显示,各因素对结果影响顺序为:洗脱液浓度> 洗脱流速>吸附液pH。
回归分析给出模型的二次回归方程为:
R=5 528.953 12+117.574 50A+17.147 50B+83.812 50C-0.135 00AB-0.275 00AC+0.625BC-0.619 30A2-0.682 50B2-67.062 50C2
此方程对应的最佳提取条件洗脱液浓度94.45%,洗脱液pH为3.43,洗脱流速0.45 mL/min,预测最大洗脱率为71.77%。对最佳条件取整为:洗脱液浓度95%,洗脱液pH为3.5,洗脱流速0.5 mL/min,确定该条件为最佳实际操作条件,以便于工业化生产。在确定的最佳实际操作条件下平行试验3次,并测得到平均洗脱率为70.63%。
2.3 萘醌提取物抗菌性试验结果
不同浓度提取物抑菌圈的大小如表7所示,同一浓度的提取物对不同菌种的抑菌能力大小如图4和图5所示。不同提取物在浓度为50 mg/mL和25 mg/mL对大肠杆菌和金黄色葡萄球菌均表现出了一定的抑菌能力,而浓度低于25 mg/mL则不可检出抑菌圈,且同一浓度下,树脂分离提取物对大肠杆菌和金黄色葡萄球菌均高于粗提物。

表7 提取物抑菌活性试验结果

图4 提取物对大肠杆菌抑菌效果

图5 提取物对金黄色葡萄球菌抑菌效果
4 结论
试验结果表明,核桃青皮萘醌类成分树脂吸附最优条件为:吸附液浓度0.1 mg/mL、吸附液pH值2、吸附流速0.5 mL/min,在此条件下吸附率可达81.89%,各因素对吸附率影响顺序为:吸附液浓度>吸附液pH>吸附流速;最优洗脱条件为:丙酮洗脱液浓度95%、洗脱液pH值3.5、洗脱流速0.5 mL/min,在此条件下洗脱率可达70.63%。各因素对洗脱率影响顺序为:洗脱液浓度> 洗脱流速>洗脱液pH;抑菌试验表明,提取物对大肠杆菌和金黄色葡萄球菌均具有明显的抑制作用,且萘醌树脂分离提取物的抑菌性高于粗提物。
