恩施市泡萝卜中乳酸菌的分离鉴定及其对品质的影响
2019-09-23魏冰倩张振东
倪 慧,王 强,魏冰倩,廖 华,张振东,郭 壮,3,*
(1.湖北文理学院食品科学技术学院,鄂西北传统发酵食品研究所,湖北襄阳 441053; 2.恩施市农业局,湖北恩施 445000; 3.恩施市公共检验检测中心,湖北恩施 445000)
泡萝卜是以萝卜为原料,浸渍在5%~8%的盐水中,依靠自身携带的乳酸菌经6~10 d发酵而成的一类蔬菜制品,因质地脆嫩和风味独特而深受消费者青睐[1-2]。传统方法生产的泡萝卜多为自然发酵,存在发酵过程中易“生花”[3]和产品质量不稳定等问题[4]。为了弥补自然发酵的不足之处,国内外研究人员尝试从泡菜水中分离乳酸菌[5-6],并将具有优良发酵特性的乳酸菌分离株应用于泡菜的生产中。侯晓艳等[7]利用短乳杆菌(Lactobacillusbrevis)、肠膜明串珠菌(Leuconostocmesenteroides)、戊糖片球菌(Pediococcuspentosaceus)和植物乳杆菌(L.plantarum)进行泡萝卜制备,发现纯种发酵可以明显地缩短发酵周期并提升产品品质。
作为湖北省唯一的少数民族自治州,恩施土家族苗族自治州境内海拔落差大、小气候特征明显且生物多样性较高,因而有华中地区“动植物基因库”之称。恩施土家族苗族自治州恩施市居民历来就有使用萝卜、豇豆和辣椒等蔬菜制作泡菜的习俗,由于地理环境的特殊性,该地制作的泡菜中可能蕴含着丰富的乳酸菌资源,然而目前关于恩施市泡菜中乳酸菌多样性研究的报道尚少。
本研究以恩施市泡萝卜为研究对象,对样品中蕴含的乳酸菌资源进行了分离鉴定,同时采用色度仪、质构仪和电子鼻等设备,对其分离株纯种发酵制备泡萝卜的品质进行了评价,以期为后续泡萝卜用乳酸菌发酵剂的开发提供菌种支持。
1 材料与方法
1.1 材料与仪器
泡萝卜 采集自恩施市菜市场;MRS培养基 青岛海博生物技术有限公司;饱和酚、氯仿、溴化十六烷基三甲基铵(hexadecyltrimethylammonium bromide,CTAB)、乙二胺四乙酸、异戊醇、乙醇、三羟甲基氨基甲烷、醋酸钠、氯化钠、十二烷基硫酸钠和碳酸钙 国药集团化学试剂有限公司;Axygen PCR 清洁试剂盒 康宁生命科学吴江有限公司;引物27F/1495R 由武汉天一辉远生物科技有限公司合成;DL15000 Maker、DL2000 Maker、10×PCR buffer、dNTP mix、r Taq酶、pMD18-T克隆载体 宝生物工程(大连)有限公司。
HBM-400B拍击式无菌均质器 天津市恒奥科技发展有限公司;DWS DG250厌氧工作站 英国Don Whitley公司;DYY-12电泳仪 北京六一仪器厂;R40-IIB2生物安全柜 中国青岛海尔;5810R台式高速冷冻离心机 德国Eppendorf公司;PTC-100PCR仪 美国Bio-Rad公司;FluorChem FC3化学发光凝胶成像系统 美国ProteinSimple公司;3-18k离心机 德国SIGMA实验室离心机股份有限公司;UltraScan PRO色度仪 美国HunterLab公司;TA.XT plus质构仪 英国SMS公司;PEN3电子鼻 德国Airsense公司。
1.2 实验方法
1.2.1 样品的采集 2017年11月于恩施州土家族苗族自治州恩施市舞阳坝菜市场和六角菜市场(109.47°N,30.3°E)采集泡萝卜样品5份,样品在采集过程中应符合以下条件:样品未经过热处理;样品无异味、无霉变;制作泡萝卜的品种为白萝卜且产地在恩施市;泡萝卜的加工地亦在恩施市[8]。从每个采样点采集泡萝卜样品约500 g装入采样袋中并置于含有冰袋的采样箱中迅速带回实验室。
1.2.2 乳酸菌的分离 使用灭菌刀和砧板将样品切碎后,加入适量生理盐水后装入无菌厌氧袋中,并使用拍击器拍击3 min。采用倍比稀释法对拍击好的样品进行稀释,取10-2、10-3、10-4和10-5四个梯度稀释液涂布于含有1.0%碳酸钙的MRS固体培养基上,于DG250厌氧工作站中37 ℃培养48 h,工作站中通入含有氮气、氢气和二氧化碳的混合气体,其体积比为85∶10∶5[9]。选择菌落数在30~300间的平皿,按照菌落大小、颜色和是否有透明圈等特点挑取单菌落,划线纯化3次后进行过氧化氢酶实验,同时进行革兰氏染色并对菌株形态进行观察,将过氧化氢酶实验为阴性而革兰氏染色为阳性的菌株定义为潜在乳酸菌菌株[10]。
1.2.3 乳酸菌的鉴定 使用CTAB法进行潜在乳酸菌菌株基因组DNA的提取[11],并以它为模板进行PCR扩增,PCR扩增靶点为16S rRNA,PCR扩增引物为27F/1495R,其中正向引物序列为5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物序列为5′-CTACGGCTACCTTCTTACGA-3′。PCR扩增体系(25 μL)为:正反引物(10 μmol/μL)各0.5 μL,模板DNA 0.5 μL,10×PCR Buffer 2.5 μL,dNTP mix 2 μL,r Taq酶0.3 μL,加超纯水至25 μL。PCR扩增程序为:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸90 s,30次循环;72 ℃延伸10 min,4 ℃保温[12]。使用1.0%琼脂糖凝胶电泳对基因组DNA和PCR扩增产物分别进行浓度和纯度的定性检测,检测合格后的PCR产物使用Axygen PCR清洁试剂盒进行清洗,清洁产物进一步连接转化后挑取阳性克隆子送往武汉天一辉远生物科技有限公司进行测序。测序公司反馈回的序列在NCBI网站(https://www.ncbi.nlm.nih.gov/)采用BLAST方法与模式菌株进行比对进而明确其种属分类地位[13]。
1.2.4 乳酸菌菌株纯种发酵泡萝卜的制备 将乳酸菌分离株接入MRS液体培养基中,37 ℃培养24 h后,再次转接入新鲜MRS液体培养基中活化两代,10000 r/min离心5 min弃上清,加入10 mL生理盐水吹打均匀备用,白萝卜切成1 cm×1 cm×5 cm条状备用。取白萝卜350 g、食盐39.5 g和煮沸冷却的水600 mL装入1 L蓝盖瓶,按照1.5×107CFU/g白萝卜的比例接入菌悬液,25 ℃发酵7 d。设置不接乳酸菌自然发酵的泡萝卜为对照组,对照组除不接入乳酸菌外,其制作工艺和配料比与乳酸菌纯种发酵组均相同。
1.2.5 泡菜水色度的测定 将发酵结束后的泡菜水10000 r/min离心5 min取上清备用。使用光阱和白板对色度仪校正后,将泡菜水装入50 mm×10 mm的石英比色皿中,采用透射模式对样品的L*(亮度)、a*(红绿度)和b*(黄蓝度)进行测定,每个样品平行测定3次[14]。
1.2.6 泡菜质构的测定 采用穿刺模式对泡萝卜的咀嚼性、脆性和硬度进行测定,其中测试模式为穿刺模式,探头为P/2柱形探头(直径为2 mm),测试前速率为1 mm/s,测试速率为5 mm/s,测试后速率为5 mm/s,压缩比为50%,最小感知力5 g[15]。每个样品取5个泡萝卜条,每个萝卜条取3个测试点。
1.2.7 基于电子鼻技术泡菜风味品质的评价 取15 mL泡菜水于电子鼻样品瓶中,55 ℃保温10 min且室温平衡10 min后,使用电子鼻进行测定,传感器清洗时间为90 s,插入时间为5 s,测试时间为60 s,进样流量为120 mL/min,内部流量为120 mL/min[16]。每个样品平行测定3次,取49、50、51 s数据求平均值。
1.3 统计分析
采用主成分分析法(principal component analysis,PCA)对泡萝卜品质进行评价。使用MEGA 7.0软件绘制系统发育树,使用SAS 9.0软件进行PCA,使用Origin 2017软件绘图。
2 结果与分析
2.1 泡菜水中乳酸菌的分离鉴定
本研究共从5份泡萝卜中分离出18株潜在乳酸菌菌株,其中17株为杆菌,1株为球菌,所有菌株在含有1.0%碳酸钙的MRS上均能形成透明圈,且菌落呈乳白色,革兰氏染色均为阳性,过氧化氢酶实验均为阴性。在对18 株潜在乳酸菌菌株基因组DNA进行提取的基础上,本研究进一步对16S rRNA基因进行了PCR扩增,同时采用琼脂糖电泳技术对其扩增产物浓度和纯度进行了检测,结果如图1所示。
由图1可知,所有泳道在1500 bp左右均出现荧光条带,条带清晰、亮度较高且无明显拖尾现象,因而所有潜在乳酸菌菌株16S rRNA基因PCR扩增成功,可用于后续清洁、连接、转化和核苷酸序列测定。本研究进一步登陆NCBI网站,将各菌株反馈后的序列采用BLAST方法进行比对,选取相似度较高且已公布的乳酸菌模式种的16S rRNA基因序列构建系统发育树,进而明确分离株的种属分类学地位,系统发育树如图2所示。
由图2可知,根据16S rRNA基因的系统发育分析,1株球菌鉴定为P.pentosaceus,而其他17株杆菌分别被鉴定为Lactobacillus的5个种,其中菌株HBUAS51059和HBUAS51060被鉴定为食品乳杆菌(L.alimentarius),菌株HBUAS51064、HBUAS51070和HBUAS51071被鉴定为L.brevis,菌株HBUAS51062和HBUAS51063被鉴定为副干酪乳杆菌(L.paracasei),菌株HBUAS51051和HBUAS51052被鉴定为发酵乳杆菌(L.fermentum),而其他8 株菌株均被鉴定为L.plantarum。由此可见,恩施地区泡萝卜中乳酸菌具有较高的多样性,且L.plantarum为其优势乳酸菌类群,占分离株总数的44.44%。根据卫生部印发的《可用于食品的菌种名单》(2016版)规定,L.alimentarius不能用于食品的加工,因而本研究进一步使用除L.alimentarius外的16株乳酸菌分离株进行了泡萝卜的纯种发酵。
2.2 乳酸菌纯种发酵泡萝卜色泽和质构的评价
本研究分别采用色度仪对泡萝卜水的色泽进行了数字化评价,同时采用质构仪对泡萝卜的质构进行了测定,结果如表1所示。
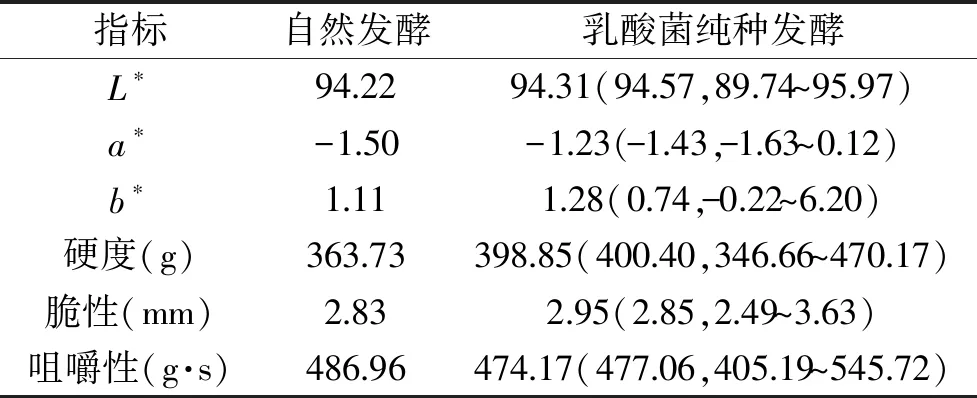
表1 不同处理泡萝卜水色度和泡萝卜质构指标的比较分析Table 1 The comparative analysis of chromaticity indexeses of radish water and texture index of pickled radish by different treatments
由表1可知,由乳酸菌纯种发酵制备的16份泡萝卜水样品的L*和a*值的中位数均大于自然发酵的泡菜水,这说明较之自然发酵,过半数乳酸菌菌株纯种发酵制备的泡萝卜水颜色偏亮和偏绿[17]。由表1亦可知,过半数乳酸菌菌株纯种发酵制备的泡萝卜硬度和脆性较之自然发酵组偏大,而咀嚼性偏小。由此可见,乳酸菌纯种发酵对泡萝卜水的色泽和泡萝卜的质地均有明显的影响,与本研究结论相同,汪立平等[18]开展了纯种L.plantarum发酵低盐萝卜泡菜的研究,结果发现在降低食盐用量的同时接入L.plantarum可保持泡菜的脆度。
2.3 乳酸菌纯种发酵泡萝卜典型风味物质的评价
在对泡菜水色泽和泡萝卜质构进行评价的基础上,本研究进一步使用电子鼻技术对不同泡萝卜水中典型风味物质的含量进行了分析,结果如表2所示。
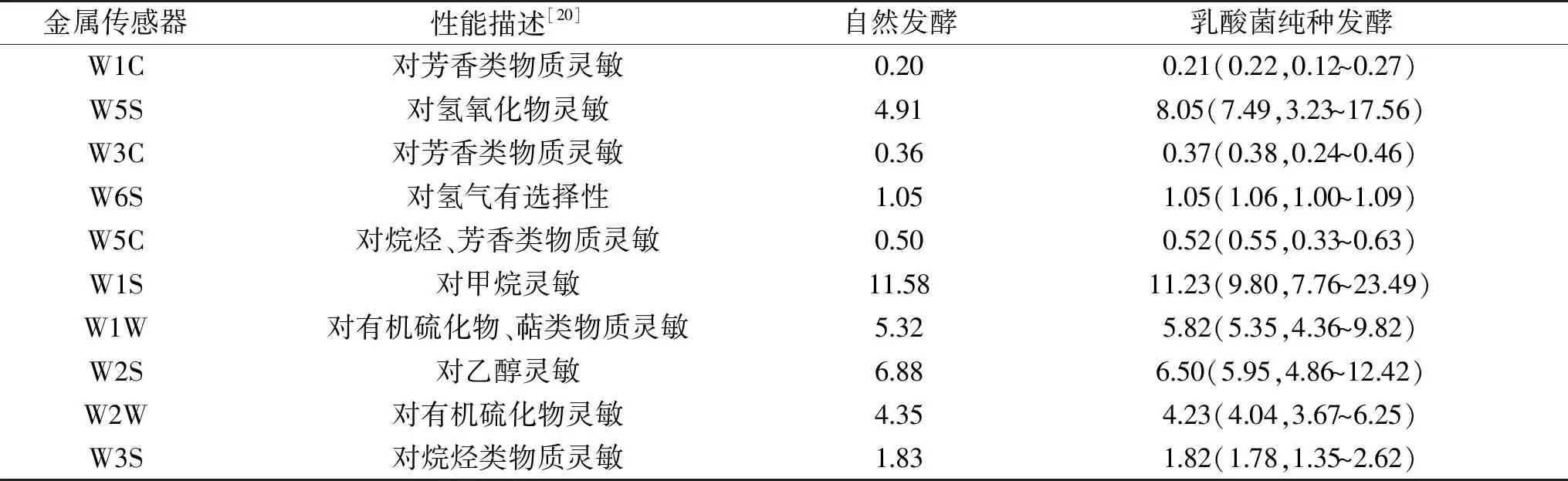
表2 不同处理泡萝卜水中典型风味物质的比较分析Table 2 The significance analysis of volatile components in radish water by different treatment
由表2可知,传感器W1C、W3C和W5C对乳酸菌纯种发酵制备的16份泡萝卜水响应值的中位数均大于自然发酵的泡菜水,而传感器W1S、W2S、W2W和W3S对乳酸菌纯种发酵制备泡萝卜水响应值的中位数均小于自然发酵的泡菜水。由于传感器W1C、W3C和W5C主要对芳香类物质敏感,而传感器W6S、W1S、W2S、W2W和W3S主要对氢气、甲烷、乙醇、有机硫化物和烷烃类物质敏感[20],因而接种多数乳酸菌菌株进行纯种发酵可明显提升泡萝卜水挥发性风味物质中的芳香类物质,进而改善泡菜的风味品质。沈菲儿[19]研究结论与本研究相同,其发现乳酸菌纯种发酵的莲藕泡菜风味品质优于自然发酵,且纯种发酵的莲藕泡菜挥发性风味物种中醇类、醛类、烃类、酸类和烯类相对含量显著增高。
2.4 基于主成分分析(PCA)乳酸菌纯种发酵泡萝卜品质
本研究基于PCA,采用降维的方法对乳酸菌纯种发酵泡萝卜的品质进行了进一步评价,第一主成分(principal component 1,PC1)、PC2、PC3和PC4的贡献率分别为42.44%、22.34%、11.70%和10.27%,前4个主成分的累计方差贡献率为86.75%。PC1由W1C、W5S、W3C、W5C和W2S 5个风味指标构成;PC2由W1W、W2W、L*和b*4个指标构成;PC3由脆性和咀嚼性2个质构指标构成;PC4由W6S、W1S、W3S、硬度和a*5个指标构成。较之色泽,消费者可能更为关注泡萝卜的质地,因而本研究选取PC1和PC3进行了因子载荷图的绘制,结果如图3所示。
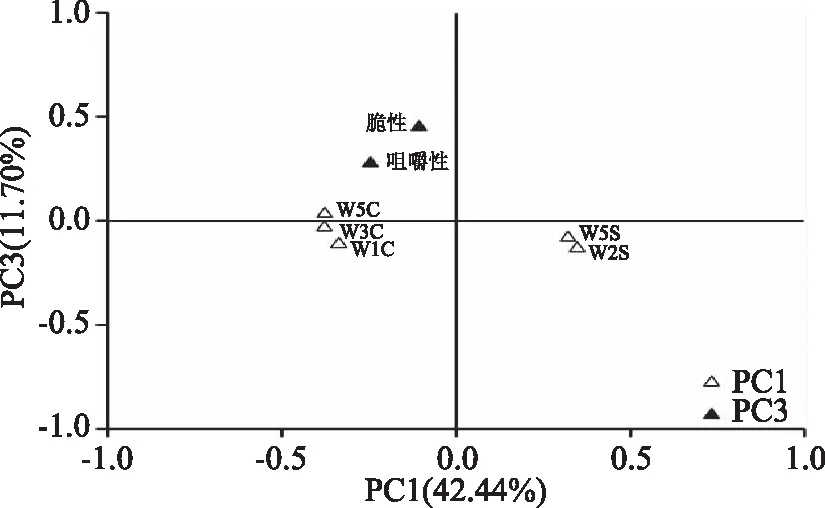
图3 基于PCA的乳酸菌纯种发酵泡萝卜品质的因子载荷图Fig.3 Factor loading diagram of product quality of pickled radish by pure breed fermentation of lactic acid bacterial strains based on PCA
由图3可知,PC1中W5S和W2S两个风味缺陷型指标偏向X轴正方向,W1C、W3C和W5C三个风味特征性指标偏向X轴负方向,PC3中脆性和咀嚼性指标偏向Y轴正方向,因而在因子得分图中越偏向左上方的样品其品质越佳,即排布于第二象限的样品其品质最佳,排布于第一、三象限的次之,而排布于第四象限的品质最差。基于PC1和PC3的因子得分图如图4所示。
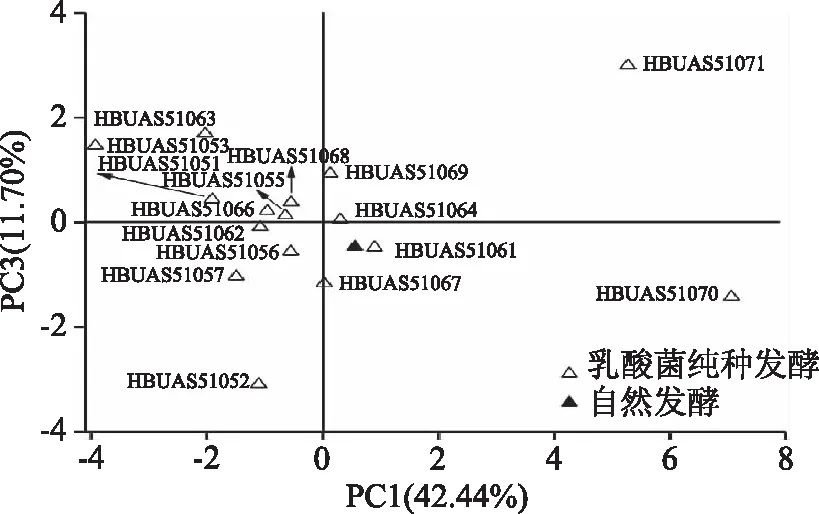
图4 基于PCA的乳酸菌纯种发酵泡萝卜品质的因子得分图Fig.4 Factor score diagram of product quality of pickled radish by pure breed fermentation of lactic acid bacterial strains based on PCA
由图4可知,不同乳酸菌分离株纯种发酵制备的泡萝卜样品在空间排布上较为分散,在4个象限均有分布,这说明不同菌株间的发酵特性差异较大,其中多数样品的空间排布较自然发酵组偏左上方,因而这进一步证实了乳酸菌纯种发酵可明显提升多数泡萝卜的品质。由图4亦可知,菌株L.paracaseiHBUAS51063和L.plantarumHBUAS51053纯种发酵制备的泡萝卜样品最偏左上方,因而该两株菌具有相对较佳的发酵特性,可进一步用于后续泡菜用乳酸菌菌株的筛选。
3 结论
采用传统微生物学和分子生物学手段相结合的方法对恩施地区泡萝卜中乳酸菌的多样性进行了解析,发现其乳酸菌隶属于2个属和6个种,具有较高的生物多样性,且L.plantarum为优势乳酸菌。在使用L.plantarum纯种发酵泡萝卜的基础上,使用电子鼻和质构仪对其品质进行了评价,结果发现通过提升多数泡萝卜水挥发性风味物质中的芳香类物质及泡萝卜的硬度和脆性,L.plantarum纯种发酵可明显改善泡萝卜的品质,其中菌株L.paracaseiHBUAS51063和L.plantarumHBUAS51053具有相对较佳的发酵特性,可进一步用于后续泡菜用乳酸菌菌株的筛选。
