青海藜麦资源酚类物质及其抗氧化活性分析
2019-09-23党斌
党 斌
(青海大学农林科学院,青海省青藏高原农产品加工重点实验室,青海西宁 810016)
藜麦(ChenopodiumquinoaWilld.)又称南藜麦、藜谷、奎奴亚藜等,是一种藜科藜属的双子叶假谷物,发源于南美洲的安第斯山脉,具有5000~7000多年的食用和种植历史,是印加土著居民的主要传统食物,有“粮食之母”的美称[1-2]。藜麦种子颜色主要有黑、红、白几种颜色,其中黑、红色的籽粒较小,白色口感较好[2]。藜麦在1980年代被美国宇航局用于宇航员的太空食品,联合国粮农组织认为藜麦是一种单体植物,可满足人体基本营养需求的食物,正式推荐藜麦为最适宜人类的完美全营养食品。联合国将2013年宣布为国际藜麦年,以促进人类营养健康和食品安全,实现千年发展目标,各国均加强了对藜麦的研究和开发[3-6]。我国自上世纪末引入以来,藜麦在我国发展迅速,不但种植面积逐渐扩大,主要分布于山西、吉林、甘肃、青海和西藏等地区,在四川、广东、吉林、河北等地也有大面积的种植[7-8]。由于引进资源混杂,资源之间在营养功能成分含量方面的差异不明确,品种退化严重,亟需筛选出营养品质优异、功能特异的种质资源。
藜麦营养丰富合理,满足了人们追求更营养更健康的消费需求,符合大健康产业的发展要求,具有很大的开发潜力,开发营养功能全面的藜麦食品是其未来发展的方向,功能性藜麦新品种的选育是基础[7,9-13]。目前针对藜麦营养成分已开展大量研究,藜麦蛋白质、脂肪酸、矿物质、维生素、膳食纤维等营养物质丰富,氨基酸组成和比例均衡,可满足人体日常需要。藜麦高蛋白、低热量、活性物质丰富的特点使其有助于辅助免疫、预防肥胖,改善心血管疾病、糖尿病、癌症等疾病,因此藜麦受到了科学家和消费者的广泛关注[14-16]。赵亚东等[8]、Woldemichael等[17]的研究发现藜麦种子中含有很高的皂甙(20%~30%)。研究表明,藜麦种子及新芽中有较多的总多酚,具有良好的体外抗氧化活性[18-20]。藜麦还含有大多水果蔬菜中含量很少且具有抗菌消炎、抗突变、降压等功效的异黄酮,是人体和动物重要的外源性功能化合物[21]。藜麦的这些活性成分,能够预防治疗疾病,对于维持人类身体健康具有十分重要的作用。但功能成分含量及活性高的藜麦品种缺乏,开展高活性藜麦资源的筛选尤为重要。
基于此,本研究以收集的90份青海藜麦资源为研究对象,比较分析青海藜麦资源的酚类物质含量(主要包括游离酚、结合酚、游离黄酮、结合黄酮)及其抗氧化活性,进一步明确不同藜麦资源酚类物质含量及其抗氧化活性差异,筛选出酚类物质含量高或抗氧化活性强的优异藜麦资源,为高活性藜麦资源的筛选及功能性藜麦新品种的选育提供科学指导。
1 材料与方法
1.1 材料与仪器
藜麦 青海大学农林科学院作物育种栽培研究所提供(见表1),所有材料于2015年春在青海省农林科学院试验田(西宁)统一进行种植,试验设3次重复,随机区组排列。收获后从精选种子中按四分法各取500 g种子为分析样品,藜麦粉采用高速粉碎机粉碎过60目筛,备用;DPPH(1,1-二苯基-2-三硝基苯肼)、TPTZ(三吡啶三吖嗪)、Trolox(水溶性维生素E)、ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)、没食子酸、芦丁标准品 纯度≥98.0,购自上海源叶生物科技有限公司;福林酚(优级纯)和齐墩果酸标准品 购自北京索莱宝科技有限公司;甲醇、乙醇、冰乙酸、丙酮、高氯酸、过硫酸钾、三氯化铁、无水醋酸钠等 均为国产分析纯。
表1 试验材料Table 1 Experiment varieties
HH-4型数显恒温水浴锅 国华电器有限公司;TGL-20M型低速冷冻离心机 湖南湘仪有限公司;N4S型紫外可见分光光度计 上海仪电分析仪器有限公司;KQ-500DE型数控超声波清洗器 昆山市超声波仪器有限公司;R-215型旋转蒸发仪 瑞士布奇有限公司;FW200型高速粉碎机 天津华鑫仪器厂。
1.2 实验方法
1.2.1 藜麦中游离酚与结合酚的提取及总酚、总黄酮含量测定 藜麦游离酚和结合酚的提取参考Yang等[22]的方法。
1.2.1.1 藜麦游离酚提取液的制备 准确称取1.0 g藜麦粉,按照料液比1∶20比例加入体积分数70%的丙酮,于35 ℃及功率450 W条件下超声提取25 min,4000 r/min冷冻离心10 min,收集上清液,残渣用同样的方法重复提取2次,合并三次提取上清液即为游离酚提取液,45 ℃旋转蒸发至干后用甲醇转移定容至10 mL,-20 ℃避光保存备用。
1.2.1.2 藜麦结合酚提取液的制备 向提取游离酚后的残渣中加入30 mL正己烷振荡后2000 r/min离心5 min弃去上清液,加入20 mL体积分数11%的硫酸甲醇溶液提取试剂,75 ℃水浴1 h,pH调至2,加入30 mL乙酸乙酯萃取5次,3 000 r/min离心5 min后合并乙酸乙酯萃取相,45 ℃旋转蒸发至干后用甲醇转移定容至10 mL,过0.45 μm有机滤膜后即得藜麦结合酚提取液,-20 ℃避光保存备用。
1.2.1.3 总酚含量测定 采用Folin-Ciocalteu法,以没食子酸为标准品,总酚含量以每100 g提取物(干基)中所含相当于没食子酸的质量mg表示[23],以没食子酸浓度为横坐标,A765值为纵坐标绘制标准曲线,回归方程为Y=0.0042X+0.0124(0~300 μg/mL,R2=0.9996)。
1.2.1.4 总黄酮含量的测定 采用硝酸铝比色法,以芦丁为标准品,A510值为纵坐标绘制标准曲线,回归方程为Y=0.0055X-0.0047(0~80 μg/mL,R2=0.9947);总黄酮含量以每100 g提取物(干基)中所含相当于芦丁的质量mg表示,单位为mg GAE/100 g DW。
1.2.2 藜麦酚类物质体外抗氧化试验
1.2.2.1 标准曲线的制作 DPPH自由基清除能力以Trolox为标准物,517 nm处测吸光值,绘制标准曲线并进行回归处理,得回归标准曲线方程为Y=-0.0042X+0.9163(0~140 μmol/L,R2=0.9928)。样品的DPPH·清除能力以每100 g提取物(干基)中所含相当于水溶性维生素E的量(μmol Trolox Eq/100 g DW)表示。
FRAP抗氧化能力以Trolox作为标准品,在波长593 nm下测定吸光度,绘制标准曲线,得回归方程:Y=0.0072X-0.0012(0~300 μmol/L,R2=0.9992)。样品的FRAP抗氧化能力以μmol Trolox Eq/100 g DW表示。
ABTS+·清除能力以Trolox为标准物,734 nm处测吸光值,绘制标准曲线并进行回归处理,得回归标准曲线方程为Y=-0.001X+0.6242(0~300 μmol/L,R2=0.9907)。样品的ABTS+·清除能力以μmol Trolox Eq/100 g DW表示。
1.2.2.2 DPPH·清除能力、FRAP抗氧化能力及ABTS+·自由基清除能力 均参考Yang等[22]的方法。
A.DPPH·清除能力测定:吸取从1 g藜麦粉中提取的游离酚或结合酚样品提取液1 mL于试管中,再加入4.5 mL 0.1 mmol/L DPPH甲醇溶液,充分摇匀后避光反应30 min,以甲醇代替样品提取液为空白调零,在波长517 nm下测定吸光度,重复三次。根据标准曲线计算DPPH·清除能力。计算公式为:DPPH·清除能力(μmol Trolox Eq/100 g DW)=[(Y×V)/(1000×M)]×100。
其中:Y为标准曲线计算出的DPPH·清除能力(μmol/L);V为提取液的总体积(mL);M为样品干重(g)。
B.FRAP抗氧化能力测定:FRAP工作液的配制:为300 mmol·L-1pH3.6的醋酸钠缓冲液(3.0762 g C2H3NaO2·加20 mL C2H4O2,用蒸馏水定容至250 mL)、10 mmol·L-1TPTZ溶液(0.1562 g TPTZ 用40 mmol·L-1盐酸定容至100 mL)和20 mmol·L-1FeCl3溶液,按照体积比为10∶1∶1 的比例混合,于37 ℃水浴锅中预热备用。
测定方法:吸取样品提取液50 μL于试管中,再加入4.5 mL FRAP工作液,充分摇匀后避光反应30 min,以甲醇代替样品提取液为空白调零,在波长593 nm下测定吸光度,重复三次。根据标准曲线计算出样品提取液铁还原能力,以μmol Trolox Eq/100 g DW表示。计算公式为:FRAP铁还原能力(μmol Trolox Eq/100 g DW)=[(Y×V)/(1000×M)]×100
其中:Y为标准曲线计算出的FRAP铁还原能力(μmol/L);V为提取液的总体积(mL);M为样品干重(g)
C.清除 ABTS+·能力测定:ABTS+·工作液的配制:将5 mL 7 mmol/L ABTS+·溶液和88 μL 140 mmol/L过硫酸钾溶液混合,室温避光条件下静置12~16 h,得ABTS+·储备液。将此储备液按适当比例1∶100 (V/V)与无水甲醇混合,要求其在734 nm下的吸光值达到0.70±0.02,得到ABTS+·工作液,备用。
测定方法:吸取样品提取液200 μL于试管中,再加入4 mL ABTS+·工作液,充分摇匀后避光反应30 min,以甲醇代替样品提取液为空白调零,在波长734 nm下测定吸光度,重复三次。根据标准曲线计算出样品提取液清除ABTS+·能力,以μmol TE/100 g DW表示。
计算公式为:ABTS+·清除能力(μmol Trolox Eq/100 g DW)=[(Y×V)/(1000×M)]×100。
其中:Y为标准曲线计算出的ABTS+·自由基清除能力,μmol/L;V为提取液的总体积,mL;M为样品干重,g。
1.2.3 利用SPSS 21.0软件进行相关分析、聚类分析,采用欧氏距离平方法和组间连接聚类法进行聚类分析),绘制聚类分析树状图。
1.3 数理统计
试验结果以“平均值±标准差” 表示。采用Excel 2017软件对数据进行整理与分析;利用SPSS 21.0软件进行方差分析(ANOVA),多重比较采用LSD法进行差异显著性分析,并用该软件完成检测指标间的相关性分析和基于全部检测指标的聚类分析。差异显著性水平表示方法:显著(P<0.05);极显著(P<0.01)。
2 结果与分析
2.1 不同藜麦酚类物质含量分析
2.1.1 不同藜麦酚类物质含量描述性分析 由表2可知,不同藜麦酚类化合物含量均存在较大差异,且不同藜麦资源结合酚类物质含量差异较大,游离酚类物质含量相对较小。其中参试藜麦结合黄酮含量平均为10.08 mg/100 g,变幅为1.32~33.44 mg/100 g,变异系数达62.49%,50%以上的参试藜麦结合黄酮含量高于平均值,且参试藜麦中sy-13、sy-28、LM1-118的结合黄酮含量分别达33.44、27.37、24.67 mg/100 g。结合酚含量的变异系数为52.12%,平均含量为255.52 mg/100 g,53.78%的参试藜麦结合酚含量低于平均值,其中sy-13、sy-22、sy-28和sy-34的结合酚含量达634.33、607.98、646.58、647.42 mg/100 g。游离黄酮含量均值为69.96 mg/100 g,游离酚含量平均为442.19 mg/100 g,变异系数分别为23.40%、14.05%,不同藜麦资源间差异较小。50%以上的参试藜麦资源游离酚类物质含量高于平均值,其中LM1-56和sy-24的游离黄酮含量分别达106.1、111.54 mg/100 g;LM2-10、LM1-76和sy-24的游离酚含量分别达557.03、593.20、601.22 mg/100 g。
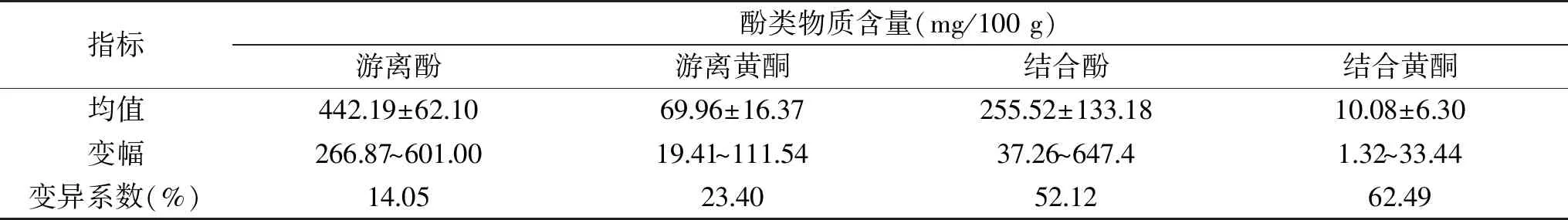
表2 不同藜麦功能成分含量分析Table 2 Analysis of functional components content of different quinoas
酚类物质是植物中含量最多的次生代谢产物,目前国内外相关学者已证实植物中酚类物质种类、含量及活性受到籽粒颜色和基因型的影响,酚类物质在不同品种、不同生态条件均会导致其种类和含量相差很大[24-25]。本研究中参试藜麦的多酚种类丰富,不同资源间含量差异较大,主要是不同藜麦资源间的基因型差异导致的。且藜麦中的酚类物质含量均高于王黎明等[13]研究报道,这与参数藜麦的生产环境有关,相关研究报道,酚类物质含量的累积受栽培环境的综合影响,其中光是影响植物多酚含量的重要非生物因素[26],参试藜麦种植于青海高原,日照长,有利于酚类物质的合成、累积,这是导致参数藜麦酚类物质含量较高的原因。
2.1.2 不同粒色藜麦酚类物质含量比较分析 由表3可知,不同粒色藜麦之间游离酚类物质含量相对一致,结合酚类物质含量差异较大,变异系数均达到45%以上。红色藜麦的游离酚和游离黄酮含量最高,且红色藜麦资源间的变异系数较小,其中游离酚含量在386.09~557.03 mg/100 g之间,游离黄酮含量在55.69~99.20 mg/100 g之间。白色藜麦的游离酚类物质含量均最低,其结合酚和结合黄酮含量最高,且白色藜麦资源间的变异系数高达53.68%、68.67%,结合酚含量在109.37~646.58 mg/100 g之间,结合黄酮含量在1.33~33.44 mg/100 g之间。红色藜麦的结合酚类物质含量均最低。可见,藜麦中游离酚类物质含量较丰富,种类多样,这与相启森等人研究结果一致[3-4]。
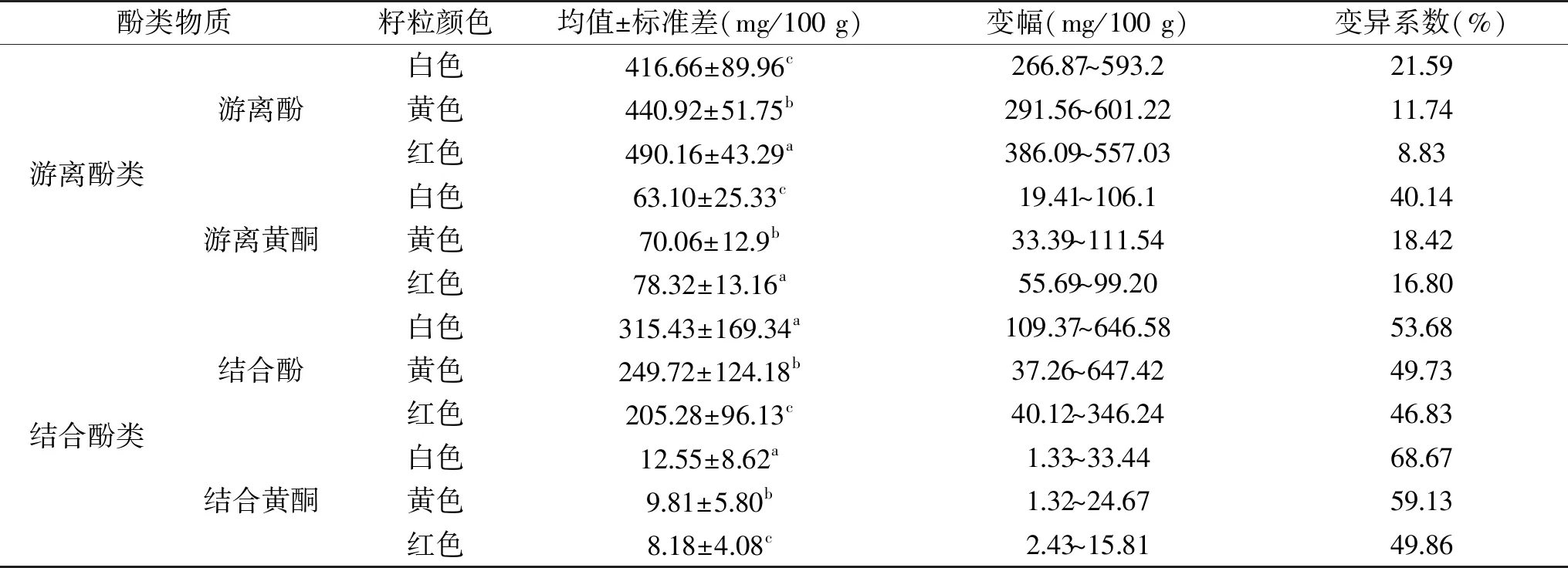
表3 不同粒色藜麦的功能成分含量分析Table 3 Analysis of functional components of different grain colors quinoa
2.2 不同藜麦酚类物质抗氧化活性分析
2.2.1 不同藜麦酚类物质抗氧化性分析 从图1可以看出,90份参试藜麦中的酚类化合物均具有较强的抗氧化活性,且结合酚类物质在清除DPPH·、ABTS+·及FRAP还原能力方面存在明显差异。结合酚类具有较强的清除DPPH·、ABTS+·能力,分别达4732.56、3371.97 μmol Trolox Eq/100 g DW;游离酚类的FRAP还原能力相对较强,达1408.64 μmol Trolox Eq/100 g DW。Hirose等[27]报道藜麦中的酚类物质具有抗氧化功能,且总多酚含量与其DPPH自由基清除能力呈显著正相关,这与本研究结果一致。
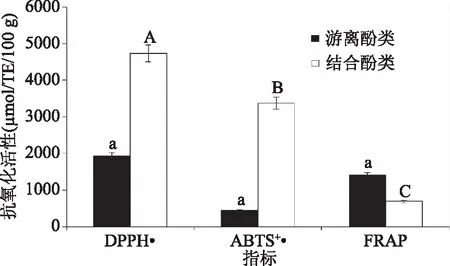
图1 不同藜麦酚类物质抗氧化活性Fig.1 Antioxidant activity of phenols in different quinoas注:不同小写、大写字母分别表示参试藜麦间游离酚类、 结合酚类化合物抗氧化差异显著(P<0.05)。
2.2.2 不同粒色藜麦酚类物质抗氧化性比较分析 不同粒色参试藜麦的酚类物质清除DPPH·能力较强(见图2),且结合酚类物质DPPH·清除能力优于游离酚物质。白色、黄色藜麦的结合酚类物质清除DPPH·能力显著高于红色藜麦,分别达4657.41、5065.66 μmol Trolox Eq/100 g DW;不同粒色参试藜麦的游离酚类物质清除DPPH·能力差异不显著,黄色藜麦相对较高(2089.23 μmol Trolox Eq/100 g DW),白色红色藜麦相对较低。杨希娟等[28]报道4种颜色组青稞的结合态酚类提取物的DPPH·清除能力显著高于游离态提取物。延莎等[29]对不同米色小米多酚提取物的含量及体外抗氧化试验表明,米色与小米中多酚的含量及其抗氧化活性关系不大。本研究结果表明结合态酚类物质具有较强的DPPH·清除能力,且红色藜麦的DPPH·清除能力最弱;而红色藜麦的游离酚和游离黄酮含量最高,白色、黄色藜麦的结合酚和结合黄酮含量最高,说明结合态的酚类物质与其DPPH·清除能力密切相关,参试藜麦的DPPH·清除能力主要与结合态酚类物质含量有关,与籽粒颜色关系不大,这与前人的研究结果一致。
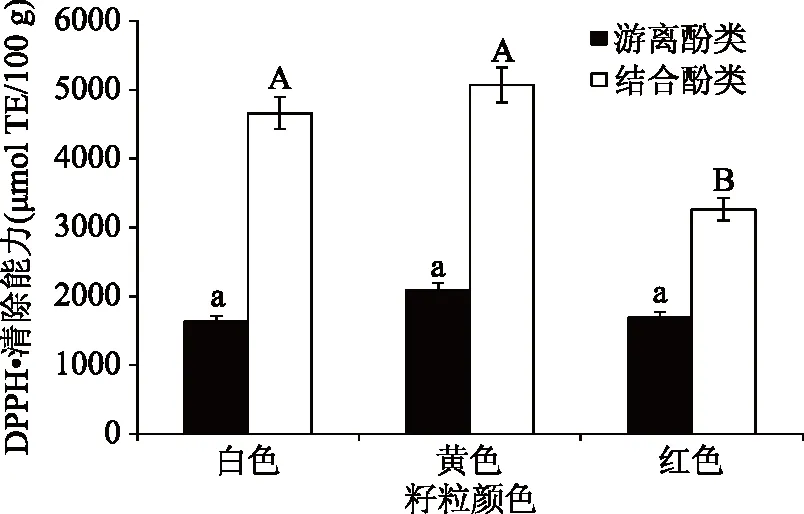
图2 不同粒色藜麦酚类物质DPPH·清除能力Fig.2 The DPPH· scavenging ability of phenols in different colors of quinoas注:不同小写、大写字母分别表示不同粒色藜麦间游离酚类、 结合酚类化合物抗氧化差异显著(P<0.05);图3、图4同。
红色、黄色藜麦结合酚类物质清除ABTS+·能力较强,差异显著(P<0.05),游离酚类清除ABTS+·能力均较弱,差异不显著(见图3)。其中白色、黄色藜麦的结合酚类物质清除ABTS+·能力分别为3532.37、3350.72 μmol Trolox Eq/100 g DW;红色藜麦较弱,为487.49 μmol Trolox Eq/100 g DW。这可能与不同粒色藜麦中不同形态的酚类化合物中单体多酚组成及含量有关,不同单体酚对不同自由基的清除具有选择性[30]。
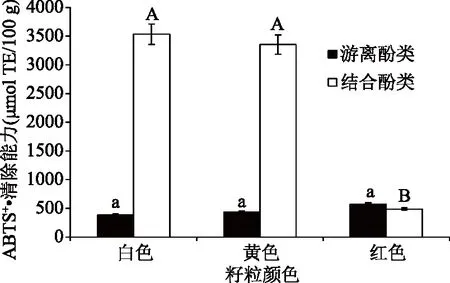
图3 不同粒色藜麦酚类物质ABTS+·清除力Fig.3 The ABTS+· scavenging ability of phenols in different colors of quinoas
从图4可知,不同粒色参试藜麦的结合酚类物质FRAP还原能力差异显著(P<0.05),游离酚类FRAP还原能力差异不显著。红色藜麦的酚类物质FRAP铁还原力最强(3264.42 μmol Trolox Eq/100 g DW),白色和黄色藜麦次之,分别为869.05、683.2μmol Trolox Eq/100 g DW。谷物中酚类物质抗氧化活性的相关报道[31-32]表明,游离态酚类物质的FRAP铁离子还原能力远远强于结合态酚类物质,这与本研究结果一致。红色藜麦的FRAP铁离子还原能力最强,同时其游离态酚类物质含量最高,红色藜麦的FRAP铁离子还原能力强弱与其游离态酚类物质含量高低一致。
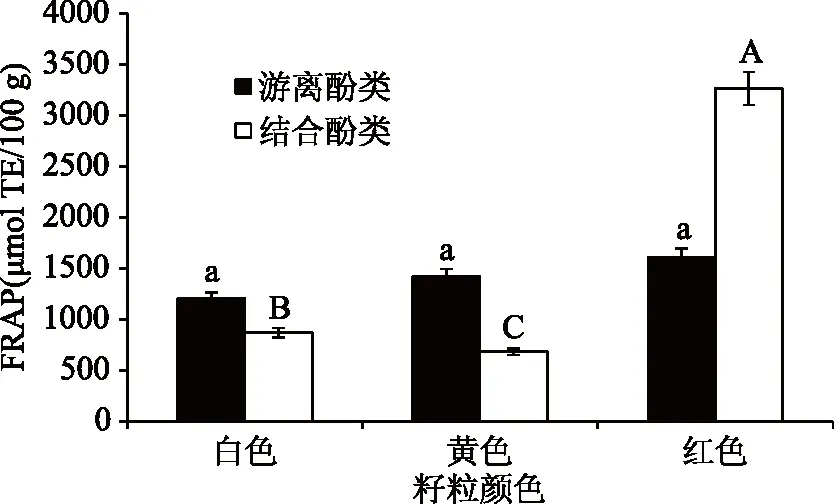
图4 不同粒色藜麦酚类物质FRAP还原力Fig.4 The FRAP ability of phenols in different colors of quinoa
2.3 青海不同藜麦资源聚类分析
2.3.1 不同藜麦酚类物质含量与抗氧化性相关性分析 由表4可知,参试90份藜麦的结合酚或结合黄酮含量与DPPH自由基清除能力和ABTS+·清除能力等指标呈极显著相关关系(P<0.01),说明结合态酚类物质含量高低与藜麦的DPPH·清除能力和ABTS+·清除能力密切相关。游离酚或游离黄酮含量与ABTS+·清除能力和FRAP铁还原能力等指标呈极显著或显著正相关关系(P<0.01或P<0.05),与DPPH·清除能力无显著相关性,说明游离态酚类化合物含量高低与其ABTS+·清除能力和FRAP铁还原能力大小密切相关。结合酚或结合黄酮含量与游离酚或游离黄酮之间呈现极显著或显著性负相关(P<0.01或P<0.05),结合酚与结合黄酮、游离酚与游离黄酮间均呈现极显著正相关性(P<0.01),表明藜麦中的多酚类物质含量越高,其所含黄酮含量就越高。
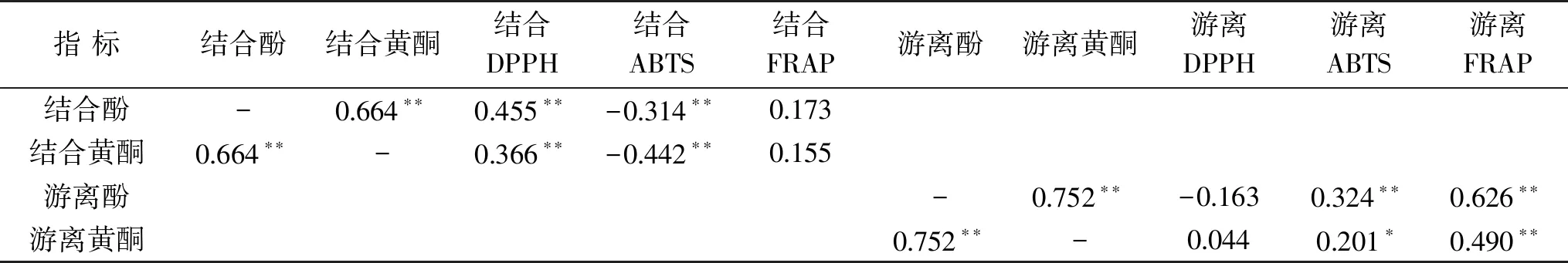
表4 不同藜麦酚类化合物含量与抗氧化性间的相关性分析Table 4 Correlation analysis between phenols content and antioxidant activity
2.3.2 不同藜麦资源聚类分析 对青海90份藜麦资源的酚类物质含量(游离酚、结合酚、游离黄酮、结合黄酮)和抗氧化活性等7个指标采用欧氏距离平方法和组间连接聚类法进行聚类分析(图5)。
结果显示,欧式距离为5处将参试藜麦资源划分为3类(表5),第I类共有79个藜麦资源,参试的藜麦资源大多部分都划分为此类,结合酚类物质含量较低,DPPH·清除力、ABTS+·清除力较弱,但FRAP铁还原力较强。第II类共有6个藜麦资源,结合酚类物质含量最高,抗氧化活性居中的一类。第III类共有5个藜麦资源,游离酚类和结合酚类含量居中,抗氧化活性表现最强的一类。此研究结果有利于对不同育种目标的藜麦资源开展进一步的筛选,为功能性藜麦新品种的选育提供依据。
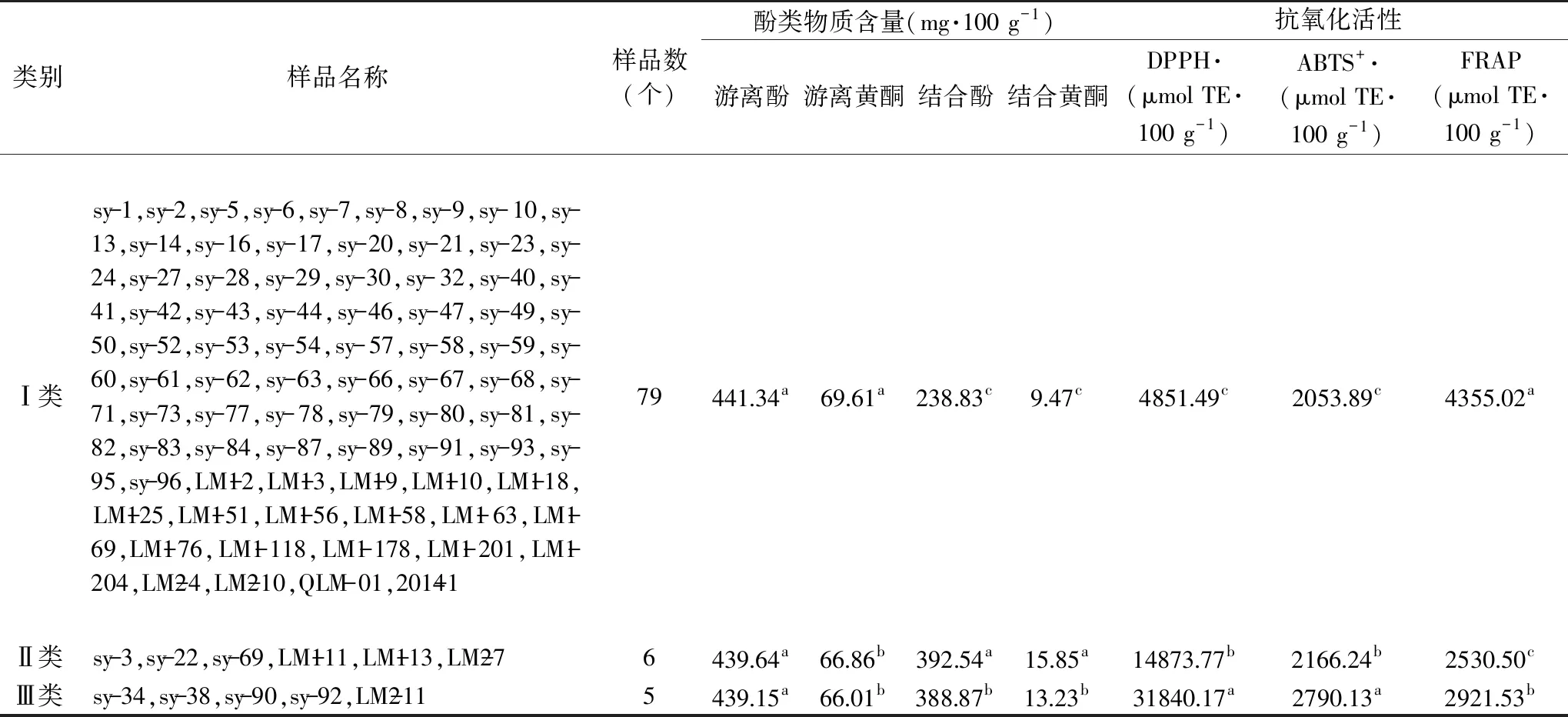
表5 青海不同藜麦资源化学成分含量和抗氧化活性的聚类结果Table 5 Clustering results of functional components content and antioxidant activities of different quinoas
3 结论
不同藜麦酚类化合物含量均存在较大差异,且不同藜麦资源结合酚类物质含量差异较大,游离酚类物质含量相对较小。有50%以上的藜麦结合黄酮含量高于平均值,sy-13、sy-28、LM1-118三个藜麦资源结合黄酮含量高达33.44、27.37、24.67 mg/100 g。53.78%藜麦的结合酚含量低于平均值,其中sy-13、sy-22、sy-28和sy-34四个藜麦资源结合酚含量高达634.33、607.98、646.58、647.42 mg/100 g。不同粒色藜麦之间游离酚类物质含量相对一致,结合酚类物质含量差异较大,变异系数均达到45%以上。红色藜麦的游离酚和游离黄酮含量最高,但结合酚类物质含量均最低。
抗氧化研究表明,藜麦中的酚类物质均具有较强的清除DPPH·自由基能力,结合酚类在清除DPPH·、ABTS+·、FRAP方面存在明显差异,结合酚类具有较强的清除DPPH·、ABTS+·能力,游离酚类在FRAP方面相对较强。红色藜麦的酚类物质FRAP铁还原力最强,白色和黄色藜麦的结合酚类清除DPPH·自由基能力、ABTS+·清除力最强。
聚类分析结果表明,参试的青海藜麦资源约有88%表现为结合酚类物质含量较低,DPPH·自由基清除力、ABTS+·自由基清除力较弱,但FRAP铁还原力较强。有6个藜麦资源表现为结合酚类物质含量最高,有5个藜麦资源表现为抗氧化活性表现最强。此结果为功能性藜麦新品种的选育提供了优质资源,对藜麦新品种的选育具有重要的指导意义。
